2.1.1 化学反应速率 课件(共20张PPT)化学(人教版)选择性必修1
文档属性
| 名称 | 2.1.1 化学反应速率 课件(共20张PPT)化学(人教版)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-06 14:34:36 | ||
图片预览








文档简介
(共20张PPT)
化学反应速率
化学(人教版)选择性必修1 第二章 第一节 第一课时
炸药的爆炸
溶洞的形成
如何衡量化学反应的快慢?
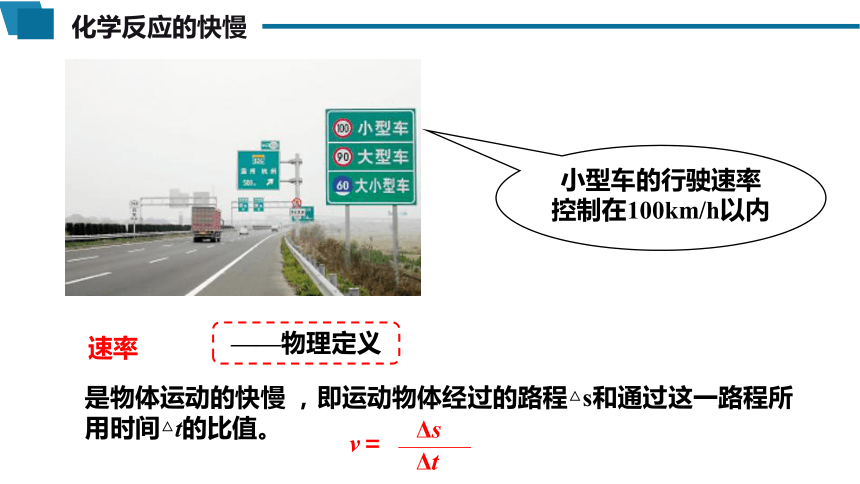
化学反应的快慢
化学反应的快慢
判断下列反应的快慢:
1.炸药爆炸
2.金属锈蚀
3.煤炭的形成
快
慢
慢
4.离子反应
5.塑料老化
6.牛奶变质
快慢慢
只能粗略地估计化学反应进行的快慢 (定性角度)
准确表示化学反应的快慢
需要统一的定量标准
化学反应的快慢
是物体运动的快慢 ,即运动物体经过的路程△s和通过这一路程所用时间△t的比值。
——物理定义
小型车的行驶速率控制在100km/h以内
v=
Δs
Δt
速率
1.定义:衡量化学反应进行快慢程度的物理量。
3.公式:
4.常用单位:
在容积不变的反应器中,通常用单位时间内反应物浓度的减小或生成物浓度的增加来表示 。
v =
mol/(L·s) 或 mol/(L·min)
化学反应速率
2.表示方法:
例题:在密闭容器中发生反应:N2+3H2=2NH3,开始时N2的浓度为0.8mol/L,5分钟后浓度变为0.7mol/L。此时△ c(N2)=___________,则v(N2)= ___________________。
问题1: 请计算△ c (H2)、 △ c (NH3)、v(H2)、v(NH3)。
0.02mol/(L·min)
v(H2)= 0.06mol/(L·min)
化学反应速率的计算
-0.1mol/L
v(NH3)=0.04mol/(L·min)
△ c (H2)= -0.3mol/L
△ c (NH3)= 0.2mol/L
问题2:v(N2)=0.02mol/(L·min)与v(H2)=0.06mol/(L·min)、v(NH3)=0.04 mol/(L· min)是否表示此反应的同一速率?
在同一反应体系中用不同的物质来表示反应速率时,其数值是可以不同的,但是这些数值都表示同一个反应速率。因此化学反应速率的表示必须说明用哪种物质来做标准。
用同一反应体系中不同物质表示同一速率时,速率之比=化学计量数之比=各物质浓度的变化量 (Δc)之比=各物质物质的量的变化量(Δn)之比。
问题3: △ c (N2)、 △ c (H2)、 △ c (NH3)三者的数值比为? v(N2)、 v(H2)、v(NH3)三者的数值比为?这与反应中各物质化学计量数有何关系?
化学反应速率的计算
△ c (N2): △ c (H2): △ c (NH3)= v(N2): v(H2):v(NH3)=1:3:2
【小结】化学反应速率表示时的注意点、规律。
(1)利用基本公式:v= = 。
(2)利用速率之比=化学计量数之比=各物质浓度的变化量 (Δc)之 比=各物质物质的量的变化量(Δn)之比。
(3)计算出的反应速率为平均速率。
(4)固体或纯液体的浓度为常数,Δc =0,不能用固体或纯液体表示反应速率。
化学反应速率的理解
1.在2 L容积不变容器中发生 N2+3H2 2NH3的反应。现通入0.8 mol H2 和 0.4 mol N2 ,2 min 后生成了0.12 mol NH3 ,求v (H2)、v (N2) 、v(NH3)。
随堂练习—化学反应速率的计算
【解法指导】 运用“三段式”法进行计算的步骤:
第一步:写出有关反应的化学方程式;
第二步:设未知数,列出各物质的起始量、转化量、某时刻量;
第三步:根据已知条件列方程式计算,得出各物质的转化浓度(Δc);
第四步:根据 计算反应速率。
随堂练习—化学反应速率的计算
①v= =
②A的转化率:α(A)=
起始浓度(mol/L) a b 0 0
转化浓度(mol/L) mx nx px qx
t时刻浓度(mol/L) a-mx b-nx px qx
mA(g)+nB(g)?? pC(g) + qD(g)
任意反应
模型认知:“三段式”计算模板
1.在2 L容积不变容器中发生 N2+3H2 2NH3的反应。现通入0.8 mol H2 和 0.4 mol N2 ,2 min 后生成了0.12 mol NH3 ,求v (H2)、v (N2) 、v(NH3)。
随堂练习—化学反应速率的计算
起始浓度(mol/L): 0.2 0.4 0
转化浓度(mol/L) : 0.03 0.09 0.06
2min浓度(mol/L) : 0.17 0.31 0.06
解: N2 + 3H2 2NH3
v (H2) = 0.045 mol/(L·min)
v(N2) = 0.015mol /(L·min)
v (NH3) = 0.03mol /(L·min)
2. 反应A + 3B == 2C + 2D在四种不同情况下的反应速率分别为
①v(A) = 0.15mol·L-1·s-1 ②v(B) = 0.6mol·L-1·s-1
③v(C) = 0.4mol·L-1·s-1 ④v(D) = 0.45mol·L-1·s-1
则该反应在不同条件下速率快慢顺序是 。
随堂练习—化学反应速率的计算
【解法指导】对于同一化学反应速率用不同物质表示的数值可能不同,但比较反应速率的大小不能只看数值的大小,而要进行一定的转化,具体比较方法如下:
(1)归一法:将不同物质的化学反应速率转化成同一物质的化学反应速率。
(2)比值法:比较同一物质化学反应速率的数值或分别除以相应物质的化学计量数之后的数值。数值越大,反应进行得越快。
④>②=③>①
3. 某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的量浓度分别为:c(X2)=0.4mol/L , c(Y2)=0.8mol/L ,c(Z)=0.4mol/L,则该反应的化学方程式可表示为__________________。
随堂练习—化学反应速率的计算
【解法指导】t min内,X2的物质的量浓度由1mol/L减小到0.4mol/L ,则Δc= -0.6 mol/L。Δc( Y2 )= 0.8 mol/L -1mol/L=-0.2 mol/L, Δc( z)= 0.4mol/L -0=0.4 mol/L, 反应方程式的浓度变化量之比等于化学计量数之比。故方程式可表示为
3X2 + Y2 = 2Z。
3X2 + Y2 = 2Z
课堂总结
“三段式”计算模板
1.下列关于化学反应速率的说法,不正确的是
A. 化学反应速率是衡量化学反应进行快慢程度的物理量
B. 单位时间内某物质的浓度变化大,则该物质反应就快
C. 化学反应速率可以用单位时间内生成某物质的质量的多少来表示
D. 化学反应速率常用单位有和
随堂练习—化学反应速率的计算
2. 在2L密闭容器中,发生3A(气)+B(气)=2C(气)的反应,若最初加入A和B都是4mol,A的平均反应速率为0.12mol/(L·s),则10秒钟后容器中含的B是
A. 1.6mol B. 2.8mol C. 3.2mol D. 3.6mol
随堂练习—化学反应速率的计算
3. 反应A(g)+3B(g) 2C(g)+ 2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是
A. v(C)= 0.04 mol /(L·s)
B. v(B)= 0.06 mol /(L·min)
C. v(A)= 0.15 mol /(L·min)
D. v(D) = 0.01 mol /(L·s)
随堂练习—化学反应速率的计算
4. 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
下列描述正确的是
A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B. 反应开始到10s,X的物质的量浓度减少了0.79mol/L
C. 反应开始到10s时,Y的转化率为79.0%
D. 反应的化学方程式为: X(g)+Y(g) Z(g)
随堂练习—化学反应速率的计算
5. 加入0.1mol MnO2粉末于50mL过氧化氢溶液(ρ=1.1g/mL)中,在标准状况下放出气体的体积和时间的关系如图所示:
(1) 反应放出3/4气体所需时间为____________。
(2) A、B、C、D各点反应速率快慢的顺序为___________________。
(3) 计算H2O2的初始物质的量浓度______________________。
(4) 求反应到2min时,H2O2的质量分数_______________。
随堂练习—化学反应速率的计算
1~4:C C A C
5. (1)2min
(2)
(3)
(4)
随堂练习参考答案
化学反应速率
化学(人教版)选择性必修1 第二章 第一节 第一课时
炸药的爆炸
溶洞的形成
如何衡量化学反应的快慢?
化学反应的快慢
化学反应的快慢
判断下列反应的快慢:
1.炸药爆炸
2.金属锈蚀
3.煤炭的形成
快
慢
慢
4.离子反应
5.塑料老化
6.牛奶变质
快慢慢
只能粗略地估计化学反应进行的快慢 (定性角度)
准确表示化学反应的快慢
需要统一的定量标准
化学反应的快慢
是物体运动的快慢 ,即运动物体经过的路程△s和通过这一路程所用时间△t的比值。
——物理定义
小型车的行驶速率控制在100km/h以内
v=
Δs
Δt
速率
1.定义:衡量化学反应进行快慢程度的物理量。
3.公式:
4.常用单位:
在容积不变的反应器中,通常用单位时间内反应物浓度的减小或生成物浓度的增加来表示 。
v =
mol/(L·s) 或 mol/(L·min)
化学反应速率
2.表示方法:
例题:在密闭容器中发生反应:N2+3H2=2NH3,开始时N2的浓度为0.8mol/L,5分钟后浓度变为0.7mol/L。此时△ c(N2)=___________,则v(N2)= ___________________。
问题1: 请计算△ c (H2)、 △ c (NH3)、v(H2)、v(NH3)。
0.02mol/(L·min)
v(H2)= 0.06mol/(L·min)
化学反应速率的计算
-0.1mol/L
v(NH3)=0.04mol/(L·min)
△ c (H2)= -0.3mol/L
△ c (NH3)= 0.2mol/L
问题2:v(N2)=0.02mol/(L·min)与v(H2)=0.06mol/(L·min)、v(NH3)=0.04 mol/(L· min)是否表示此反应的同一速率?
在同一反应体系中用不同的物质来表示反应速率时,其数值是可以不同的,但是这些数值都表示同一个反应速率。因此化学反应速率的表示必须说明用哪种物质来做标准。
用同一反应体系中不同物质表示同一速率时,速率之比=化学计量数之比=各物质浓度的变化量 (Δc)之比=各物质物质的量的变化量(Δn)之比。
问题3: △ c (N2)、 △ c (H2)、 △ c (NH3)三者的数值比为? v(N2)、 v(H2)、v(NH3)三者的数值比为?这与反应中各物质化学计量数有何关系?
化学反应速率的计算
△ c (N2): △ c (H2): △ c (NH3)= v(N2): v(H2):v(NH3)=1:3:2
【小结】化学反应速率表示时的注意点、规律。
(1)利用基本公式:v= = 。
(2)利用速率之比=化学计量数之比=各物质浓度的变化量 (Δc)之 比=各物质物质的量的变化量(Δn)之比。
(3)计算出的反应速率为平均速率。
(4)固体或纯液体的浓度为常数,Δc =0,不能用固体或纯液体表示反应速率。
化学反应速率的理解
1.在2 L容积不变容器中发生 N2+3H2 2NH3的反应。现通入0.8 mol H2 和 0.4 mol N2 ,2 min 后生成了0.12 mol NH3 ,求v (H2)、v (N2) 、v(NH3)。
随堂练习—化学反应速率的计算
【解法指导】 运用“三段式”法进行计算的步骤:
第一步:写出有关反应的化学方程式;
第二步:设未知数,列出各物质的起始量、转化量、某时刻量;
第三步:根据已知条件列方程式计算,得出各物质的转化浓度(Δc);
第四步:根据 计算反应速率。
随堂练习—化学反应速率的计算
①v= =
②A的转化率:α(A)=
起始浓度(mol/L) a b 0 0
转化浓度(mol/L) mx nx px qx
t时刻浓度(mol/L) a-mx b-nx px qx
mA(g)+nB(g)?? pC(g) + qD(g)
任意反应
模型认知:“三段式”计算模板
1.在2 L容积不变容器中发生 N2+3H2 2NH3的反应。现通入0.8 mol H2 和 0.4 mol N2 ,2 min 后生成了0.12 mol NH3 ,求v (H2)、v (N2) 、v(NH3)。
随堂练习—化学反应速率的计算
起始浓度(mol/L): 0.2 0.4 0
转化浓度(mol/L) : 0.03 0.09 0.06
2min浓度(mol/L) : 0.17 0.31 0.06
解: N2 + 3H2 2NH3
v (H2) = 0.045 mol/(L·min)
v(N2) = 0.015mol /(L·min)
v (NH3) = 0.03mol /(L·min)
2. 反应A + 3B == 2C + 2D在四种不同情况下的反应速率分别为
①v(A) = 0.15mol·L-1·s-1 ②v(B) = 0.6mol·L-1·s-1
③v(C) = 0.4mol·L-1·s-1 ④v(D) = 0.45mol·L-1·s-1
则该反应在不同条件下速率快慢顺序是 。
随堂练习—化学反应速率的计算
【解法指导】对于同一化学反应速率用不同物质表示的数值可能不同,但比较反应速率的大小不能只看数值的大小,而要进行一定的转化,具体比较方法如下:
(1)归一法:将不同物质的化学反应速率转化成同一物质的化学反应速率。
(2)比值法:比较同一物质化学反应速率的数值或分别除以相应物质的化学计量数之后的数值。数值越大,反应进行得越快。
④>②=③>①
3. 某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的量浓度分别为:c(X2)=0.4mol/L , c(Y2)=0.8mol/L ,c(Z)=0.4mol/L,则该反应的化学方程式可表示为__________________。
随堂练习—化学反应速率的计算
【解法指导】t min内,X2的物质的量浓度由1mol/L减小到0.4mol/L ,则Δc= -0.6 mol/L。Δc( Y2 )= 0.8 mol/L -1mol/L=-0.2 mol/L, Δc( z)= 0.4mol/L -0=0.4 mol/L, 反应方程式的浓度变化量之比等于化学计量数之比。故方程式可表示为
3X2 + Y2 = 2Z。
3X2 + Y2 = 2Z
课堂总结
“三段式”计算模板
1.下列关于化学反应速率的说法,不正确的是
A. 化学反应速率是衡量化学反应进行快慢程度的物理量
B. 单位时间内某物质的浓度变化大,则该物质反应就快
C. 化学反应速率可以用单位时间内生成某物质的质量的多少来表示
D. 化学反应速率常用单位有和
随堂练习—化学反应速率的计算
2. 在2L密闭容器中,发生3A(气)+B(气)=2C(气)的反应,若最初加入A和B都是4mol,A的平均反应速率为0.12mol/(L·s),则10秒钟后容器中含的B是
A. 1.6mol B. 2.8mol C. 3.2mol D. 3.6mol
随堂练习—化学反应速率的计算
3. 反应A(g)+3B(g) 2C(g)+ 2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是
A. v(C)= 0.04 mol /(L·s)
B. v(B)= 0.06 mol /(L·min)
C. v(A)= 0.15 mol /(L·min)
D. v(D) = 0.01 mol /(L·s)
随堂练习—化学反应速率的计算
4. 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
下列描述正确的是
A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B. 反应开始到10s,X的物质的量浓度减少了0.79mol/L
C. 反应开始到10s时,Y的转化率为79.0%
D. 反应的化学方程式为: X(g)+Y(g) Z(g)
随堂练习—化学反应速率的计算
5. 加入0.1mol MnO2粉末于50mL过氧化氢溶液(ρ=1.1g/mL)中,在标准状况下放出气体的体积和时间的关系如图所示:
(1) 反应放出3/4气体所需时间为____________。
(2) A、B、C、D各点反应速率快慢的顺序为___________________。
(3) 计算H2O2的初始物质的量浓度______________________。
(4) 求反应到2min时,H2O2的质量分数_______________。
随堂练习—化学反应速率的计算
1~4:C C A C
5. (1)2min
(2)
(3)
(4)
随堂练习参考答案
