1.1.2 反应热与焓变 课件(共24张PPT)化学(人教版)选择性必修1
文档属性
| 名称 | 1.1.2 反应热与焓变 课件(共24张PPT)化学(人教版)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-06 14:34:58 | ||
图片预览






文档简介
(共24张PPT)
反应热(第二课时)
化学(人教版)选择性必修1 第一章 第一节 第二课时
一、辨识化学反应中能量的转化
实例 原电池 暖宝宝 燃放烟花、燃气炉
能量转化 能转化成 能 能转化成 能 能转化成 能、 能
化学
电
化学
光
热
化学
热
常见的吸热反应和放热反应
放热
反应
吸热
反应
大多数化合反应
中和反应、
金属与酸(或水)的反应、
燃烧反应及缓慢氧化、
铝热反应等。
大多数分解反应,
碳和二氧化碳、碳和水的反应,Ba(OH)2·8H2O与铵盐的反应等,
NaHCO3与盐酸的反应
为什么化学反应会有能量的变化?
任务1
二、宏观角度认识反应热
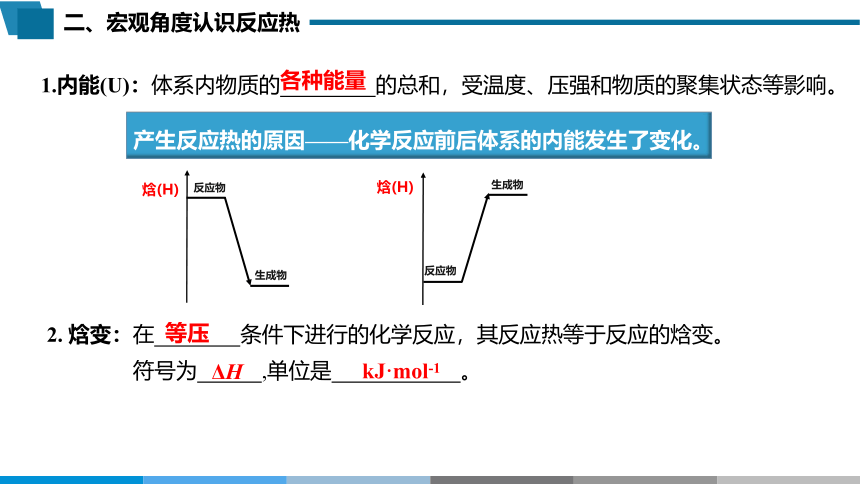
1.内能(U):体系内物质的 的总和,受温度、压强和物质的聚集状态等影响。
2. 焓变:在 条件下进行的化学反应,其反应热等于反应的焓变。
符号为 ,单位是 。
产生反应热的原因——化学反应前后体系的内能发生了变化。
等压
ΔH
kJ·mol-1
各种能量
内能(U)
焓(H)
反应物
生成物
内能(U)
反应物
生成物
焓(H)
二、宏观角度认识反应热
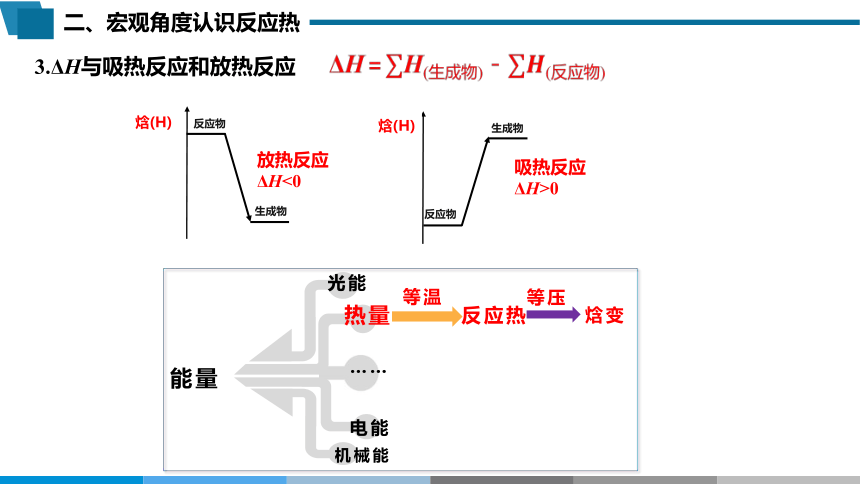
3.ΔH与吸热反应和放热反应
焓(H)
反应物
生成物
放热反应
ΔH<0
反应物
生成物
吸热反应
ΔH>0
焓(H)
能量
光能
热量
电能
机械能
……
等温
反应热
焓变
等压
二、宏观角度认识反应热
在25℃,101kPa下,1 mol H2与1 mol Cl2反应生成2 mol HCl,放出184.6 kJ的热量,该反应的反应热为
ΔH= -184.6 kJ·mol-1
在25℃,101kPa下,1 mol C 与1 mol H2O(g) 反应生成1 mol CO和1 mol H2,需要吸收131.5 kJ的热量,该反应的反应热为
ΔH= + 131.5 kJ·mol-1
注意:“+” 、 “-”不能省略!
化学反应能量是如何转化的?
任务2
为什么化学反应会有能量的变化?
三、微观角度理解反应热
键形成,释放能量
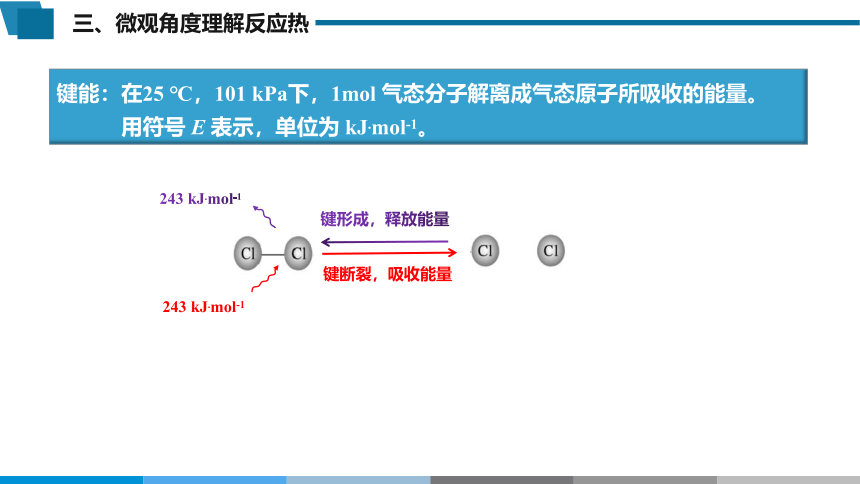
键能:在25 ℃,101 kPa下,1mol 气态分子解离成气态原子所吸收的能量。
用符号 E 表示,单位为 kJ.mol-1。
243 kJ.mol-1
键断裂,吸收能量
243 kJ.mol-1
以H2(g)+Cl2(g)===2HCl(g)反应的能量变化为例
化学键 反应中能量变化 断裂或形成1 mol 化学键的能量变化 断裂或形成化学
键的总能量变化
H—H 吸收 kJ 共吸收 kJ
Cl—Cl 吸收 kJ H—Cl 放出 kJ 共放出 kJ
H2(g)+Cl2(g)===2HCl(g)的反应热 ΔH= ________________ 436
243
679
431
862
-183 kJ·mol-1
结论:化学键的断裂和形成时的能量变化是化学反应中能量变化的主要原因。
+
+
实测值(ΔH= -184.6 kJ·mol-1)
三、微观角度理解反应热
【利用键能估算反应热】
反应热 ΔH= 。
E1 - E2
三、微观角度理解反应热
E1:反应物断裂化学键吸收的总能量,
E2:生成物形成化学键放出的总能量,
吸收能量 >放出能量 ΔH > 0
吸收能量 <放出能量 ΔH < 0
反应物
生成物
ΔH
E1
E2
H
【 利用键能估算反应热】
【例1】化学反应N2(g)+3H2(g) 2NH3(g)的能量变化如图所示:
已知N≡N、N—H的键能分别为946 kJ·mol-1、391 kJ·mol-1
(1)该反应为______反应(填“吸热”或“放热”)。
(2)拆开1 mol H2中化学键所需能量为______ kJ。
(3)该反应的反应热ΔH=______________。
放热
436
- 92 kJ·mol-1
ΔH=E(反应物键能)-E(生成物键能)
三、微观角度理解反应热
【例2】下列判断氢气燃烧生成气态水时的热量变化的说法中一定正确的是 ( )
A. 生成1 mol H2O(g)时吸收热量245 kJ
B. H2O(g)分解为H2与O2时放出热量
C. 氢气和氧气的总能量小于气态水的能量
D. 甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙
D
甲
乙
丙
ΔH<0
ΔH=436+249-930= -245 (kJ·mol-1)
总能量越低越稳定
反应放热,且用量未注明
学以致用
任务3
为什么化学反应会有能量的变化?
化学反应能量是如何转化的?
研究反应热的意义是什么?
热能综
合利用
工艺条
件优化
反应热应用
理论
分析
反应热估算
键能估算
能耗
……
给吸热反应加热;
给放热反应及时转移热量;
热能循环利用。
四、研究反应热的意义
学以致用
负 极:2Fe - 4e- = 2Fe2+
正 极: O2 + 4e- + 2H2O = 4OH-
总反应:2Fe + 2O2 + 2H2O = 2Fe(OH)2
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
铁粉的缓慢氧化放热,形成原电池加速氧化,利用蛭石材料保温。
小 结
反应热
本质原因:
宏观认识
反应前后内能的变化
微观理解
主要原因:
化学键的断裂与形成
ΔH=E(反应物键能)-E(生成物键能)
计 算:
焓变
表 征:
恒压反应热
研究意义
单位:kJ·mol-1
ΔH>0 反应吸热;ΔH<0反应放热
热能综合应用
工艺条件优化;理论研究
ΔH=H(生成物)-(反应物)
随堂练习
1.下列说法正确的是( )
A.化学变化中的能量变化都是化学能与热能间的相互转化
B.伴有能量变化的一定是化学反应
C.加热条件下发生的反应均为吸热反应
D.一个化学反应中,当反应物总焓大于生成物的总焓时,反应放热ΔH为负值
随堂练习
2.白磷和红磷分别与氧气反应生成1 mol P4O10(s)过程中焓变化如图,下列说法正确的是( )
A.红磷比白磷稳定
B.白磷燃烧是吸热反应
C.红磷转变为白磷是放热反应
D.红磷燃烧反应的:4P(s)+5O2(g)===P4O10(s) ΔH=-(E3-E2) kJ/mol
随堂练习
3. 在日常生活和学习中,我们经常接触到下列反应:
①化石燃料燃烧 ②强酸、强碱的中和反应 ③用C和H2O在高温下制水煤气
④锌和盐酸反应制氢气 ⑤氢氧化钡晶体和氯化铵晶体研磨放出氨气
⑥煅烧石灰石
其中焓变为负值的有________,焓变为正值的有________。
随堂练习
4.化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是( )
A. 该反应每生成2 mol AB(g)吸收b kJ热量
B. 反应热ΔH=+(a-b) kJ·mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A 和1 mol B—B放出 a kJ 能量
随堂练习
5. 根据下图所示的过程中的能量变化情况,判断下列说法正确的是( )
A.H2(g)转化为氢原子是一个放热过程
B.1 mol H2和1 mol Cl2的总能量比2 mol HCl的总能量高
C.1个HCl(g)分子中的化学键断裂时需要吸收431 kJ能量
D.2HCl(g)===H2(g)+Cl2(g)的反应热ΔH=-183 kJ·mol-1
随堂练习答案
01
02
03
04
D
B
B
A
05
①②④ ③⑤⑥
希望大家有所收获!
反应热(第二课时)
化学(人教版)选择性必修1 第一章 第一节 第二课时
一、辨识化学反应中能量的转化
实例 原电池 暖宝宝 燃放烟花、燃气炉
能量转化 能转化成 能 能转化成 能 能转化成 能、 能
化学
电
化学
光
热
化学
热
常见的吸热反应和放热反应
放热
反应
吸热
反应
大多数化合反应
中和反应、
金属与酸(或水)的反应、
燃烧反应及缓慢氧化、
铝热反应等。
大多数分解反应,
碳和二氧化碳、碳和水的反应,Ba(OH)2·8H2O与铵盐的反应等,
NaHCO3与盐酸的反应
为什么化学反应会有能量的变化?
任务1
二、宏观角度认识反应热
1.内能(U):体系内物质的 的总和,受温度、压强和物质的聚集状态等影响。
2. 焓变:在 条件下进行的化学反应,其反应热等于反应的焓变。
符号为 ,单位是 。
产生反应热的原因——化学反应前后体系的内能发生了变化。
等压
ΔH
kJ·mol-1
各种能量
内能(U)
焓(H)
反应物
生成物
内能(U)
反应物
生成物
焓(H)
二、宏观角度认识反应热
3.ΔH与吸热反应和放热反应
焓(H)
反应物
生成物
放热反应
ΔH<0
反应物
生成物
吸热反应
ΔH>0
焓(H)
能量
光能
热量
电能
机械能
……
等温
反应热
焓变
等压
二、宏观角度认识反应热
在25℃,101kPa下,1 mol H2与1 mol Cl2反应生成2 mol HCl,放出184.6 kJ的热量,该反应的反应热为
ΔH= -184.6 kJ·mol-1
在25℃,101kPa下,1 mol C 与1 mol H2O(g) 反应生成1 mol CO和1 mol H2,需要吸收131.5 kJ的热量,该反应的反应热为
ΔH= + 131.5 kJ·mol-1
注意:“+” 、 “-”不能省略!
化学反应能量是如何转化的?
任务2
为什么化学反应会有能量的变化?
三、微观角度理解反应热
键形成,释放能量
键能:在25 ℃,101 kPa下,1mol 气态分子解离成气态原子所吸收的能量。
用符号 E 表示,单位为 kJ.mol-1。
243 kJ.mol-1
键断裂,吸收能量
243 kJ.mol-1
以H2(g)+Cl2(g)===2HCl(g)反应的能量变化为例
化学键 反应中能量变化 断裂或形成1 mol 化学键的能量变化 断裂或形成化学
键的总能量变化
H—H 吸收 kJ 共吸收 kJ
Cl—Cl 吸收 kJ H—Cl 放出 kJ 共放出 kJ
H2(g)+Cl2(g)===2HCl(g)的反应热 ΔH= ________________ 436
243
679
431
862
-183 kJ·mol-1
结论:化学键的断裂和形成时的能量变化是化学反应中能量变化的主要原因。
+
+
实测值(ΔH= -184.6 kJ·mol-1)
三、微观角度理解反应热
【利用键能估算反应热】
反应热 ΔH= 。
E1 - E2
三、微观角度理解反应热
E1:反应物断裂化学键吸收的总能量,
E2:生成物形成化学键放出的总能量,
吸收能量 >放出能量 ΔH > 0
吸收能量 <放出能量 ΔH < 0
反应物
生成物
ΔH
E1
E2
H
【 利用键能估算反应热】
【例1】化学反应N2(g)+3H2(g) 2NH3(g)的能量变化如图所示:
已知N≡N、N—H的键能分别为946 kJ·mol-1、391 kJ·mol-1
(1)该反应为______反应(填“吸热”或“放热”)。
(2)拆开1 mol H2中化学键所需能量为______ kJ。
(3)该反应的反应热ΔH=______________。
放热
436
- 92 kJ·mol-1
ΔH=E(反应物键能)-E(生成物键能)
三、微观角度理解反应热
【例2】下列判断氢气燃烧生成气态水时的热量变化的说法中一定正确的是 ( )
A. 生成1 mol H2O(g)时吸收热量245 kJ
B. H2O(g)分解为H2与O2时放出热量
C. 氢气和氧气的总能量小于气态水的能量
D. 甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙
D
甲
乙
丙
ΔH<0
ΔH=436+249-930= -245 (kJ·mol-1)
总能量越低越稳定
反应放热,且用量未注明
学以致用
任务3
为什么化学反应会有能量的变化?
化学反应能量是如何转化的?
研究反应热的意义是什么?
热能综
合利用
工艺条
件优化
反应热应用
理论
分析
反应热估算
键能估算
能耗
……
给吸热反应加热;
给放热反应及时转移热量;
热能循环利用。
四、研究反应热的意义
学以致用
负 极:2Fe - 4e- = 2Fe2+
正 极: O2 + 4e- + 2H2O = 4OH-
总反应:2Fe + 2O2 + 2H2O = 2Fe(OH)2
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
铁粉的缓慢氧化放热,形成原电池加速氧化,利用蛭石材料保温。
小 结
反应热
本质原因:
宏观认识
反应前后内能的变化
微观理解
主要原因:
化学键的断裂与形成
ΔH=E(反应物键能)-E(生成物键能)
计 算:
焓变
表 征:
恒压反应热
研究意义
单位:kJ·mol-1
ΔH>0 反应吸热;ΔH<0反应放热
热能综合应用
工艺条件优化;理论研究
ΔH=H(生成物)-(反应物)
随堂练习
1.下列说法正确的是( )
A.化学变化中的能量变化都是化学能与热能间的相互转化
B.伴有能量变化的一定是化学反应
C.加热条件下发生的反应均为吸热反应
D.一个化学反应中,当反应物总焓大于生成物的总焓时,反应放热ΔH为负值
随堂练习
2.白磷和红磷分别与氧气反应生成1 mol P4O10(s)过程中焓变化如图,下列说法正确的是( )
A.红磷比白磷稳定
B.白磷燃烧是吸热反应
C.红磷转变为白磷是放热反应
D.红磷燃烧反应的:4P(s)+5O2(g)===P4O10(s) ΔH=-(E3-E2) kJ/mol
随堂练习
3. 在日常生活和学习中,我们经常接触到下列反应:
①化石燃料燃烧 ②强酸、强碱的中和反应 ③用C和H2O在高温下制水煤气
④锌和盐酸反应制氢气 ⑤氢氧化钡晶体和氯化铵晶体研磨放出氨气
⑥煅烧石灰石
其中焓变为负值的有________,焓变为正值的有________。
随堂练习
4.化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是( )
A. 该反应每生成2 mol AB(g)吸收b kJ热量
B. 反应热ΔH=+(a-b) kJ·mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A 和1 mol B—B放出 a kJ 能量
随堂练习
5. 根据下图所示的过程中的能量变化情况,判断下列说法正确的是( )
A.H2(g)转化为氢原子是一个放热过程
B.1 mol H2和1 mol Cl2的总能量比2 mol HCl的总能量高
C.1个HCl(g)分子中的化学键断裂时需要吸收431 kJ能量
D.2HCl(g)===H2(g)+Cl2(g)的反应热ΔH=-183 kJ·mol-1
随堂练习答案
01
02
03
04
D
B
B
A
05
①②④ ③⑤⑥
希望大家有所收获!
