7.3.1 溶液浓稀的表示-2022-2023学年九年级化学下册同步精品课件(科粤版)
文档属性
| 名称 | 7.3.1 溶液浓稀的表示-2022-2023学年九年级化学下册同步精品课件(科粤版) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-09 15:46:49 | ||
图片预览





文档简介
(共17张PPT)
课前读
1. 固体溶解度是指在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量。
2. 固体物质溶解度的影响因素:① 溶质和溶剂的性质;② 温度(大多数物质来说,温度升高,溶解度增大)。
3. 气体溶解度是指该气体在压强为101.3KPa, 一定温度时溶解在1体积水里达到饱和状态时的气体体积。
4. 气体的溶解度与温度、压强有关。温度越高,溶解度越小;压强越大,溶解度越大。
【实验7-8】在室温下,向三个小烧杯中各加入20mL水,然后分别加入0.1g、0.5g、2g无水硫酸铜,用玻璃棒搅拌,使硫酸铜全部溶解,比较三种硫酸铜溶液。 在这三种溶液中,哪种溶液最浓?哪种溶液最稀?你判断的依据是什么?
观察思考
第七章 溶液
7.3 溶液浓稀的表示
第一课时 溶质质量分数及计算
一、溶质的质量分数
1. 定义:溶质的质量与溶液的质量之比,以百分数表示。
① 用百分数表示,一般与温度无关;
② 溶质的质量分数为10%的含义是每100份质量的溶液
中含溶质质量为10份。
溶质质量
溶液质量
×100%
溶质的质量分数=
2. 计算公式
或=
溶质质量
溶质质量+溶剂质量
×100%
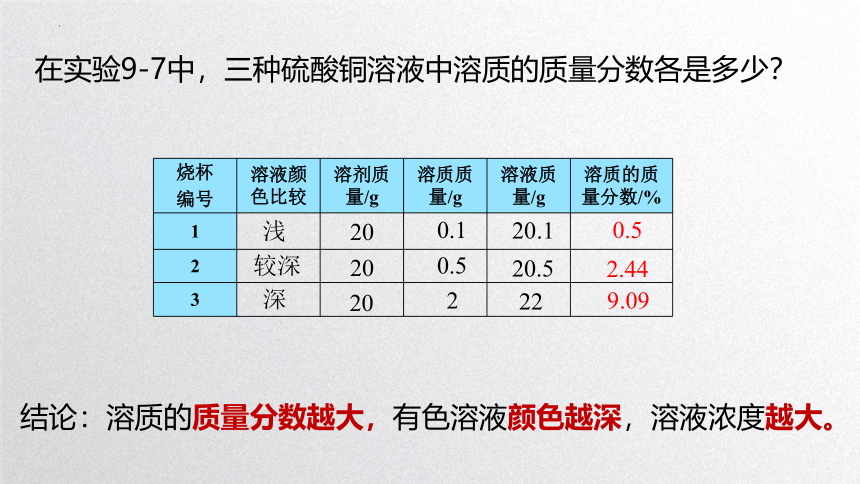
烧杯 编号 溶液颜色比较 溶剂质量/g 溶质质量/g 溶液质量/g 溶质的质量分数/%
1
2
3
浅
较深
深
20
20
20
0.1
0.5
2
20.1
20.5
22
在实验9-7中,三种硫酸铜溶液中溶质的质量分数各是多少?
0.5
2.44
9.09
结论:溶质的质量分数越大,有色溶液颜色越深,溶液浓度越大。
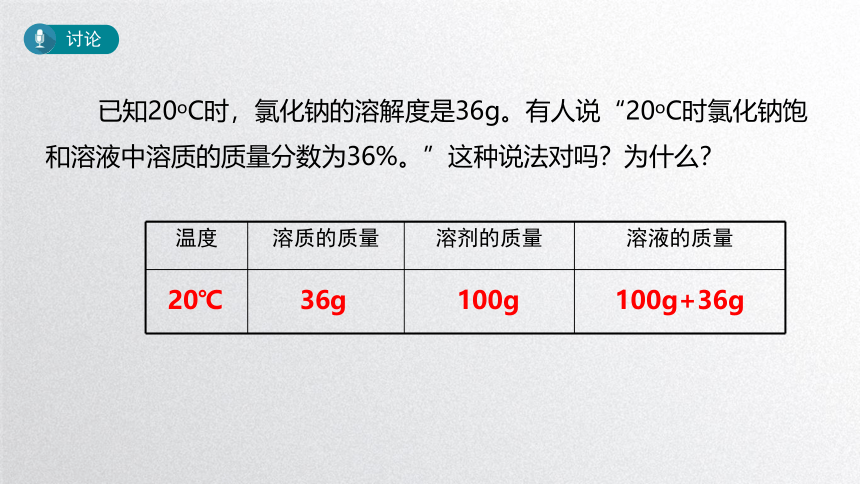
讨论
已知20oC时,氯化钠的溶解度是36g。有人说“20oC时氯化钠饱和溶液中溶质的质量分数为36%。”这种说法对吗?为什么?
温度 溶质的质量 溶剂的质量 溶液的质量
20℃
36g
100g
100g+36g
区别 溶解度 溶质的质量分数
概念 一定温度时,100g溶剂中最多溶解溶质的质量 (饱和) 任意溶液中,溶质质量与溶液质量之比
表示意义 某物质溶解能力的大小 任一溶液的浓度大小
条件 一定温度 不定温度
状态 饱和状态 可饱和,可不饱和
单位 g 无单位
饱和溶液中的
溶质的质量分数
溶解度S
100g+溶解度S
=
一定温度,某物质的饱和溶液质量分数相等,且溶解度越大,饱和溶液的质量分数就越大。
溶解度曲线图上溶液质量分数的判断
饱和溶液升降温分析
① a点溶液,t1→t2,溶解度增大,此时溶液变为________(填“饱和”或“不饱和”),溶液中溶质质量分数_________(填“大于、小于或不变”)。
② b点溶液,t2→t1,降低温度,溶解度减小,此时现象是__________,溶液变为________(同①),溶液中溶质质量分数_________(同①)。
2. 将溶液c → b,有2种方式。
①___________,溶质质量分数_________
②_________,溶质质量分数_______
不饱和
不变
有晶体析出
饱和
减小
增加溶质
恒温
蒸发溶剂
增大
增大
移点法巧解饱和溶液升降温质量分数题
t2℃时,分别将a、b、c的饱和溶液降温至t1℃,溶质质量分数关系是______________。
课堂练习
将50℃时A、B、C的饱和溶液降温至30℃,所得溶液的溶质质量分数:__________________。
t1℃时,将甲、乙饱和溶液分别升温至t2℃,两溶液中溶质质量分数:___________。
溶质的质量分数的简单计算
例1:在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
解:
溶质质量
溶液质量
溶质的质量分数 =
X 100%
溶质质量 =
溶液质量
X 溶质的质量分数 = 150kg X 16%=24kg
答: 配制150kg质量分数为16%的氯化钠溶液需24 kg氯化钠和126 kg水。
溶剂质量 =
溶液质量
— 溶质的质量 = 150kg — 24kg = 126kg
注意:
①溶质的质量:必须是溶解的那部分溶质,不溶解的固体质量不计。
②溶液的质量 = 溶质的质量 + 溶剂的质量。
③计算时上下质量单位要统一。
④不要忘记×100%,最后得到百分数。
溶液稀释问题的计算
稀释方式 计算依据
加水稀释 加水稀释前后,溶液中溶质的质量不变
加稀溶液稀释 加稀溶液稀释时,稀溶液中溶质的质量与浓溶液中溶质的质量之和等于混合后溶液中溶质的质量
例2:化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要水的质量是多少?
溶液浓缩问题的计算
浓缩方式 计算依据
添加溶质 原溶液中的溶质与后加入的溶质质量之和等于混合后溶液中的溶质质量
蒸发溶剂 蒸发溶剂前后溶液中溶质的质量不变
加入浓溶液 原溶液中的溶质与后加入浓溶液中的溶质质量之和等于混合后溶液中的溶质质量
例3:现有100g溶质质量分数为10%的食盐溶液,若使溶液的溶质质量分数变为20%,应蒸发掉多少克水?
答:蒸发掉的水的质量为50g。
解:设蒸发掉的水的质量为x。
x =50g
100g×10%
= 20%
100g-x
×100%
将溶质的质量分数运用于化学方程式的计算
例4: 100g某硫酸溶液恰好与13g锌完全反应,试计算这种硫酸中溶质的质量分数。
解:设这种硫酸中溶质的质量为x。
Zn + H2SO4 = ZnSO4 + H2↑
65 98
13g x
13g x
65 98
x = 19.6 g
溶质的质量分数 = × 100% =19.6%
19.6g
100g
答:这种硫酸溶液中溶质的质量分数为19.6%。
体积分数也是一种表示溶液组成的方法。
资料卡片
课前读
1. 固体溶解度是指在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量。
2. 固体物质溶解度的影响因素:① 溶质和溶剂的性质;② 温度(大多数物质来说,温度升高,溶解度增大)。
3. 气体溶解度是指该气体在压强为101.3KPa, 一定温度时溶解在1体积水里达到饱和状态时的气体体积。
4. 气体的溶解度与温度、压强有关。温度越高,溶解度越小;压强越大,溶解度越大。
【实验7-8】在室温下,向三个小烧杯中各加入20mL水,然后分别加入0.1g、0.5g、2g无水硫酸铜,用玻璃棒搅拌,使硫酸铜全部溶解,比较三种硫酸铜溶液。 在这三种溶液中,哪种溶液最浓?哪种溶液最稀?你判断的依据是什么?
观察思考
第七章 溶液
7.3 溶液浓稀的表示
第一课时 溶质质量分数及计算
一、溶质的质量分数
1. 定义:溶质的质量与溶液的质量之比,以百分数表示。
① 用百分数表示,一般与温度无关;
② 溶质的质量分数为10%的含义是每100份质量的溶液
中含溶质质量为10份。
溶质质量
溶液质量
×100%
溶质的质量分数=
2. 计算公式
或=
溶质质量
溶质质量+溶剂质量
×100%
烧杯 编号 溶液颜色比较 溶剂质量/g 溶质质量/g 溶液质量/g 溶质的质量分数/%
1
2
3
浅
较深
深
20
20
20
0.1
0.5
2
20.1
20.5
22
在实验9-7中,三种硫酸铜溶液中溶质的质量分数各是多少?
0.5
2.44
9.09
结论:溶质的质量分数越大,有色溶液颜色越深,溶液浓度越大。
讨论
已知20oC时,氯化钠的溶解度是36g。有人说“20oC时氯化钠饱和溶液中溶质的质量分数为36%。”这种说法对吗?为什么?
温度 溶质的质量 溶剂的质量 溶液的质量
20℃
36g
100g
100g+36g
区别 溶解度 溶质的质量分数
概念 一定温度时,100g溶剂中最多溶解溶质的质量 (饱和) 任意溶液中,溶质质量与溶液质量之比
表示意义 某物质溶解能力的大小 任一溶液的浓度大小
条件 一定温度 不定温度
状态 饱和状态 可饱和,可不饱和
单位 g 无单位
饱和溶液中的
溶质的质量分数
溶解度S
100g+溶解度S
=
一定温度,某物质的饱和溶液质量分数相等,且溶解度越大,饱和溶液的质量分数就越大。
溶解度曲线图上溶液质量分数的判断
饱和溶液升降温分析
① a点溶液,t1→t2,溶解度增大,此时溶液变为________(填“饱和”或“不饱和”),溶液中溶质质量分数_________(填“大于、小于或不变”)。
② b点溶液,t2→t1,降低温度,溶解度减小,此时现象是__________,溶液变为________(同①),溶液中溶质质量分数_________(同①)。
2. 将溶液c → b,有2种方式。
①___________,溶质质量分数_________
②_________,溶质质量分数_______
不饱和
不变
有晶体析出
饱和
减小
增加溶质
恒温
蒸发溶剂
增大
增大
移点法巧解饱和溶液升降温质量分数题
t2℃时,分别将a、b、c的饱和溶液降温至t1℃,溶质质量分数关系是______________。
课堂练习
将50℃时A、B、C的饱和溶液降温至30℃,所得溶液的溶质质量分数:__________________。
t1℃时,将甲、乙饱和溶液分别升温至t2℃,两溶液中溶质质量分数:___________。
溶质的质量分数的简单计算
例1:在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
解:
溶质质量
溶液质量
溶质的质量分数 =
X 100%
溶质质量 =
溶液质量
X 溶质的质量分数 = 150kg X 16%=24kg
答: 配制150kg质量分数为16%的氯化钠溶液需24 kg氯化钠和126 kg水。
溶剂质量 =
溶液质量
— 溶质的质量 = 150kg — 24kg = 126kg
注意:
①溶质的质量:必须是溶解的那部分溶质,不溶解的固体质量不计。
②溶液的质量 = 溶质的质量 + 溶剂的质量。
③计算时上下质量单位要统一。
④不要忘记×100%,最后得到百分数。
溶液稀释问题的计算
稀释方式 计算依据
加水稀释 加水稀释前后,溶液中溶质的质量不变
加稀溶液稀释 加稀溶液稀释时,稀溶液中溶质的质量与浓溶液中溶质的质量之和等于混合后溶液中溶质的质量
例2:化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要水的质量是多少?
溶液浓缩问题的计算
浓缩方式 计算依据
添加溶质 原溶液中的溶质与后加入的溶质质量之和等于混合后溶液中的溶质质量
蒸发溶剂 蒸发溶剂前后溶液中溶质的质量不变
加入浓溶液 原溶液中的溶质与后加入浓溶液中的溶质质量之和等于混合后溶液中的溶质质量
例3:现有100g溶质质量分数为10%的食盐溶液,若使溶液的溶质质量分数变为20%,应蒸发掉多少克水?
答:蒸发掉的水的质量为50g。
解:设蒸发掉的水的质量为x。
x =50g
100g×10%
= 20%
100g-x
×100%
将溶质的质量分数运用于化学方程式的计算
例4: 100g某硫酸溶液恰好与13g锌完全反应,试计算这种硫酸中溶质的质量分数。
解:设这种硫酸中溶质的质量为x。
Zn + H2SO4 = ZnSO4 + H2↑
65 98
13g x
13g x
65 98
x = 19.6 g
溶质的质量分数 = × 100% =19.6%
19.6g
100g
答:这种硫酸溶液中溶质的质量分数为19.6%。
体积分数也是一种表示溶液组成的方法。
资料卡片
