第八单元 海水中的化学 复习与测试-2022-2023学年九年级化学下册同步精品课堂(鲁教版)
文档属性
| 名称 | 第八单元 海水中的化学 复习与测试-2022-2023学年九年级化学下册同步精品课堂(鲁教版) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-09 15:49:48 | ||
图片预览






文档简介
(共24张PPT)
单元复习与测试
第八单元 海水中的化学
PART
01
PART
02
了解海水及海底蕴含的主要物质,知道海水制镁及淡化海水常用的方法。
知道蒸发结晶是海水晒盐的基本原理,了解食盐的用途和工业上精制食盐的方法。
学习目标
PART
03
认识纯碱等盐类物质的重要性质。
PART
04
知道工业制取纯碱的化学反应原理,了解纯碱在日常生活或工农业生产中的应用。
构建知识体系
一、海洋资源的综合利用
【答案速填】
一、①MgCl2+Ca(OH)2====
Mg(OH)2↓+CaCl2
②Mg(OH)2+2HCl====MgCl2+2H2O
③MgCl2====Mg+Cl2↑
④可燃冰 ⑤蒸发
⑥降温 ⑦溶解
⑧过滤 ⑨蒸发
⑩NaCl+NH3+CO2+H2O====NaHCO3+NH4Cl
2NaHCO3====Na2CO3+CO2↑+H2O
【答案速填】二、①酸碱指示剂
②Na2CO3+2HCl====2NaCl+H2O+CO2↑ ③Na2CO3+Ca(OH)2====CaCO3↓+2NaOH
④Na2CO3+BaCl2====BaCO3↓+2NaCl ⑤有沉淀生成 ⑥有气体生成 ⑦有水生成
二、盐的性质
主题一 海洋资源的综合利用
【主题训练1】 (2022北京)海水是宝贵的自然资源,从海水中提取食盐的主要过程如下图。
(1)食盐的主要成分
是______________。
(2)蒸发池中,水蒸发属于______________(填“物理”或“化学”)变化。
(3)下列是去除粗盐中难溶性杂质的操作,正确的顺序是______________(填序号)。
A. 过滤 B. 溶解 C. 蒸发
氯化钠
物理
BAC
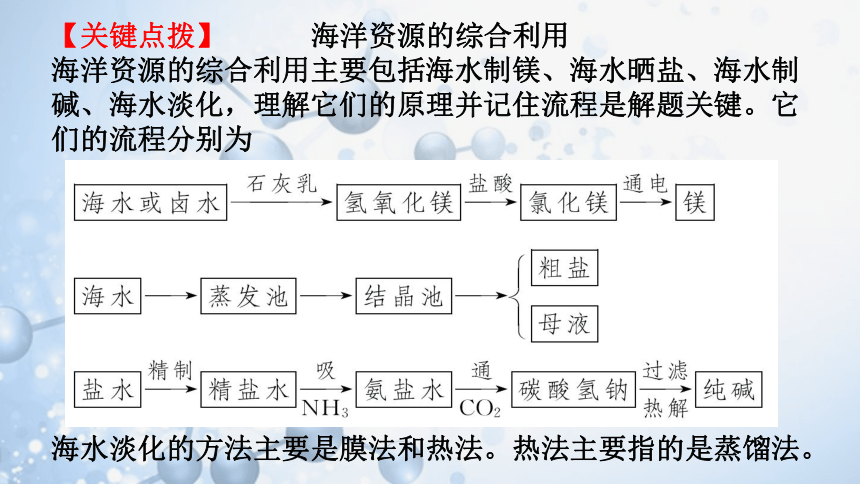
【关键点拨】 海洋资源的综合利用
海洋资源的综合利用主要包括海水制镁、海水晒盐、海水制碱、海水淡化,理解它们的原理并记住流程是解题关键。它们的流程分别为
海水淡化的方法主要是膜法和热法。热法主要指的是蒸馏法。
【真题体验】
1.(2022长春)关于“粗盐中难溶性杂质的去除”实验,下列说法错误的是( )
A. 溶解:为加快粗盐的溶解,可预先将粗盐研细
B. 过滤:过滤食盐水时,需用玻璃棒引流
C. 蒸发:蒸发皿中的水蒸干后,停止加热
D. 分析:粗盐未完全溶解就过滤,则得到的精盐偏少
B
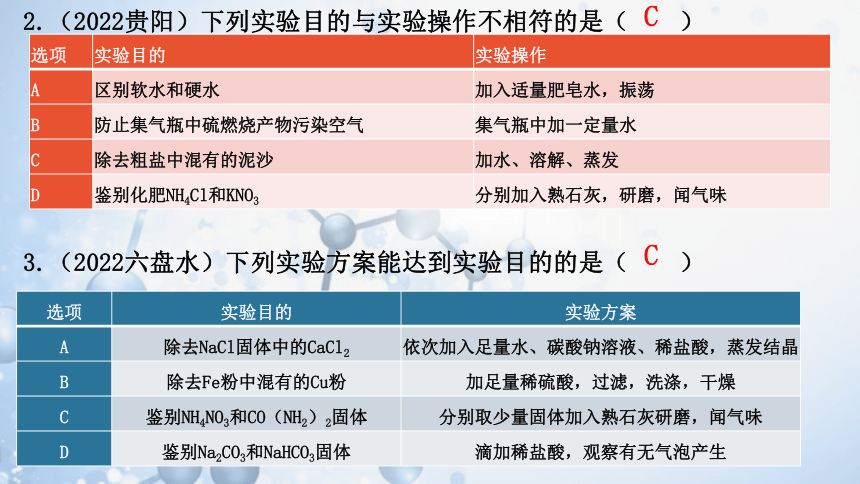
2.(2022贵阳)下列实验目的与实验操作不相符的是( )
3.(2022六盘水)下列实验方案能达到实验目的的是( )
C
C
选项 实验目的 实验操作
A 区别软水和硬水 加入适量肥皂水,振荡
B 防止集气瓶中硫燃烧产物污染空气 集气瓶中加一定量水
C 除去粗盐中混有的泥沙 加水、溶解、蒸发
D 鉴别化肥NH4Cl和KNO3 分别加入熟石灰,研磨,闻气味
选项 实验目的 实验方案
A 除去NaCl固体中的CaCl2 依次加入足量水、碳酸钠溶液、稀盐酸,蒸发结晶
B 除去Fe粉中混有的Cu粉 加足量稀硫酸,过滤,洗涤,干燥
C 鉴别NH4NO3和CO(NH2)2固体 分别取少量固体加入熟石灰研磨,闻气味
D 鉴别Na2CO3和NaHCO3固体 滴加稀盐酸,观察有无气泡产生
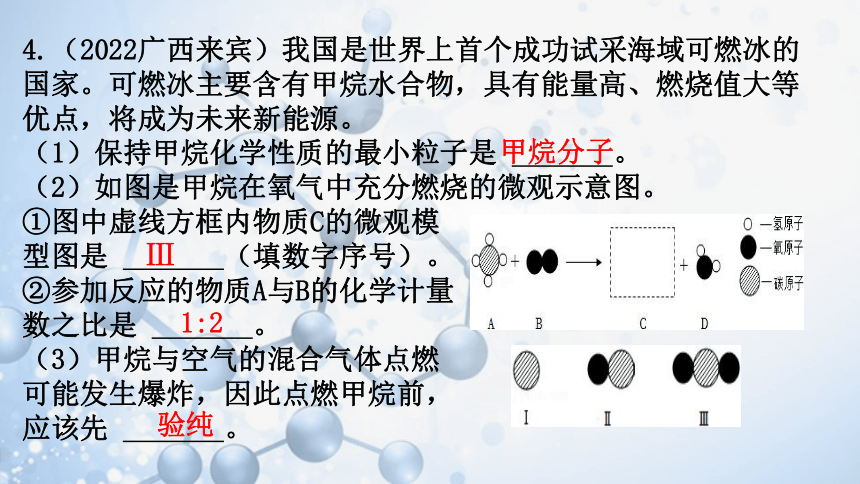
4.(2022广西来宾)我国是世界上首个成功试采海域可燃冰的国家。可燃冰主要含有甲烷水合物,具有能量高、燃烧值大等优点,将成为未来新能源。
(1)保持甲烷化学性质的最小粒子是 。
(2)如图是甲烷在氧气中充分燃烧的微观示意图。
①图中虚线方框内物质C的微观模
型图是 (填数字序号)。
②参加反应的物质A与B的化学计量
数之比是 。
(3)甲烷与空气的混合气体点燃
可能发生爆炸,因此点燃甲烷前,
应该先 。
甲烷分子
Ⅲ
1:2
验纯
5.(2022鞍山)阅读下面科普短文。
海洋是巨大的资源宝库
【材料1】海洋蕴含着丰富的油气资源。我国南海中南部油气地质资源量占我国总储量的53%,可采资源量占66%。西沙群岛、中沙群岛的水下有上千米的新生代沉积物,是大有希望的海底石油和天然气产地。天然气主要成分甲烷的含碳量相对较少,燃烧较完全,燃烧产生的二氧化碳比起煤和石油制品相对较少,通常被称为“清洁能源”。
【材料2】海洋是化学资源宝库,含有80多种元素,钠和氯是其中含量较高的元素。海水中存在大量的氯化钠、氯化镁、氯化钙等盐类物质,生活中的食盐主要来自海洋。
【材料3】海洋是能力出众的“捕碳者”。海洋约占地球表面积的71%,这个庞大的碳库储碳量是陆地的20倍、大气的50倍。自工业革命以来,人类产生的二氧化碳有大约48%被海水吸收。
(节选自《知识就是力量》)
回答下列问题:
(1)石油是_________________(填“可再生”或“不可再生”)能源。
(2)甲烷充分燃烧的化学方程式是_________________。
(3)工业上从海水中获得粗盐的结晶方法是_________________。
(4)海洋作为“捕碳者”可以有效缓解的环境问题是_________________。
不可再生
CH4+2O2点燃CO2+2H2O
蒸发结晶
温室效应
主题二 盐的性质
【主题训练2】(2022丹东)下列是化学兴趣小组的同学进行粗盐提纯的实验,请你帮助回答相关问题。
【实验一】除去粗盐中难溶性杂质
溶解:在溶解过程中,用玻璃棒不断搅拌的目的是 。
过滤:漏斗下端管口应紧靠 ;若滤纸未紧贴漏斗壁,会导致 。
得到的滤液M中还含有可溶性杂质CaCl2和MgCl2。
【实验二】除去滤液M中的可溶性杂质CaCl2和MgCl2(温馨提示:氢氧化镁不溶于水)
步骤1:向滤液M中加入过量的NaOH溶液,
充分反应后过滤。该反应的基本反应类
型是 ,所得溶液A中含有
的金属离子有 。
步骤2:向溶液A中加入过量某溶液,充
分反应后过滤。发生反应的化学方程式为 。
步骤3: 。
加快粗盐的溶解速率
烧杯内壁
过滤速度慢
复分解反应
Ca2+、Na+
Na2CO3+CaCl2=CaCO3↓+2NaCl
向溶液B中加入适量的稀盐酸,后蒸发结晶
【关键点拨】
盐的性质释疑
(1)因盐不像酸、碱那样能解离出共同的阳离子或阴离子,因
此,盐无化学通性,但盐都是由金属离子(铵盐除外)和酸根离
子构成,因此,盐在化学性质方面存在相似性。
(2)KNO3、NaNO3一般不参与复分解反应。
(3)在初中阶段,难溶性盐主要参与以下两类反应。
①与酸反应:CaCO3+2HCl====CaCl2+H2O+CO2↑。
②部分难溶性盐受热或高温易分解,如CaCO3 高温 CaO+CO2↑。
【真题体验】
1.(2022柳州)下列常见物质的俗名与化学式不相符的是( )
A.水银﹣H2O B.纯碱﹣Na2CO3
C.生石灰﹣CaO D.烧碱﹣NaOH
2.(2022益阳)侯德榜是我国著名的化学家,发明了侯氏制碱法,为纯碱(Na2CO3)和氮肥工业技术的发展作出了杰出的贡献。其中纯碱(Na2CO3)属于( )
A.酸 B.碱 C.盐 D.氧化物
3.(2022汉中)碳酸氢钠(NaHCO3)是焙制糕点所用发酵粉的主要成分之一,下列有关说法正确的是( )
A.NaHCO3中的阳离子为Na+2 B.NaHCO3中碳元素的化合价为+2价
C.氧原子的结构示意图为 D.NaHCO3中含有一种金属元素
A
D
C
3.(2022河南节选)食盐(主要成分是NaCl)除可用作调味品外,还是一种重要化工原料。晾晒海水所得到的粗盐中含有不溶性杂质(泥沙)和可溶性杂质(CaCl2、MgCl2、Na2SO4).下图是某化学小组在实验室对粗盐样品进行除杂提纯的过程。
①溶解、过滤、蒸发的操作中
都需要用到的一种玻璃仪器为
(填“烧
杯”“漏斗”或“玻璃棒”)。
②固体甲中所含有的难溶性
物质为BaSO4、 、CaCO3和BaCO3。
③请设计实验验证溶液乙中所含有的杂质。(简要叙述实验步骤及现象)。
玻璃棒
Mg(OH)2
取少取溶液于试管中,加入足量的氯化钡溶液,有白色沉淀产生,静置,取上层清液,滴加几滴无色酚酞溶液,溶液变红
4.(2022来宾)纯碱是一种重要的化工原料,广泛用于玻璃、造纸、纺织和洗涤剂的生产。某化学兴趣小组对纯碱的制备、性质及用途等开展项目式学习。
任务一:了解纯碱的制备——“侯氏制碱法”
“侯氏制碱法”主要化学原理是利用饱和氯化钠溶液吸收两种气体,生成碳酸氢钠和氯化铵(NH4Cl),再加热碳酸氢钠即可制得纯碱。
(1)纯碱属于 (填“酸”“碱”或“盐”)。
(2)饱和氯化钠溶液吸收的两种气体是 (填字母序号)。A.Cl2 B.NH3 C.SO2 D.CO2
任务二:探究纯碱的性质——Na2CO3溶液呈碱性
【查阅资料】①溶液呈碱性,是因为溶液中存在较多的OH﹣。
②Na2CO3在水中全部解离出Na+和CO32﹣。
③CaCl2溶液呈中性,Ca2+、Cl﹣对溶液的酸碱性没有影响。
【提出猜想】猜想一:H2O单独起作用,产生较多的OH﹣,使溶液呈碱性。
猜想二:Na+与H2O作用,产生较多的OH﹣,使溶液呈碱性。
猜想三: 。
BD
盐
碳酸根离子和水作用,产生较多的OH﹣,使溶液呈碱性
【实验探究】
【解释与结论】同学们和老师交流,得知CO32﹣和H2O作用,产生较多的OH﹣和另一种阴离子。
【拓展与延伸】结合任务二的所有信息和结论,运用初中化学所学知识,经过分析推理可得出:Na2CO3溶液中含有的阴离子是 。
实验操作 实验现象 实验结论
(1)向试管中加入一定量的蒸馏水,滴入2滴酚酞溶液 溶液无明显变化 猜想一不成立
(2)向试管中加入一定量的NaCl溶液,滴入2滴酚酞溶液 溶液无明显变化 猜想二不成立
(3)①向试管中加入一定量的Na2CO3溶液,滴入2滴酚酞溶液 ②往①所得溶液中逐滴加入CaCl2溶液至过量 ①溶液由无色变红色 ② 。 猜想三成立
产生白色沉淀,溶液红色消失
CO32﹣、OH﹣
任务三 探究纯碱的用途——用于生产洗涤剂
【查阅资料】Na2CO3可用于生产洗涤剂。Na2CO3溶液呈碱性,可清洗油污,溶液碱性越强,去油污效果越好。
【实验探究】兴趣小组继续对影响Na2CO3溶液去油污效果的因素进行探究。
用不同温度的水,配制溶质质量分数分别为2%、6%和10%的Na2CO3溶液,并测定溶液pH,记录数据如表:
实验编号 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨
溶质质量分数 2% 2% 2% 6% 6% 6% 10% 10% 10%
溶液温度(℃) 20 40 60 20 50 60 20 40 70
溶液pH 10.90 11.18 11.26 11.08 11.27 11.30 11.22 11.46 11.50
【解释与结论】(1)实验①、②、③对比,可得出的结论是 。
(2)要证明Na2CO3溶液的溶质质量分数变化与pH变化关系,可选择的3个实验的编号是 。
【拓展与应用】下列物质可用于去油污的是 (填字母序号)。
A.NaCl B.NaOH C.K2CO3 D.CaCO3
温度越高,碳酸钠溶液碱性越强
①④⑦
BC
主题三 复分解反应的应用
【主题训练3】(2022襄阳)下列各组物质在溶液中能大量共存的是( )
A.MgCl2、NaOH、(NH4)2SO4 B.Ba(OH)2、KNO3、NaCl
C.NaOH、H2SO4、Ba(NO3)2 D.AgNO3、HCl、NaHCO3
B
【关键点拨】 复分解反应
1.概念:
复分解反应是由两种化合物相互交换成分,生成另外两种化合物的反应。
可简单表示为AB + CD AD + CB。
2.反应发生的条件:
生成物中:有沉淀产生;有气体放出;有水生成。只要具备上述条件之一,复分解反应即可发生。
3.常见类型:
①酸 + 碱 盐 + 水;
②酸 + 盐 新酸 + 新盐;
③碱 + 盐 新碱 + 新盐;
④盐 + 盐 新盐 + 新盐;
⑤酸 + 金属氧化物 盐 + 水。
【真题体验】
1.(2022苏州)下列各组物质在水中能大量共存且溶液为无色、透明的是( )
A.NaOH、KNO3、MgCl2 B.Na2CO3、HCl、BaCl2
C.KNO3、NaCl、H2SO4 D.FeCl3、KCl、HCl
C
2.(2022邵阳)下列化学方程式及反应类型均正确的是
( )
A.S + O2 点燃 SO2 化合反应
B.H2O2 MnO2 H2↑+ O2↑ 分解反应
C.Fe + H2SO4 = FeSO4 + H2 置换反应
D.Ca(OH)2 + HCI = CaCl2 + H2O 复分解反应
A
3.(2022益阳)用盐酸除去水垢中Mg(OH)2的化学方程式为Mg(OH)2+2HCl=MgCl2+2H2O。该反应属于( )
A.化合反应 B.分解反应
C.复分解反应 D.置换反应
4.(2022河池)下列溶液混合后,一定有沉淀生成的是( )
A.HCl KOH Na2CO3 CaCl2
B.AgNO3 HCl HNO3 NaCl
C.CuSO4 HNO3 NaOH KCl
D.FeCl3 NaOH NH4Cl HCl
C
B
5.(2022十堰)将12.0g大理石样品置于烧杯中,向其中逐渐加入稀盐酸(杂质既不溶于水,也不与稀盐酸反应)。当加入94.4g稀盐酸,恰好不再有气体生成,此时烧杯内混合物的质量为102.0g(假设 全部逸出,不考虑水的损失)。试计算:
(1)生成二氧化碳的质量是______________g。
(2)烧杯内所得溶液中溶质的质量分数(写出计算过程)。
解:(1)12.0g+94.4g-102.0g=4.4g
设氯化钙的质量为x,碳酸钙的质量y
2HCl + CaCO = CaCl + H O + CO ↑
100 111 44
y x 4.4g
111/44 = x/4.4g 100/44 = y/4.4g
x = 11.1g y = 10g
11.1g/(94.4g+10g-4.4g)×100% = 11.1%
答:烧杯内所得溶液中溶质的质量分数为11.1%。
单元复习与测试
第八单元 海水中的化学
PART
01
PART
02
了解海水及海底蕴含的主要物质,知道海水制镁及淡化海水常用的方法。
知道蒸发结晶是海水晒盐的基本原理,了解食盐的用途和工业上精制食盐的方法。
学习目标
PART
03
认识纯碱等盐类物质的重要性质。
PART
04
知道工业制取纯碱的化学反应原理,了解纯碱在日常生活或工农业生产中的应用。
构建知识体系
一、海洋资源的综合利用
【答案速填】
一、①MgCl2+Ca(OH)2====
Mg(OH)2↓+CaCl2
②Mg(OH)2+2HCl====MgCl2+2H2O
③MgCl2====Mg+Cl2↑
④可燃冰 ⑤蒸发
⑥降温 ⑦溶解
⑧过滤 ⑨蒸发
⑩NaCl+NH3+CO2+H2O====NaHCO3+NH4Cl
2NaHCO3====Na2CO3+CO2↑+H2O
【答案速填】二、①酸碱指示剂
②Na2CO3+2HCl====2NaCl+H2O+CO2↑ ③Na2CO3+Ca(OH)2====CaCO3↓+2NaOH
④Na2CO3+BaCl2====BaCO3↓+2NaCl ⑤有沉淀生成 ⑥有气体生成 ⑦有水生成
二、盐的性质
主题一 海洋资源的综合利用
【主题训练1】 (2022北京)海水是宝贵的自然资源,从海水中提取食盐的主要过程如下图。
(1)食盐的主要成分
是______________。
(2)蒸发池中,水蒸发属于______________(填“物理”或“化学”)变化。
(3)下列是去除粗盐中难溶性杂质的操作,正确的顺序是______________(填序号)。
A. 过滤 B. 溶解 C. 蒸发
氯化钠
物理
BAC
【关键点拨】 海洋资源的综合利用
海洋资源的综合利用主要包括海水制镁、海水晒盐、海水制碱、海水淡化,理解它们的原理并记住流程是解题关键。它们的流程分别为
海水淡化的方法主要是膜法和热法。热法主要指的是蒸馏法。
【真题体验】
1.(2022长春)关于“粗盐中难溶性杂质的去除”实验,下列说法错误的是( )
A. 溶解:为加快粗盐的溶解,可预先将粗盐研细
B. 过滤:过滤食盐水时,需用玻璃棒引流
C. 蒸发:蒸发皿中的水蒸干后,停止加热
D. 分析:粗盐未完全溶解就过滤,则得到的精盐偏少
B
2.(2022贵阳)下列实验目的与实验操作不相符的是( )
3.(2022六盘水)下列实验方案能达到实验目的的是( )
C
C
选项 实验目的 实验操作
A 区别软水和硬水 加入适量肥皂水,振荡
B 防止集气瓶中硫燃烧产物污染空气 集气瓶中加一定量水
C 除去粗盐中混有的泥沙 加水、溶解、蒸发
D 鉴别化肥NH4Cl和KNO3 分别加入熟石灰,研磨,闻气味
选项 实验目的 实验方案
A 除去NaCl固体中的CaCl2 依次加入足量水、碳酸钠溶液、稀盐酸,蒸发结晶
B 除去Fe粉中混有的Cu粉 加足量稀硫酸,过滤,洗涤,干燥
C 鉴别NH4NO3和CO(NH2)2固体 分别取少量固体加入熟石灰研磨,闻气味
D 鉴别Na2CO3和NaHCO3固体 滴加稀盐酸,观察有无气泡产生
4.(2022广西来宾)我国是世界上首个成功试采海域可燃冰的国家。可燃冰主要含有甲烷水合物,具有能量高、燃烧值大等优点,将成为未来新能源。
(1)保持甲烷化学性质的最小粒子是 。
(2)如图是甲烷在氧气中充分燃烧的微观示意图。
①图中虚线方框内物质C的微观模
型图是 (填数字序号)。
②参加反应的物质A与B的化学计量
数之比是 。
(3)甲烷与空气的混合气体点燃
可能发生爆炸,因此点燃甲烷前,
应该先 。
甲烷分子
Ⅲ
1:2
验纯
5.(2022鞍山)阅读下面科普短文。
海洋是巨大的资源宝库
【材料1】海洋蕴含着丰富的油气资源。我国南海中南部油气地质资源量占我国总储量的53%,可采资源量占66%。西沙群岛、中沙群岛的水下有上千米的新生代沉积物,是大有希望的海底石油和天然气产地。天然气主要成分甲烷的含碳量相对较少,燃烧较完全,燃烧产生的二氧化碳比起煤和石油制品相对较少,通常被称为“清洁能源”。
【材料2】海洋是化学资源宝库,含有80多种元素,钠和氯是其中含量较高的元素。海水中存在大量的氯化钠、氯化镁、氯化钙等盐类物质,生活中的食盐主要来自海洋。
【材料3】海洋是能力出众的“捕碳者”。海洋约占地球表面积的71%,这个庞大的碳库储碳量是陆地的20倍、大气的50倍。自工业革命以来,人类产生的二氧化碳有大约48%被海水吸收。
(节选自《知识就是力量》)
回答下列问题:
(1)石油是_________________(填“可再生”或“不可再生”)能源。
(2)甲烷充分燃烧的化学方程式是_________________。
(3)工业上从海水中获得粗盐的结晶方法是_________________。
(4)海洋作为“捕碳者”可以有效缓解的环境问题是_________________。
不可再生
CH4+2O2点燃CO2+2H2O
蒸发结晶
温室效应
主题二 盐的性质
【主题训练2】(2022丹东)下列是化学兴趣小组的同学进行粗盐提纯的实验,请你帮助回答相关问题。
【实验一】除去粗盐中难溶性杂质
溶解:在溶解过程中,用玻璃棒不断搅拌的目的是 。
过滤:漏斗下端管口应紧靠 ;若滤纸未紧贴漏斗壁,会导致 。
得到的滤液M中还含有可溶性杂质CaCl2和MgCl2。
【实验二】除去滤液M中的可溶性杂质CaCl2和MgCl2(温馨提示:氢氧化镁不溶于水)
步骤1:向滤液M中加入过量的NaOH溶液,
充分反应后过滤。该反应的基本反应类
型是 ,所得溶液A中含有
的金属离子有 。
步骤2:向溶液A中加入过量某溶液,充
分反应后过滤。发生反应的化学方程式为 。
步骤3: 。
加快粗盐的溶解速率
烧杯内壁
过滤速度慢
复分解反应
Ca2+、Na+
Na2CO3+CaCl2=CaCO3↓+2NaCl
向溶液B中加入适量的稀盐酸,后蒸发结晶
【关键点拨】
盐的性质释疑
(1)因盐不像酸、碱那样能解离出共同的阳离子或阴离子,因
此,盐无化学通性,但盐都是由金属离子(铵盐除外)和酸根离
子构成,因此,盐在化学性质方面存在相似性。
(2)KNO3、NaNO3一般不参与复分解反应。
(3)在初中阶段,难溶性盐主要参与以下两类反应。
①与酸反应:CaCO3+2HCl====CaCl2+H2O+CO2↑。
②部分难溶性盐受热或高温易分解,如CaCO3 高温 CaO+CO2↑。
【真题体验】
1.(2022柳州)下列常见物质的俗名与化学式不相符的是( )
A.水银﹣H2O B.纯碱﹣Na2CO3
C.生石灰﹣CaO D.烧碱﹣NaOH
2.(2022益阳)侯德榜是我国著名的化学家,发明了侯氏制碱法,为纯碱(Na2CO3)和氮肥工业技术的发展作出了杰出的贡献。其中纯碱(Na2CO3)属于( )
A.酸 B.碱 C.盐 D.氧化物
3.(2022汉中)碳酸氢钠(NaHCO3)是焙制糕点所用发酵粉的主要成分之一,下列有关说法正确的是( )
A.NaHCO3中的阳离子为Na+2 B.NaHCO3中碳元素的化合价为+2价
C.氧原子的结构示意图为 D.NaHCO3中含有一种金属元素
A
D
C
3.(2022河南节选)食盐(主要成分是NaCl)除可用作调味品外,还是一种重要化工原料。晾晒海水所得到的粗盐中含有不溶性杂质(泥沙)和可溶性杂质(CaCl2、MgCl2、Na2SO4).下图是某化学小组在实验室对粗盐样品进行除杂提纯的过程。
①溶解、过滤、蒸发的操作中
都需要用到的一种玻璃仪器为
(填“烧
杯”“漏斗”或“玻璃棒”)。
②固体甲中所含有的难溶性
物质为BaSO4、 、CaCO3和BaCO3。
③请设计实验验证溶液乙中所含有的杂质。(简要叙述实验步骤及现象)。
玻璃棒
Mg(OH)2
取少取溶液于试管中,加入足量的氯化钡溶液,有白色沉淀产生,静置,取上层清液,滴加几滴无色酚酞溶液,溶液变红
4.(2022来宾)纯碱是一种重要的化工原料,广泛用于玻璃、造纸、纺织和洗涤剂的生产。某化学兴趣小组对纯碱的制备、性质及用途等开展项目式学习。
任务一:了解纯碱的制备——“侯氏制碱法”
“侯氏制碱法”主要化学原理是利用饱和氯化钠溶液吸收两种气体,生成碳酸氢钠和氯化铵(NH4Cl),再加热碳酸氢钠即可制得纯碱。
(1)纯碱属于 (填“酸”“碱”或“盐”)。
(2)饱和氯化钠溶液吸收的两种气体是 (填字母序号)。A.Cl2 B.NH3 C.SO2 D.CO2
任务二:探究纯碱的性质——Na2CO3溶液呈碱性
【查阅资料】①溶液呈碱性,是因为溶液中存在较多的OH﹣。
②Na2CO3在水中全部解离出Na+和CO32﹣。
③CaCl2溶液呈中性,Ca2+、Cl﹣对溶液的酸碱性没有影响。
【提出猜想】猜想一:H2O单独起作用,产生较多的OH﹣,使溶液呈碱性。
猜想二:Na+与H2O作用,产生较多的OH﹣,使溶液呈碱性。
猜想三: 。
BD
盐
碳酸根离子和水作用,产生较多的OH﹣,使溶液呈碱性
【实验探究】
【解释与结论】同学们和老师交流,得知CO32﹣和H2O作用,产生较多的OH﹣和另一种阴离子。
【拓展与延伸】结合任务二的所有信息和结论,运用初中化学所学知识,经过分析推理可得出:Na2CO3溶液中含有的阴离子是 。
实验操作 实验现象 实验结论
(1)向试管中加入一定量的蒸馏水,滴入2滴酚酞溶液 溶液无明显变化 猜想一不成立
(2)向试管中加入一定量的NaCl溶液,滴入2滴酚酞溶液 溶液无明显变化 猜想二不成立
(3)①向试管中加入一定量的Na2CO3溶液,滴入2滴酚酞溶液 ②往①所得溶液中逐滴加入CaCl2溶液至过量 ①溶液由无色变红色 ② 。 猜想三成立
产生白色沉淀,溶液红色消失
CO32﹣、OH﹣
任务三 探究纯碱的用途——用于生产洗涤剂
【查阅资料】Na2CO3可用于生产洗涤剂。Na2CO3溶液呈碱性,可清洗油污,溶液碱性越强,去油污效果越好。
【实验探究】兴趣小组继续对影响Na2CO3溶液去油污效果的因素进行探究。
用不同温度的水,配制溶质质量分数分别为2%、6%和10%的Na2CO3溶液,并测定溶液pH,记录数据如表:
实验编号 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨
溶质质量分数 2% 2% 2% 6% 6% 6% 10% 10% 10%
溶液温度(℃) 20 40 60 20 50 60 20 40 70
溶液pH 10.90 11.18 11.26 11.08 11.27 11.30 11.22 11.46 11.50
【解释与结论】(1)实验①、②、③对比,可得出的结论是 。
(2)要证明Na2CO3溶液的溶质质量分数变化与pH变化关系,可选择的3个实验的编号是 。
【拓展与应用】下列物质可用于去油污的是 (填字母序号)。
A.NaCl B.NaOH C.K2CO3 D.CaCO3
温度越高,碳酸钠溶液碱性越强
①④⑦
BC
主题三 复分解反应的应用
【主题训练3】(2022襄阳)下列各组物质在溶液中能大量共存的是( )
A.MgCl2、NaOH、(NH4)2SO4 B.Ba(OH)2、KNO3、NaCl
C.NaOH、H2SO4、Ba(NO3)2 D.AgNO3、HCl、NaHCO3
B
【关键点拨】 复分解反应
1.概念:
复分解反应是由两种化合物相互交换成分,生成另外两种化合物的反应。
可简单表示为AB + CD AD + CB。
2.反应发生的条件:
生成物中:有沉淀产生;有气体放出;有水生成。只要具备上述条件之一,复分解反应即可发生。
3.常见类型:
①酸 + 碱 盐 + 水;
②酸 + 盐 新酸 + 新盐;
③碱 + 盐 新碱 + 新盐;
④盐 + 盐 新盐 + 新盐;
⑤酸 + 金属氧化物 盐 + 水。
【真题体验】
1.(2022苏州)下列各组物质在水中能大量共存且溶液为无色、透明的是( )
A.NaOH、KNO3、MgCl2 B.Na2CO3、HCl、BaCl2
C.KNO3、NaCl、H2SO4 D.FeCl3、KCl、HCl
C
2.(2022邵阳)下列化学方程式及反应类型均正确的是
( )
A.S + O2 点燃 SO2 化合反应
B.H2O2 MnO2 H2↑+ O2↑ 分解反应
C.Fe + H2SO4 = FeSO4 + H2 置换反应
D.Ca(OH)2 + HCI = CaCl2 + H2O 复分解反应
A
3.(2022益阳)用盐酸除去水垢中Mg(OH)2的化学方程式为Mg(OH)2+2HCl=MgCl2+2H2O。该反应属于( )
A.化合反应 B.分解反应
C.复分解反应 D.置换反应
4.(2022河池)下列溶液混合后,一定有沉淀生成的是( )
A.HCl KOH Na2CO3 CaCl2
B.AgNO3 HCl HNO3 NaCl
C.CuSO4 HNO3 NaOH KCl
D.FeCl3 NaOH NH4Cl HCl
C
B
5.(2022十堰)将12.0g大理石样品置于烧杯中,向其中逐渐加入稀盐酸(杂质既不溶于水,也不与稀盐酸反应)。当加入94.4g稀盐酸,恰好不再有气体生成,此时烧杯内混合物的质量为102.0g(假设 全部逸出,不考虑水的损失)。试计算:
(1)生成二氧化碳的质量是______________g。
(2)烧杯内所得溶液中溶质的质量分数(写出计算过程)。
解:(1)12.0g+94.4g-102.0g=4.4g
设氯化钙的质量为x,碳酸钙的质量y
2HCl + CaCO = CaCl + H O + CO ↑
100 111 44
y x 4.4g
111/44 = x/4.4g 100/44 = y/4.4g
x = 11.1g y = 10g
11.1g/(94.4g+10g-4.4g)×100% = 11.1%
答:烧杯内所得溶液中溶质的质量分数为11.1%。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
