第一节 常见的金属材料 课件-2022-2023学年九年级化学下册同步精品课堂(鲁教版)
文档属性
| 名称 | 第一节 常见的金属材料 课件-2022-2023学年九年级化学下册同步精品课堂(鲁教版) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-09 00:00:00 | ||
图片预览










文档简介
(共34张PPT)
第一节 常见的金属材料
第九单元 金属
PART
01
PART
02
了解常见金属的物理性质,知道金属材料在生活和工农业生产中的重要用途
了解合金的形成及特性
学习目标
PART
03
了解重要的铁矿石,知道炼铁的基本原理
人类文明的发展和社会的进步同金属材料关系十分密切。继石器时代之后出现的铜器时代、铁器时代。均以金属材料的应用为其时代的显著标志。现代,种类繁多的金属材料已成为人类社会发展的重要物质基础。
1.常温下多为固体(汞为液体)
2.具有金属光泽
4.具有良好的导电性、导热性、延展性
一、金属的物理性质
3.大多为银白色(铜为紫红色,金为黄色)
5.熔沸点较高
6.密度和硬度较大
金属之最
熔点最低的金属——汞
熔点最高的金属——钨
密度最小的金属——锂
密度最大的金属——锇
硬度最小的金属——铯
硬度最大的金属——铬
延性最好的金属——铂
展性最好的金属——金
地壳中含量最高的金属元素——铝
目前世界年产量最高的金属——铁
导电、导热性最好的金属——银
人体中含量最高的金属元素——钙
1.什么是合金?
在某种金属中加热熔合其他金属或非金属后形成的、具有金属特性的物质,叫做合金。
2.为什么我们使用的金属材料主要是合金,而不是纯金属?
合金与纯金属相比,除具有纯金属的特性外,还具有许多比各成分金属或非金属更优良的物理、化学或机械性能。如硬度大、熔点低、密度小、耐磨、耐腐蚀等。
二、合金
合金是混合物,各方面的性能更优良
实验1:合金与纯金属的色泽和硬度的比较
金属材料 主要成分 光泽和颜色 硬度大小对比
黄铜片(合金) 铜、锌
铜片(纯铜) 铜 焊锡(合金) 铅、锡
锡(纯锡) 锡 结论 黄色
紫红色
银白色
灰色
黄铜大
焊锡大
合金的光泽和颜色比组成它的纯金属更好
合金的硬度比组成它的纯金属的硬度大
实验探究
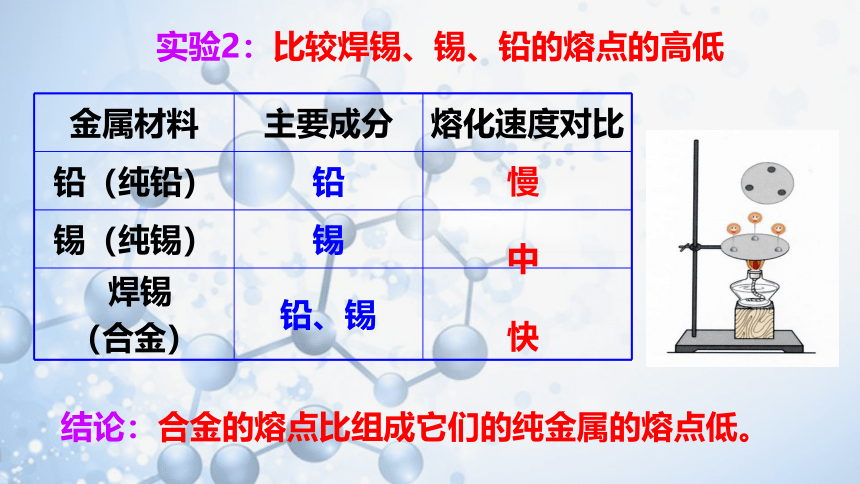
金属材料 主要成分 熔化速度对比
铅(纯铅) 铅
锡(纯锡) 锡
焊锡 (合金) 铅、锡
慢
中
快
实验2:比较焊锡、锡、铅的熔点的高低
结论:合金的熔点比组成它们的纯金属的熔点低。
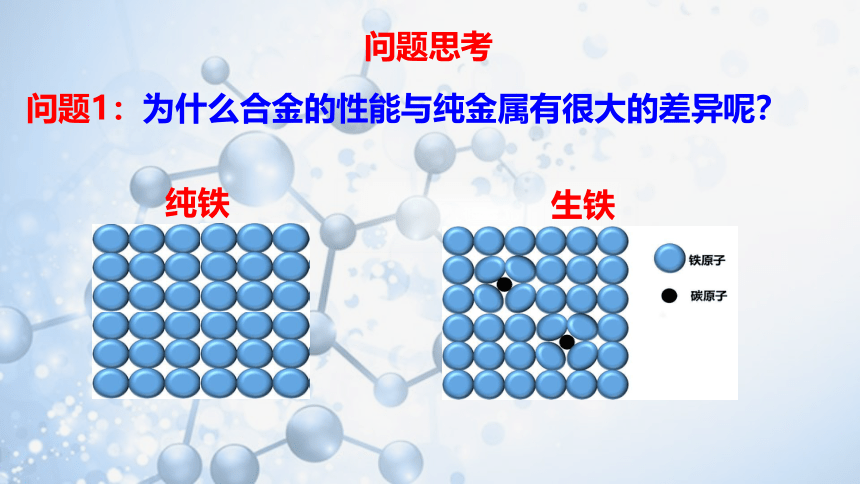
问题1:为什么合金的性能与纯金属有很大的差异呢?
纯铁
问题思考
生铁
固体的熔点与原子排列是否规整有关。你能否解释为什么多数合金的熔点一般比各成分金属的低吗?
在纯金属内,所有的原子大小相同,排列十分规整。而合金内原子的大小不一,排列没有纯金属那样整齐,使得原子之间的相互作用力减小。所以,多数合金的熔点一般比各成分金属的低。
问题2:我们在日常生活中使用的合金有铁合金、铝合金、铜合金等,这些合金的组成是什么样的?
1.铁合金
生铁:
钢:
含碳量为2%~4.3%
含碳量为0.03%~2%
生铁的用途:生铁硬度大、抗压、性脆,可以铸造成型,是制造机座、管道的重要材料。
钢的用途:有良好的延展性,机械性能好,用于制造机械和交通工具。
铁合金
钢
碳素钢:
合金钢:
如不锈钢(合金元素为铬和镍)
低碳钢、中碳钢、高碳钢
铜合金
黄铜:
青铜:
白铜:
含Cu、Zn——耐腐蚀,耐磨,可塑性强,硬度较小。
含Cu、Sn——可塑性好,耐腐蚀,强度大。
含Ni、Zn——制酒具等
2.铜合金
硬铝: 含Al、Cu 、Mg 、Si
性能:密度小、强度大、抗腐蚀。
合金的成分不同,其性质也不相同;如果改变某一合金元素的含量,合金的性质也会发生改变。
3.铝合金
世界铝的年产量仅次于铁,居第二位。铝有较好的延展性,可制成0.01mm的铝箔,用于包装香烟、糖果;铝具有密度小和抗腐蚀等优良性能,故铝及其合金在电线电缆工业、飞机、汽车等制造业有广泛的用途。
铝及其合金的用途
钛合金与人体有很好的“相容性”,因此可用来制造人造骨。
被认为是21世纪的重要材料,它具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工、机械性能好等。尤其是抗腐蚀性能非常好,即使把它们放在海水中数年,取出后仍光亮如新,其抗腐蚀性能远优于不锈钢,因此被广泛用于火箭、导弹、航天飞机、船舶、化工和通信设备等。
钛金属腕表
4.钛和钛合金
磁铁矿(主要成分Fe3O4)
赤铁矿(主要成分Fe2O3)
菱铁矿(主要成分FeCO3)
常见的
铁矿石
黄铁矿(主要成分FeS2)
三、金属矿物及其冶炼
常见的矿物:铝土矿、钾长石、明矾石
铁矿石是怎样炼成铁的呢?让我们通过实验来研究铁冶炼的化学原理。
一氧化碳与氧化铁的反应
活动天地
实验的原理
实验的步骤
实验的现象
实验应注意哪些问题?(先加热还是先通气?实验完毕是先停止加热吗?)
实验还能改进吗?(一氧化碳有毒,实验完毕的尾气怎么处理?)
一氧化碳还原氧化铁实验
实验原理:
实验操作:
1.按上图组装仪器,并检查气密性
2.把少量研细的红色氧化铁粉末装进硬质玻璃管中
Fe2O3+3CO === 2Fe+3CO2
高温
3.把硬质玻璃管接入装置系统中,先点燃出气口处的酒精灯,再通入一氧化碳气体排气;待排尽后,再点燃酒精喷灯,并观察装置中所发生的变化
4.当红色粉末全部转变成黑色后,先停止加热,再通一会儿一氧化碳,直至玻璃管冷却
将产生的气体通入到澄清石灰水中,澄清石灰水变浑浊,则生成二氧化碳:CO2+Ca(OH)2=CaCO3↓+H2O ;
红色粉末变黑色,用磁铁检验,证明黑色粉末为铁。(若用一氧化碳还原四氧化三铁,应将生成的黑色粉末加入盐酸中,若有气体生成,则证明有铁生成。由于四氧化三铁也有磁性,不能用磁铁吸引的方法检验。)
红色(氧化铁)粉末逐渐变成黑色,同时澄清的石灰水逐渐变浑浊。
实验现象:
问题讨论:1.如何判断反应中生成了什么物质?
把尾气烧掉,防止污染空气
2.装置中出气口处的酒精灯起什么作用?
3.石灰水的作用有哪些?
澄清石灰水用来检验生成物二氧化碳,并吸收二氧化碳便于处理尾气
注意事项:
1.一氧化碳还原氧化铁是在封闭的硬质玻璃管中进行的,先通一氧化碳,可以把管内的空气排出,防止一氧化碳与空气混合受热爆炸。
2.实验完毕先停止加热,还要继续通入一氧化碳直到玻璃管冷却。防止高温的条件下,生成的铁再被氧化。
实验改进:
可将上述装置除尾气的部分,改成用气球或方便袋收集,这样收集得到的未燃一氧化碳气体可重复利用
把尾气烧掉,既防止污染空气,又节约能源
工业炼铁
Fe2O3 + 3CO == 2Fe + 3CO2
高温
化学上把含氧化合物中的氧被夺去的反应叫做还原反应。
工业上采用电解法冶炼铝,反应的化学方程式为:
2Al2O3 == 4Al + 3O2 ↑
通电
CO具有还原性,是还原剂。常用的还原剂还有C、H2。
典型例题
知识点一:金属与合金的性质
【典例1】(2022哈尔滨)“嫦娥揽月、北斗指路、祝融探火……”中国航天砥砺奋进,“神舟十四”再探天河!神舟十四号飞船很多部件都用到了哈尔滨制造的铝合金,如轨道舱壳体结构、返回舱侧壁金属壳体等,这样可以有效的减轻飞船的重量。请结合上述内容,回答下列问题:
(1)铝合金属于 (填“混合物”或“纯净物”)。
(2)铝合金的优良性能有 (填字母)等。
A.密度小、硬度大 B.强度高抗腐蚀性差
混合物
A
知识点二:金属矿物及其冶炼
【典例2】(2022赤峰)钢铁冶炼的部分工艺流程如图所示,回答下列问题:
(1)用化学方程式表示赤铁矿石冶炼成
生铁的反应原理 。
(2)钢铁冶炼的产品是生铁和钢,两者
的主要区别是 。
(3)在钢水铸件机中,高温钢水加工成钢制零件时,充入氮气的作用是 。
(4)流程的最后一道操作是涂层(即在金属制品表面进行喷漆或搪瓷等),该操作的主要目的是 。
Fe2O3+3CO 高温2Fe+3CO2
含碳量不同
作保护气,防止铁在高温下被空气中的氧气氧化
隔绝氧气和水,防止金属制品生锈
课堂达标
1. (2022晋中)大自然向人类提供了丰富的金属矿物资源,在以下四种矿石中,可用于炼铁的是( )
A.赤铁矿(主要成分是Fe2O3)
B.炉甘石(主要成分是ZnCO3)
C.铝土矿(主要成分是Al2O3)
D.赤铜矿(主要成分是Cu2O)
A
2. (2022绍兴)春秋初期,绍兴一带是南方的一个冶铁中心,其炼铁方法是在1000℃左右的温度下,使木炭和铁矿石(主要成分为Fe2O3)发生一系列的反应生成含较多杂质的海绵铁。其中主要化学反应为:3CO+Fe2O3 高温2Fe+3CO2。下列说法正确的是( )
A.海绵铁是一种纯净物
B.Fe2O3中铁元素的化合价为+3价
C.上述反应中涉及的氧化物只有2种
D.炼铁过程中,木炭只是作为燃料使用
B
3.(2022泰州节选)金属材料为促进生产发展、改善人类生活发挥了重要作用。
(5)《吕氏春秋》记载“金柔锡柔,合两柔则刚”(注:金指铜单质,锡指锡单质,刚指坚硬)。这句话说明铜锡合金相较于铜、锡的特点是
。
硬度大
4. (2022成都)我国有着悠久的钢铁冶
炼史,《天工开物》中记载的“炒钢法”
如图1,该方法的生产过程可用图2表示。
资料:①潮泥灰主要成分是石灰石。
②铁的熔点是1535℃。
根据图文回答下列问题。
(1)常见的铁矿石有赤铁矿和 (写一种)。
(2)不断鼓入空气的目的是 。
(3)炼铁炉中生成铁的化学方程式为 。
(4)撒入潮泥灰主要作用是 。不断翻炒液态生铁,是为了降低 元素的含量。
(5)钢的性能优良,如钢的熔点比纯铁 ,易于加工。
磁铁矿(合理即可)
提高炉温
碳或C
将铁矿石中的二氧化硅转化为炉渣而除去
Fe2O3+3CO高温 2Fe+3CO2
低
课堂小结
1.大多数金属具有共同的物理性质,如具有金属光泽、可以导电和导热、延展性良好等
2.合金是在一种金属中加热熔合其他金属或非金属而形成的具有金属特性的物质
3.工业炼铁的主要化学反应原理是:
Fe2O3 + 3CO ==== 2Fe + 3CO2
高温
第一节 常见的金属材料
第九单元 金属
PART
01
PART
02
了解常见金属的物理性质,知道金属材料在生活和工农业生产中的重要用途
了解合金的形成及特性
学习目标
PART
03
了解重要的铁矿石,知道炼铁的基本原理
人类文明的发展和社会的进步同金属材料关系十分密切。继石器时代之后出现的铜器时代、铁器时代。均以金属材料的应用为其时代的显著标志。现代,种类繁多的金属材料已成为人类社会发展的重要物质基础。
1.常温下多为固体(汞为液体)
2.具有金属光泽
4.具有良好的导电性、导热性、延展性
一、金属的物理性质
3.大多为银白色(铜为紫红色,金为黄色)
5.熔沸点较高
6.密度和硬度较大
金属之最
熔点最低的金属——汞
熔点最高的金属——钨
密度最小的金属——锂
密度最大的金属——锇
硬度最小的金属——铯
硬度最大的金属——铬
延性最好的金属——铂
展性最好的金属——金
地壳中含量最高的金属元素——铝
目前世界年产量最高的金属——铁
导电、导热性最好的金属——银
人体中含量最高的金属元素——钙
1.什么是合金?
在某种金属中加热熔合其他金属或非金属后形成的、具有金属特性的物质,叫做合金。
2.为什么我们使用的金属材料主要是合金,而不是纯金属?
合金与纯金属相比,除具有纯金属的特性外,还具有许多比各成分金属或非金属更优良的物理、化学或机械性能。如硬度大、熔点低、密度小、耐磨、耐腐蚀等。
二、合金
合金是混合物,各方面的性能更优良
实验1:合金与纯金属的色泽和硬度的比较
金属材料 主要成分 光泽和颜色 硬度大小对比
黄铜片(合金) 铜、锌
铜片(纯铜) 铜 焊锡(合金) 铅、锡
锡(纯锡) 锡 结论 黄色
紫红色
银白色
灰色
黄铜大
焊锡大
合金的光泽和颜色比组成它的纯金属更好
合金的硬度比组成它的纯金属的硬度大
实验探究
金属材料 主要成分 熔化速度对比
铅(纯铅) 铅
锡(纯锡) 锡
焊锡 (合金) 铅、锡
慢
中
快
实验2:比较焊锡、锡、铅的熔点的高低
结论:合金的熔点比组成它们的纯金属的熔点低。
问题1:为什么合金的性能与纯金属有很大的差异呢?
纯铁
问题思考
生铁
固体的熔点与原子排列是否规整有关。你能否解释为什么多数合金的熔点一般比各成分金属的低吗?
在纯金属内,所有的原子大小相同,排列十分规整。而合金内原子的大小不一,排列没有纯金属那样整齐,使得原子之间的相互作用力减小。所以,多数合金的熔点一般比各成分金属的低。
问题2:我们在日常生活中使用的合金有铁合金、铝合金、铜合金等,这些合金的组成是什么样的?
1.铁合金
生铁:
钢:
含碳量为2%~4.3%
含碳量为0.03%~2%
生铁的用途:生铁硬度大、抗压、性脆,可以铸造成型,是制造机座、管道的重要材料。
钢的用途:有良好的延展性,机械性能好,用于制造机械和交通工具。
铁合金
钢
碳素钢:
合金钢:
如不锈钢(合金元素为铬和镍)
低碳钢、中碳钢、高碳钢
铜合金
黄铜:
青铜:
白铜:
含Cu、Zn——耐腐蚀,耐磨,可塑性强,硬度较小。
含Cu、Sn——可塑性好,耐腐蚀,强度大。
含Ni、Zn——制酒具等
2.铜合金
硬铝: 含Al、Cu 、Mg 、Si
性能:密度小、强度大、抗腐蚀。
合金的成分不同,其性质也不相同;如果改变某一合金元素的含量,合金的性质也会发生改变。
3.铝合金
世界铝的年产量仅次于铁,居第二位。铝有较好的延展性,可制成0.01mm的铝箔,用于包装香烟、糖果;铝具有密度小和抗腐蚀等优良性能,故铝及其合金在电线电缆工业、飞机、汽车等制造业有广泛的用途。
铝及其合金的用途
钛合金与人体有很好的“相容性”,因此可用来制造人造骨。
被认为是21世纪的重要材料,它具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工、机械性能好等。尤其是抗腐蚀性能非常好,即使把它们放在海水中数年,取出后仍光亮如新,其抗腐蚀性能远优于不锈钢,因此被广泛用于火箭、导弹、航天飞机、船舶、化工和通信设备等。
钛金属腕表
4.钛和钛合金
磁铁矿(主要成分Fe3O4)
赤铁矿(主要成分Fe2O3)
菱铁矿(主要成分FeCO3)
常见的
铁矿石
黄铁矿(主要成分FeS2)
三、金属矿物及其冶炼
常见的矿物:铝土矿、钾长石、明矾石
铁矿石是怎样炼成铁的呢?让我们通过实验来研究铁冶炼的化学原理。
一氧化碳与氧化铁的反应
活动天地
实验的原理
实验的步骤
实验的现象
实验应注意哪些问题?(先加热还是先通气?实验完毕是先停止加热吗?)
实验还能改进吗?(一氧化碳有毒,实验完毕的尾气怎么处理?)
一氧化碳还原氧化铁实验
实验原理:
实验操作:
1.按上图组装仪器,并检查气密性
2.把少量研细的红色氧化铁粉末装进硬质玻璃管中
Fe2O3+3CO === 2Fe+3CO2
高温
3.把硬质玻璃管接入装置系统中,先点燃出气口处的酒精灯,再通入一氧化碳气体排气;待排尽后,再点燃酒精喷灯,并观察装置中所发生的变化
4.当红色粉末全部转变成黑色后,先停止加热,再通一会儿一氧化碳,直至玻璃管冷却
将产生的气体通入到澄清石灰水中,澄清石灰水变浑浊,则生成二氧化碳:CO2+Ca(OH)2=CaCO3↓+H2O ;
红色粉末变黑色,用磁铁检验,证明黑色粉末为铁。(若用一氧化碳还原四氧化三铁,应将生成的黑色粉末加入盐酸中,若有气体生成,则证明有铁生成。由于四氧化三铁也有磁性,不能用磁铁吸引的方法检验。)
红色(氧化铁)粉末逐渐变成黑色,同时澄清的石灰水逐渐变浑浊。
实验现象:
问题讨论:1.如何判断反应中生成了什么物质?
把尾气烧掉,防止污染空气
2.装置中出气口处的酒精灯起什么作用?
3.石灰水的作用有哪些?
澄清石灰水用来检验生成物二氧化碳,并吸收二氧化碳便于处理尾气
注意事项:
1.一氧化碳还原氧化铁是在封闭的硬质玻璃管中进行的,先通一氧化碳,可以把管内的空气排出,防止一氧化碳与空气混合受热爆炸。
2.实验完毕先停止加热,还要继续通入一氧化碳直到玻璃管冷却。防止高温的条件下,生成的铁再被氧化。
实验改进:
可将上述装置除尾气的部分,改成用气球或方便袋收集,这样收集得到的未燃一氧化碳气体可重复利用
把尾气烧掉,既防止污染空气,又节约能源
工业炼铁
Fe2O3 + 3CO == 2Fe + 3CO2
高温
化学上把含氧化合物中的氧被夺去的反应叫做还原反应。
工业上采用电解法冶炼铝,反应的化学方程式为:
2Al2O3 == 4Al + 3O2 ↑
通电
CO具有还原性,是还原剂。常用的还原剂还有C、H2。
典型例题
知识点一:金属与合金的性质
【典例1】(2022哈尔滨)“嫦娥揽月、北斗指路、祝融探火……”中国航天砥砺奋进,“神舟十四”再探天河!神舟十四号飞船很多部件都用到了哈尔滨制造的铝合金,如轨道舱壳体结构、返回舱侧壁金属壳体等,这样可以有效的减轻飞船的重量。请结合上述内容,回答下列问题:
(1)铝合金属于 (填“混合物”或“纯净物”)。
(2)铝合金的优良性能有 (填字母)等。
A.密度小、硬度大 B.强度高抗腐蚀性差
混合物
A
知识点二:金属矿物及其冶炼
【典例2】(2022赤峰)钢铁冶炼的部分工艺流程如图所示,回答下列问题:
(1)用化学方程式表示赤铁矿石冶炼成
生铁的反应原理 。
(2)钢铁冶炼的产品是生铁和钢,两者
的主要区别是 。
(3)在钢水铸件机中,高温钢水加工成钢制零件时,充入氮气的作用是 。
(4)流程的最后一道操作是涂层(即在金属制品表面进行喷漆或搪瓷等),该操作的主要目的是 。
Fe2O3+3CO 高温2Fe+3CO2
含碳量不同
作保护气,防止铁在高温下被空气中的氧气氧化
隔绝氧气和水,防止金属制品生锈
课堂达标
1. (2022晋中)大自然向人类提供了丰富的金属矿物资源,在以下四种矿石中,可用于炼铁的是( )
A.赤铁矿(主要成分是Fe2O3)
B.炉甘石(主要成分是ZnCO3)
C.铝土矿(主要成分是Al2O3)
D.赤铜矿(主要成分是Cu2O)
A
2. (2022绍兴)春秋初期,绍兴一带是南方的一个冶铁中心,其炼铁方法是在1000℃左右的温度下,使木炭和铁矿石(主要成分为Fe2O3)发生一系列的反应生成含较多杂质的海绵铁。其中主要化学反应为:3CO+Fe2O3 高温2Fe+3CO2。下列说法正确的是( )
A.海绵铁是一种纯净物
B.Fe2O3中铁元素的化合价为+3价
C.上述反应中涉及的氧化物只有2种
D.炼铁过程中,木炭只是作为燃料使用
B
3.(2022泰州节选)金属材料为促进生产发展、改善人类生活发挥了重要作用。
(5)《吕氏春秋》记载“金柔锡柔,合两柔则刚”(注:金指铜单质,锡指锡单质,刚指坚硬)。这句话说明铜锡合金相较于铜、锡的特点是
。
硬度大
4. (2022成都)我国有着悠久的钢铁冶
炼史,《天工开物》中记载的“炒钢法”
如图1,该方法的生产过程可用图2表示。
资料:①潮泥灰主要成分是石灰石。
②铁的熔点是1535℃。
根据图文回答下列问题。
(1)常见的铁矿石有赤铁矿和 (写一种)。
(2)不断鼓入空气的目的是 。
(3)炼铁炉中生成铁的化学方程式为 。
(4)撒入潮泥灰主要作用是 。不断翻炒液态生铁,是为了降低 元素的含量。
(5)钢的性能优良,如钢的熔点比纯铁 ,易于加工。
磁铁矿(合理即可)
提高炉温
碳或C
将铁矿石中的二氧化硅转化为炉渣而除去
Fe2O3+3CO高温 2Fe+3CO2
低
课堂小结
1.大多数金属具有共同的物理性质,如具有金属光泽、可以导电和导热、延展性良好等
2.合金是在一种金属中加热熔合其他金属或非金属而形成的具有金属特性的物质
3.工业炼铁的主要化学反应原理是:
Fe2O3 + 3CO ==== 2Fe + 3CO2
高温
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
