化学人教版(2019)必修第二册5.1.3硫酸和硫酸盐(共17张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.1.3硫酸和硫酸盐(共17张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 6.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-07 11:01:42 | ||
图片预览





文档简介
(共17张PPT)
新人教版必修第二册
第五章 化工生产中重要的非金属元素
第一节 硫及其化合物
第3课时 硫酸和硫酸盐
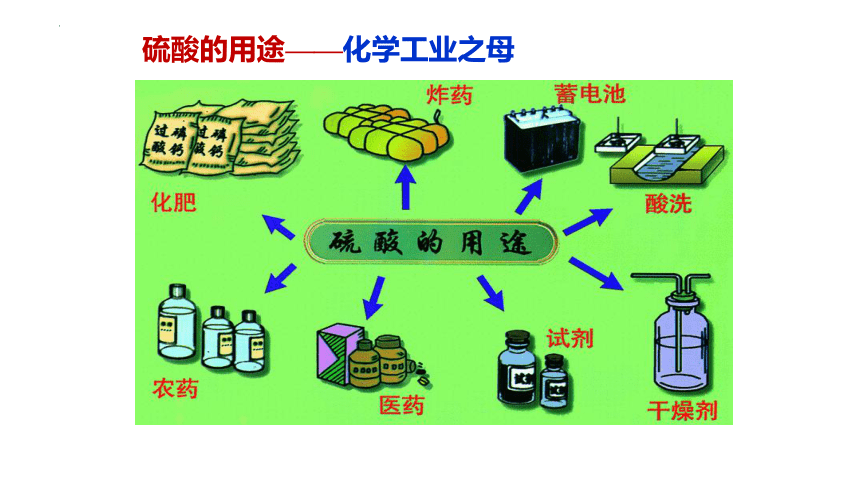
硫酸的用途——化学工业之母
1.高沸点——制取挥发性酸
2.吸水性——做干燥剂
3.脱水性——做催化剂
4.酸性——去金属表面的氧化物、制取硫酸盐、制造化肥
5.强氧化性——制炸药
硫酸的用途——化学工业之母
1.高沸点——制取挥发性酸
2.吸水性——做干燥剂
3.脱水性——做催化剂
4.酸性——去金属表面的氧化物、制取硫酸盐、制造化肥
5.强氧化性——制炸药
浓硫酸与金属Cu的反应
浓硫酸:氧化性、酸性
Tips:浓度影响物质的氧化性。随着反应的进行,浓硫酸慢慢变成稀硫酸,不再体现中心硫元素的氧化性。稀硫酸中氢离子也有氧化性,可以与活泼金属反应产生氢气。可惜,铜是氢后金属。反应就这样停止了!
铜可以和浓硫酸反应在加热的条件下反应,
请预测下锌与浓硫酸的反应?
吸水性与脱水性区别
吸水性与脱水性的本质区别在于物质本身是否含有水分子,若物质本身含有水分子(包括晶体中的结晶水),则表现为吸水性
浓硫酸与金属Zn的反应
【例1】将一定量的锌粉与 100mL 18.4mol/L 浓硫酸充分反应后,锌粉完全溶解,同时生成16.8L气体X(标准状况)。将反应后所得的溶液稀释到1L,测得溶液中的c(H+)=1mol/L。求生成的气体成分?
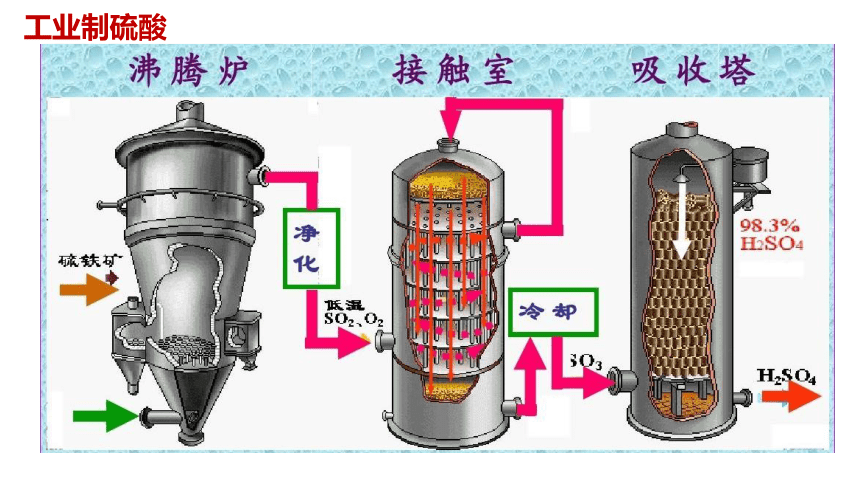
工业制硫酸
△
4FeS2 + 11O2 == 2Fe2O3 + 8SO2
△
SO3+H2O=H2SO4
加热
工业制硫酸
硫酸根离子的检验及硫酸盐介绍
取样,先加稀盐酸酸化,再加BaCl2溶液,现象,对应的结论
CO3
SO3
2-
2-
排出
干扰
投石问路
Ag+
SO42-的检验
BaSO4
白色沉淀
生产生活中的硫酸盐
石膏像
CaSO4·2H2O 2CaSO4·H2O
石膏 熟石膏
150℃
加水
用途
1制作模型与医疗绷带;
2调节水泥硬化速率
硫酸钡
钡餐双重造影
1生产其它钡盐;
2医疗上X射线内服药剂,钡餐
加水
加热失水
无水硫酸铜用于检测水的存在
无水CuSO4
CuSO4·5H2O(俗称胆矾)
胆矾可以和石灰乳混合制成一种常用的农药——波尔多液
1.在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应存在这种情况的是( )
①过量的锌与18 mol·L-1的H2SO4溶液反应 ②过量的氢气与少量的氮气在催化剂存在下充分反应 ③浓盐酸与过量的MnO2反应
④过量的铜与浓硫酸反应 ⑤过量的稀硝酸与银反应 ⑥过量的稀硫酸与块状石灰石反应
A.②③④⑥ B.②③⑤ C.①④⑤ D.①②③④⑤⑥
5.在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应存在这种情况的是( D )
①过量的锌与18 mol·L-1的H2SO4溶液反应 ②过量的氢气与少量的氮气在催化剂存在下充分反应 ③浓盐酸与过量的MnO2反应
④过量的铜与浓硫酸反应 ⑤过量的稀硝酸与银反应 ⑥过量的稀硫酸与块状石灰石反应
A①②③④⑤⑥ B.②③⑤ C.①④⑤ D.②③④⑥
解析:本题易错之处在于不理解溶液浓度变化对反应进程的影响及反应实质。①过量锌与18 mol·L-1的H2SO4溶液反应,锌先与浓硫酸反应,随着反应的进行,H2SO4溶液浓度减小,锌再与稀硫酸反应,故H2SO4能完全反应;②合成氨的反应是可逆反应,氢气过量时氮气也不能完全反应;③浓盐酸与过量的MnO2反应,随着反应的进行,盐酸浓度减小,反应会停止,故HCl不能完全反应;④过量铜与浓硫酸反应,随着反应的进行,H2SO4溶液浓度减小,铜与稀硫酸不反应,故H2SO4不能完全反应;⑤稀硝酸能与银反应,故稀硝酸过量时银能完全反应;⑥过量稀硫酸与块状石灰石反应时,由于生成的硫酸钙微溶,覆盖在石灰石表面,阻碍反应的进行,故石灰石不能完全反应。综上分析,D项正确。
2.铜粉放入稀硫酸中,加热后也无明显现象。当加入一种盐后,铜粉质量减少,溶液呈蓝色,同时有气体逸出,该盐是( )
A.Fe2(SO4)3 B.Na2CO3 C.KNO3 D.FeSO4
解析:铜与稀硫酸不反应,但加入KNO3后,由于溶液中有H+和NO存在,故会发生反应:3Cu+8H++2NO===3Cu2++2NO↑+4H2O,C符合题意;加入Fe2(SO4)3,Fe3+可与Cu发生反应,生成Cu2+和Fe2+,也能使铜粉的质量减少,溶液变蓝色,但无气体逸出,A不符合题意;加入Na2CO3,有气体逸出,但铜粉质量不减少,B不符合题意。加入FeSO4,铜粉质量不减少,也无气体逸出,D不符合题意。
新人教版必修第二册
第五章 化工生产中重要的非金属元素
第一节 硫及其化合物
第3课时 硫酸和硫酸盐
硫酸的用途——化学工业之母
1.高沸点——制取挥发性酸
2.吸水性——做干燥剂
3.脱水性——做催化剂
4.酸性——去金属表面的氧化物、制取硫酸盐、制造化肥
5.强氧化性——制炸药
硫酸的用途——化学工业之母
1.高沸点——制取挥发性酸
2.吸水性——做干燥剂
3.脱水性——做催化剂
4.酸性——去金属表面的氧化物、制取硫酸盐、制造化肥
5.强氧化性——制炸药
浓硫酸与金属Cu的反应
浓硫酸:氧化性、酸性
Tips:浓度影响物质的氧化性。随着反应的进行,浓硫酸慢慢变成稀硫酸,不再体现中心硫元素的氧化性。稀硫酸中氢离子也有氧化性,可以与活泼金属反应产生氢气。可惜,铜是氢后金属。反应就这样停止了!
铜可以和浓硫酸反应在加热的条件下反应,
请预测下锌与浓硫酸的反应?
吸水性与脱水性区别
吸水性与脱水性的本质区别在于物质本身是否含有水分子,若物质本身含有水分子(包括晶体中的结晶水),则表现为吸水性
浓硫酸与金属Zn的反应
【例1】将一定量的锌粉与 100mL 18.4mol/L 浓硫酸充分反应后,锌粉完全溶解,同时生成16.8L气体X(标准状况)。将反应后所得的溶液稀释到1L,测得溶液中的c(H+)=1mol/L。求生成的气体成分?
工业制硫酸
△
4FeS2 + 11O2 == 2Fe2O3 + 8SO2
△
SO3+H2O=H2SO4
加热
工业制硫酸
硫酸根离子的检验及硫酸盐介绍
取样,先加稀盐酸酸化,再加BaCl2溶液,现象,对应的结论
CO3
SO3
2-
2-
排出
干扰
投石问路
Ag+
SO42-的检验
BaSO4
白色沉淀
生产生活中的硫酸盐
石膏像
CaSO4·2H2O 2CaSO4·H2O
石膏 熟石膏
150℃
加水
用途
1制作模型与医疗绷带;
2调节水泥硬化速率
硫酸钡
钡餐双重造影
1生产其它钡盐;
2医疗上X射线内服药剂,钡餐
加水
加热失水
无水硫酸铜用于检测水的存在
无水CuSO4
CuSO4·5H2O(俗称胆矾)
胆矾可以和石灰乳混合制成一种常用的农药——波尔多液
1.在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应存在这种情况的是( )
①过量的锌与18 mol·L-1的H2SO4溶液反应 ②过量的氢气与少量的氮气在催化剂存在下充分反应 ③浓盐酸与过量的MnO2反应
④过量的铜与浓硫酸反应 ⑤过量的稀硝酸与银反应 ⑥过量的稀硫酸与块状石灰石反应
A.②③④⑥ B.②③⑤ C.①④⑤ D.①②③④⑤⑥
5.在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应存在这种情况的是( D )
①过量的锌与18 mol·L-1的H2SO4溶液反应 ②过量的氢气与少量的氮气在催化剂存在下充分反应 ③浓盐酸与过量的MnO2反应
④过量的铜与浓硫酸反应 ⑤过量的稀硝酸与银反应 ⑥过量的稀硫酸与块状石灰石反应
A①②③④⑤⑥ B.②③⑤ C.①④⑤ D.②③④⑥
解析:本题易错之处在于不理解溶液浓度变化对反应进程的影响及反应实质。①过量锌与18 mol·L-1的H2SO4溶液反应,锌先与浓硫酸反应,随着反应的进行,H2SO4溶液浓度减小,锌再与稀硫酸反应,故H2SO4能完全反应;②合成氨的反应是可逆反应,氢气过量时氮气也不能完全反应;③浓盐酸与过量的MnO2反应,随着反应的进行,盐酸浓度减小,反应会停止,故HCl不能完全反应;④过量铜与浓硫酸反应,随着反应的进行,H2SO4溶液浓度减小,铜与稀硫酸不反应,故H2SO4不能完全反应;⑤稀硝酸能与银反应,故稀硝酸过量时银能完全反应;⑥过量稀硫酸与块状石灰石反应时,由于生成的硫酸钙微溶,覆盖在石灰石表面,阻碍反应的进行,故石灰石不能完全反应。综上分析,D项正确。
2.铜粉放入稀硫酸中,加热后也无明显现象。当加入一种盐后,铜粉质量减少,溶液呈蓝色,同时有气体逸出,该盐是( )
A.Fe2(SO4)3 B.Na2CO3 C.KNO3 D.FeSO4
解析:铜与稀硫酸不反应,但加入KNO3后,由于溶液中有H+和NO存在,故会发生反应:3Cu+8H++2NO===3Cu2++2NO↑+4H2O,C符合题意;加入Fe2(SO4)3,Fe3+可与Cu发生反应,生成Cu2+和Fe2+,也能使铜粉的质量减少,溶液变蓝色,但无气体逸出,A不符合题意;加入Na2CO3,有气体逸出,但铜粉质量不减少,B不符合题意。加入FeSO4,铜粉质量不减少,也无气体逸出,D不符合题意。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
