化学人教版(2019)选择性必修3 2.2.1烯烃的结构与性质(共32张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 2.2.1烯烃的结构与性质(共32张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 6.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-07 11:08:37 | ||
图片预览




文档简介
(共32张PPT)
走进奇妙的化学世界
选择性必修3
第二章 烃
第二节 烯烃 炔烃
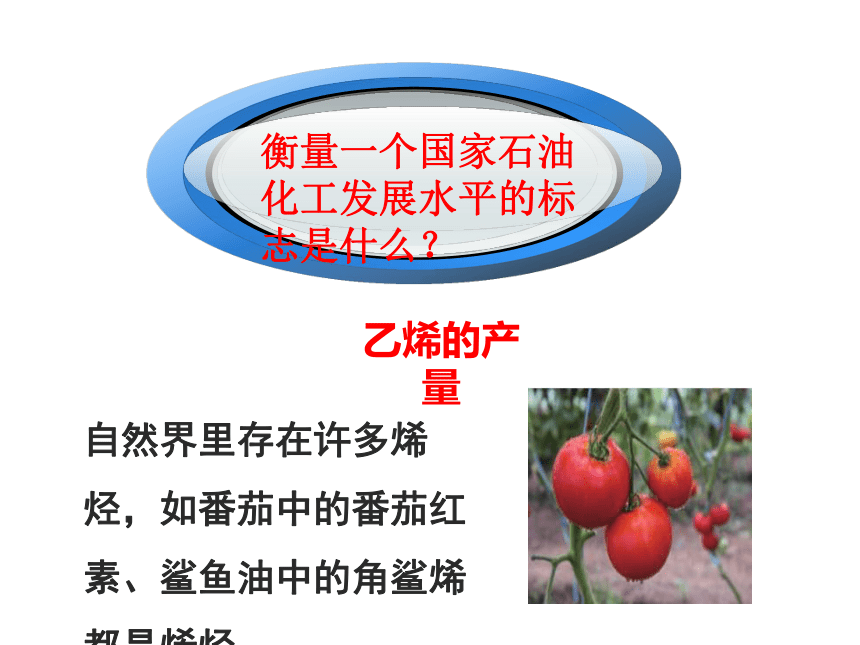
衡量一个国家石油化工发展水平的标志是什么?
一
乙烯的产量
自然界里存在许多烯烃,如番茄中的番茄红素、鲨鱼油中的角鲨烯都是烯烃。
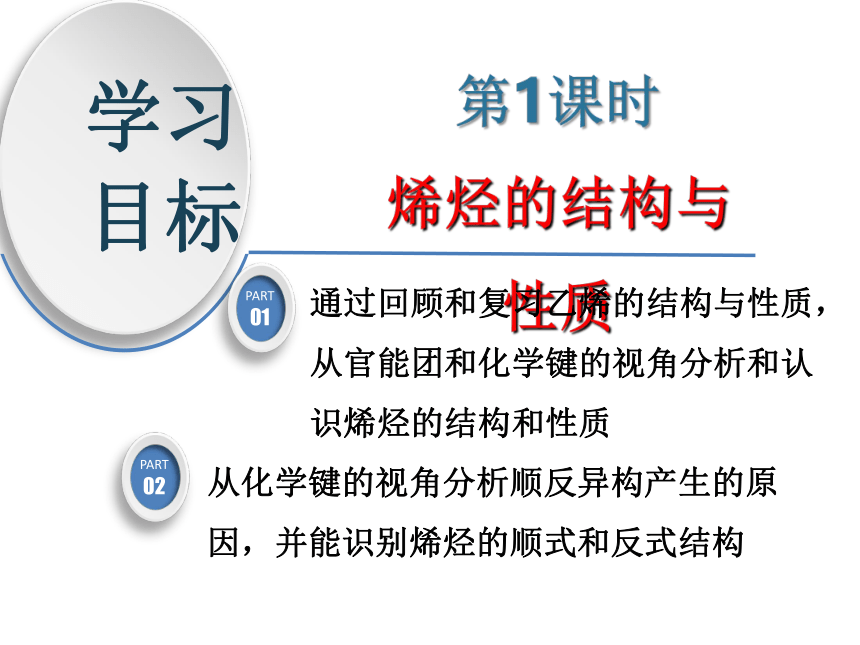
学习
目标
第1课时
烯烃的结构与性质
PART
01
PART
02
通过回顾和复习乙烯的结构与性质,从官能团和化学键的视角分析和认识烯烃的结构和性质
从化学键的视角分析顺反异构产生的原因,并能识别烯烃的顺式和反式结构
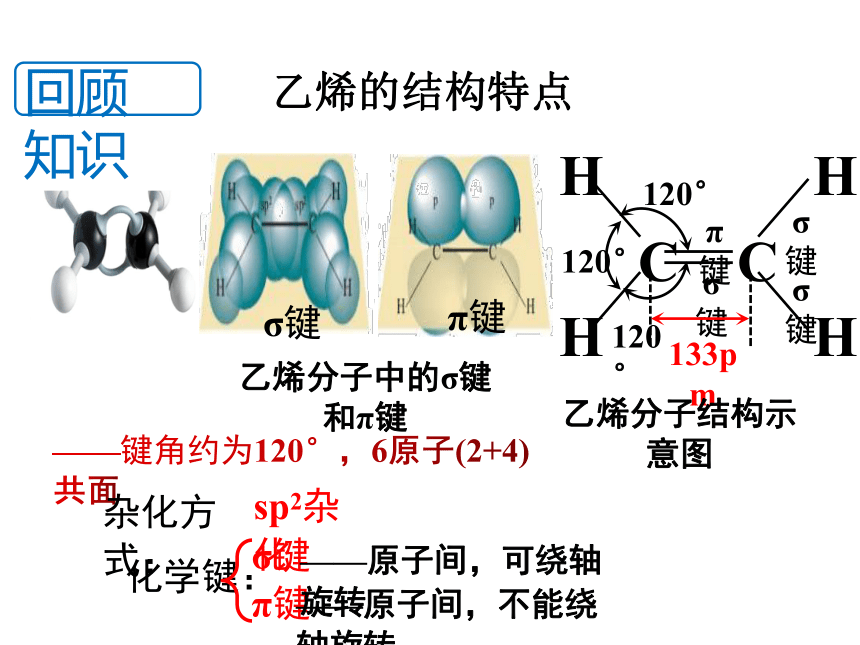
回顾知识
σ键
π键
乙烯分子中的σ键和π键
C
C
H
H
H
H
σ键
σ键
π键
σ键
133pm
120°
120°
120°
——键角约为120°,6原子(2+4)共面
乙烯分子结构示意图
杂化方式:
sp2杂化
化学键:
σ键
π键
——原子间,可绕轴旋转
——原子间,不能绕轴旋转
乙烯的结构特点
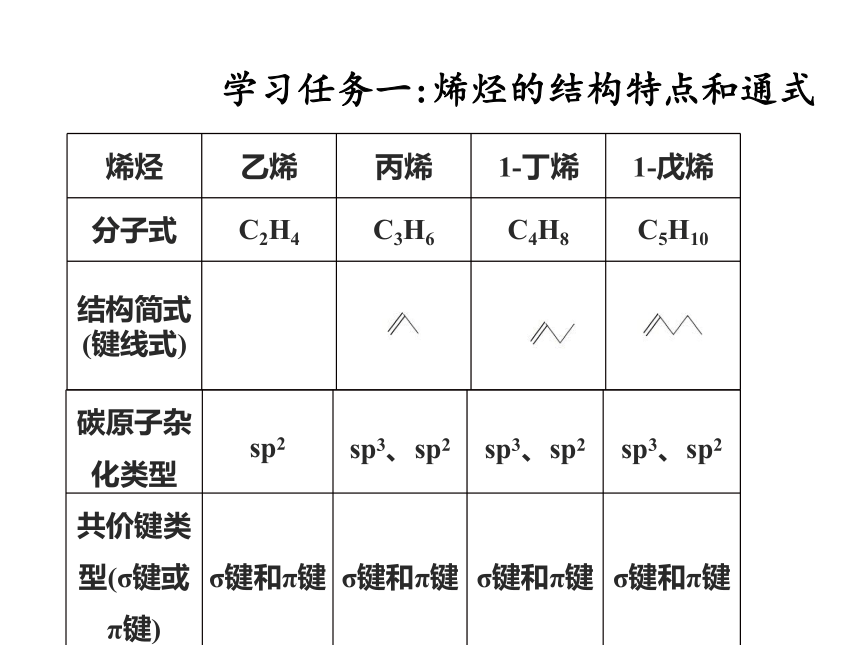
根据以下的几种烯烃的结构简式或球棍模型,分析得出单烯烃的官能团、组成通式、化学键的种类。
烯烃 乙烯 丙烯 1 丁烯 1 戊烯
分子式 C2H4 C3H6 C4H8 C5H10
结构简式(键线式)
碳原子杂化类型 sp2 sp3、sp2 sp3、sp2 sp3、sp2
共价键类型(σ键或π键) σ键和π键 σ键和π键 σ键和π键 σ键和π键
学习任务一:烯烃的结构特点和通式
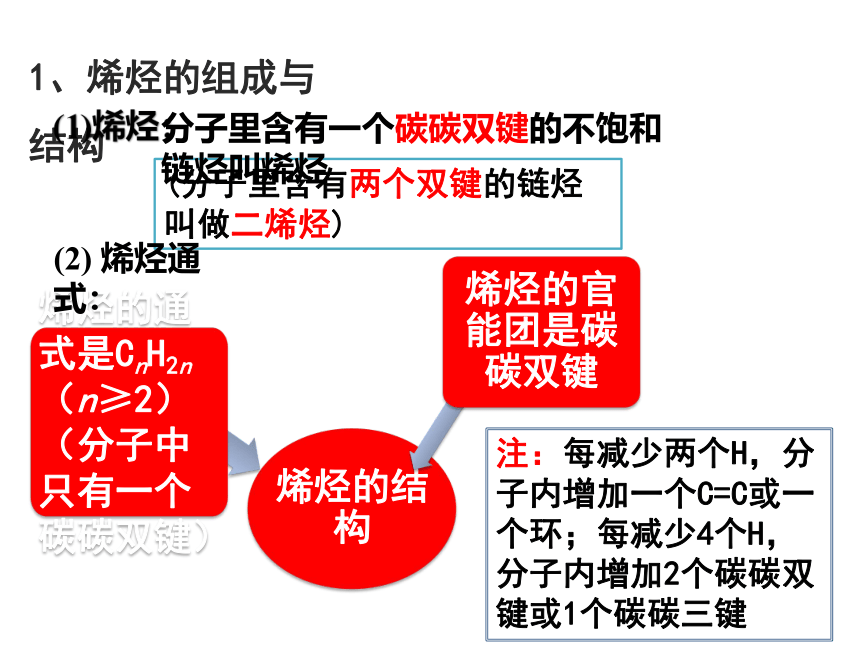
1、烯烃的组成与结构
烯烃的结构
烯烃的通式是CnH2n(n≥2)(分子中只有一个碳碳双键)
烯烃的官能团是碳碳双键
(分子里含有两个双键的链烃叫做二烯烃)
注:每减少两个H,分子内增加一个C=C或一个环;每减少4个H,分子内增加2个碳碳双键或1个碳碳三键
(1)烯烃:
分子里含有一个碳碳双键的不饱和链烃叫烯烃
(2) 烯烃通式:
C=C
H3C
H
CH3
H
C=C
H3C
CH3
H
H
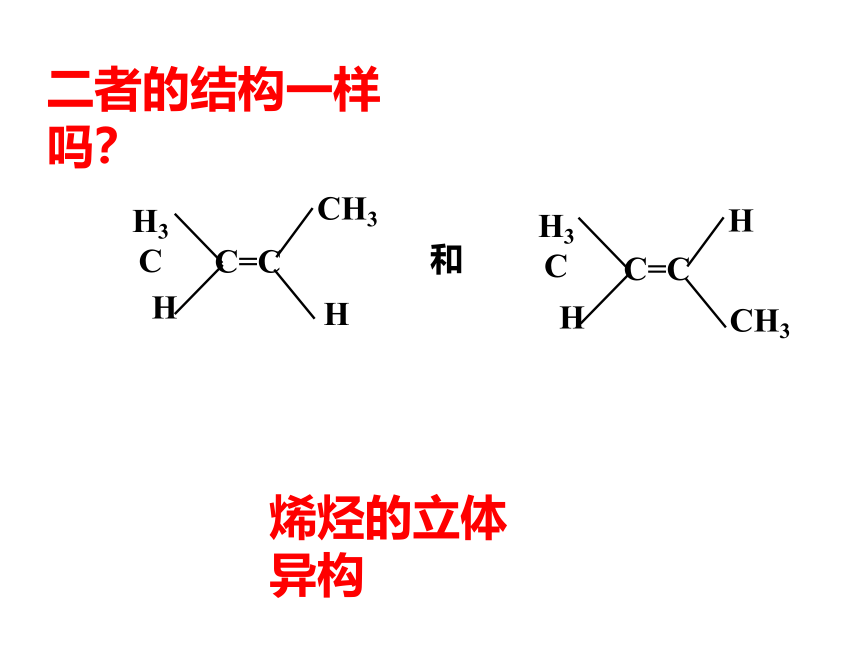
二者的结构一样吗?
和
烯烃的立体异构
2.烯烃的立体异构
通过碳碳双键 连接的原子或原子团不能绕键轴旋转会导致其空间排列方式不同,产生顺反异构现象。
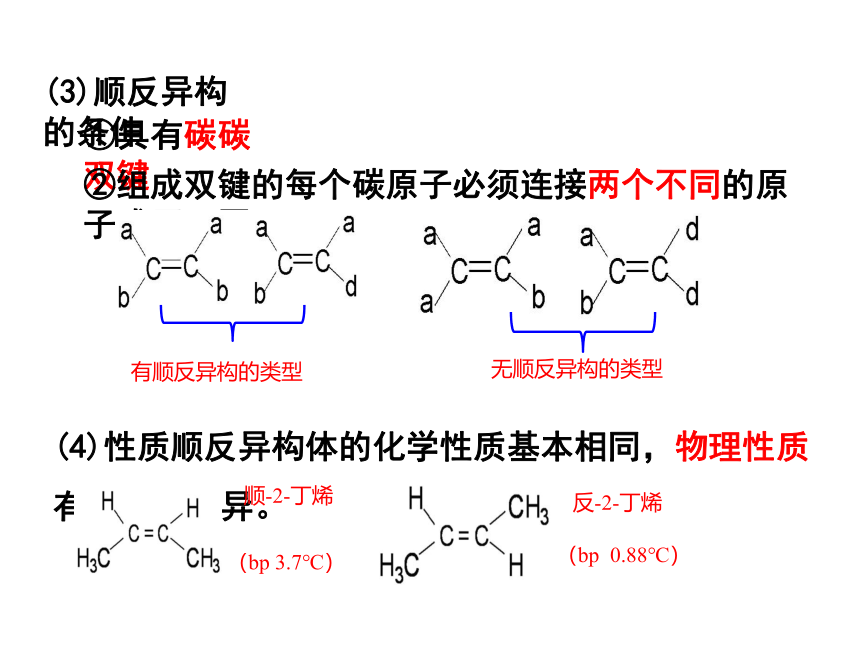
(1)顺反异构现象
(2)顺反异构体
相同的原子或原子团位于双键同一侧的称为顺式结构,相同的原子或原子团位于双键两侧的称为反式结构,例如顺 -2 -丁烯和反 -2 -丁烯的结构简式分别是 和
(3)顺反异构的条件
①具有碳碳双键
②组成双键的每个碳原子必须连接两个不同的原子或原子团。
有顺反异构的类型
无顺反异构的类型
(4)性质顺反异构体的化学性质基本相同,物理性质有一定的差异。
顺-2-丁烯
(bp 3.7℃)
反-2-丁烯
(bp 0.88℃)
练习:下列化合物中存在顺、反异构的写出构型式:
(1) CH2 = CH-CH2-CH3
(2) CH3-CH2-CH=CH-CH3
(3) CH3-CH = CCl2
(4) 2-甲基-1-丙烯
无
有
无
无
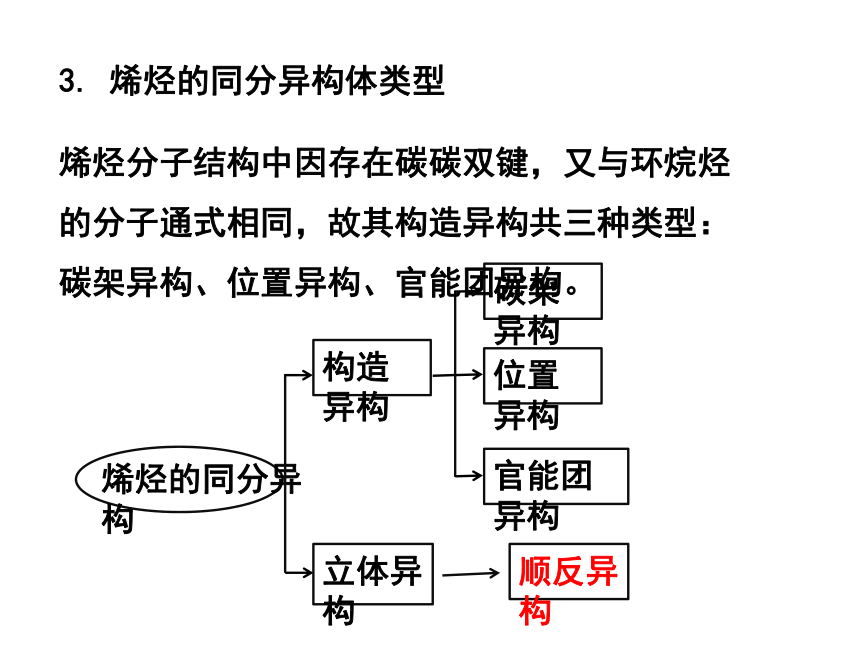
烯烃的同分异构
构造异构
立体异构
碳架异构
位置异构
官能团异构
顺反异构
3. 烯烃的同分异构体类型
烯烃分子结构中因存在碳碳双键,又与环烷烃的分子通式相同,故其构造异构共三种类型:碳架异构、位置异构、官能团异构。
同分异构体的书写方法 ---位置异构
先根据给定的碳原子数,写出具有此碳原子数可能的碳链形式(碳骨架),再根据碳链对称性
将官能团(双键)插入碳链中,再根据碳原子形成4个共价键,补写各碳原子所结合的氢原子数。
插入法( 适用于烯烃、炔烃、酯等 )
试着写出分子式为C5H10的烯烃同分异构体
命名方法:与烷烃相似,即“长、近、简、多、小”的命名原则。但不同点是主链必须含有官能团(如:双键或三键)。
命名步骤:
1、选主链,含官能团;
2、定编号,近官能团;
3、写名称,标官能团。
4、其它要求与烷烃相同!
CH3—C=CH—CH—CH2—CH3
CH3
CH3
某己烯
2
3
4
1
6
5
CH3—C=CH—CH—CH2—CH3
CH3
CH3
2,4-二甲基-2-己烯
知识补充
烯烃的命名
CH3—CH—CH2—CH—CH=CH2
CH3
CH3
2
3
4
1
6
5
3,5-二甲基-1-己烯
例:
CH3—C=CH—C=CH—CH3
CH3
CH3
1 2 3 4 5 6
2,4-二甲基-2,4-己二烯
用系统命名法命名
CH3—C C —CH2—CH3
CH3 CH3
2,3—二甲基—2—戊烯
H
H
取代基位置
取代基名称
双键位置
主链名称
取代基数目
2,3 -二甲基- 1 -丁烯
5,6- 二甲基 -3 -乙基 -1 -庚炔
学习任务二:烯烃的性质
1.物理性质
随着分子中碳原子数的递增,
1、相对分子质量越大, 分子间作用力越强, 沸点逐渐升高。
2、密度逐渐增大,都小于水的密度。
3、常温下的状态:气态→液态→固态。
碳原子数相同时,支链越多,熔沸点越低。
标准状况下 C2—C4呈气态
4、溶解性:
不溶于水,易溶于有机溶剂
乙烯的化学性质
烯烃的结构特征
烯烃的化学性质
预测
有碳碳双键
有碳氢单键
在空气中能燃烧
能发生加成反应或加聚反应
能被酸性高锰酸钾溶液氧化
一定条件下能发生取代反应
在空气中能燃烧
能发生加成反应或加聚反应
能被酸性高锰酸钾溶液氧化
①氧化反应
a.丙烯燃烧的反应方程式
b.烯烃都能使酸性KMnO4溶液褪色。
O2
nCO2+nH2O
CnH2n+
烯烃燃烧的通式
2.烯烃的化学性质
烯烃中含有不饱和键,相较于烷烃,性质更加活泼,易被酸性高锰酸钾等氧化剂氧化。可用此方法可以检验烯烃与烷烃。
②加成反应:丙烯与溴的四氯化碳反应:
注:烯烃可使Br2的CCl4溶液或Br2的水溶液褪色,用此方法可以检验烯烃与烷烃
H
H
C C
︱
︱
Br
Br
︱
︱
CH3
H
︱
H
CH3
C=C-H
+
Br-Br
︱
H
1,2-二溴乙烷
无色液体,密度比水大,难溶于水。
(主要)
(次要)
练1、丙烯与溴化氢反应后,会生成什么产物呢?试写出丙烯与溴化氢的加成反应的化学方程式,并思考原因。
可以通过调控反应条件得到不同产物,当不对称烯烃与卤化氢发生加成反应时,通常“氢加到含氢多的不饱和碳原子一侧。
练2、根据上述所学知识,能否写出丙烯与水的加成反应的化学方程式呢?
CH2══CHCH3+H2 (CH3) 2CH—OH
CH2══CHCH3+H2 CH3CH2CH2—OH
注意
催化剂
△
催化剂
△
③加聚反应:丙烯加聚反应:
分别写出下列物质发生加聚反应的化学方程式
CH2=CHCH2CH3
CH3C=CHCH3
CH3
nCH2=CHCH2CH3
催化剂
[CH2—CH ]n
CH2CH3
nCH3C=CHCH3
催化剂
[ C — CH ]n
CH3
CH3
CH3
CH3
nCH=CH2 [CH CH2]n
催化剂
△, P
(聚丙烯)
CH3
CH3
加聚反应是获得高分子材料的重要途径之一,人们日常生活中经常接触到的聚乙烯、聚氯乙烯、聚苯乙烯、ABS工程塑料、顺丁橡胶等材料,以及一些重要新型材料如导电高聚物等都是通过加聚反应得到的。
聚乙烯塑料
合成橡胶
CH2=CH—CH=CH2+Cl2
CH2—CH—CH=CH2
Cl
Cl
(1)1,2-加成
CH2=CH—CH=CH2+Cl2
CH2—CH=CH—CH2
Cl
Cl
(2)1,4-加成
1. 定义:分子中含有两个碳碳双键的烯烃
2. 代表物——CH2=CH-CH=CH2 1,3-丁二烯
3. 化学性质:加成反应
1,3-丁二烯的1,2-加成和1,4-加成是竞争反应,到底哪一种加成占优势,取决于反应条件。在温度较高的条件下大多发生1,4-加成,在温度较低的条件下大多发生1,2-加成。
二烯烃
nCH2=CH-CH=CH2→
(3)完全加成:CH2=CH-CH=CH2+2Cl2→CH2Cl-CHCl-CHCl-CH2Cl
加聚反应:
1.1 mol丙烯与Cl2发生加成反应,得到的产物再与Cl2发生取代反应,两个过程最多消耗Cl2的物质的量为( )
A.2 mol B.4 mol C.7 mol D.8 mol
2.下列烯烃中存在顺反异构体的是( )
A.丙烯 B.1 -丁烯
C.2 -戊烯 D.2 -甲基- 2 -丁烯
C
C
3.某烃的结构用键线式可表示为 ,则该烃与Br2加成时(物质的量之比为1∶1)所得产物有
A.3种 B.4种 C.5种 D.6种
C
4.下列各组物质在一定条件下反应,可以制得较纯净的1,2-二氯乙烷的是
A.乙烷与氯气在光照条件下反应 B.乙烯与氯化氢气体混合
C.乙烯与氯气混合 D.乙烯通入浓盐酸
C
这一事实可用于解释人眼的夜视功能和叶绿素在光合作用中极高的光能利用率。下列说法错误的是
A.X和Y互为同分异构体 B.X和Y中所有原子都可能共面
C.利用溴水可以区分X和Y D.X和Y都可以发生加聚反应
5.泽维尔证实了光可诱发下列变化:
C
X
Y
6.用系统命名法给下列结构简式命名和根据名称写结构简式
【课堂回眸】
走进奇妙的化学世界
选择性必修3
第二章 烃
第二节 烯烃 炔烃
衡量一个国家石油化工发展水平的标志是什么?
一
乙烯的产量
自然界里存在许多烯烃,如番茄中的番茄红素、鲨鱼油中的角鲨烯都是烯烃。
学习
目标
第1课时
烯烃的结构与性质
PART
01
PART
02
通过回顾和复习乙烯的结构与性质,从官能团和化学键的视角分析和认识烯烃的结构和性质
从化学键的视角分析顺反异构产生的原因,并能识别烯烃的顺式和反式结构
回顾知识
σ键
π键
乙烯分子中的σ键和π键
C
C
H
H
H
H
σ键
σ键
π键
σ键
133pm
120°
120°
120°
——键角约为120°,6原子(2+4)共面
乙烯分子结构示意图
杂化方式:
sp2杂化
化学键:
σ键
π键
——原子间,可绕轴旋转
——原子间,不能绕轴旋转
乙烯的结构特点
根据以下的几种烯烃的结构简式或球棍模型,分析得出单烯烃的官能团、组成通式、化学键的种类。
烯烃 乙烯 丙烯 1 丁烯 1 戊烯
分子式 C2H4 C3H6 C4H8 C5H10
结构简式(键线式)
碳原子杂化类型 sp2 sp3、sp2 sp3、sp2 sp3、sp2
共价键类型(σ键或π键) σ键和π键 σ键和π键 σ键和π键 σ键和π键
学习任务一:烯烃的结构特点和通式
1、烯烃的组成与结构
烯烃的结构
烯烃的通式是CnH2n(n≥2)(分子中只有一个碳碳双键)
烯烃的官能团是碳碳双键
(分子里含有两个双键的链烃叫做二烯烃)
注:每减少两个H,分子内增加一个C=C或一个环;每减少4个H,分子内增加2个碳碳双键或1个碳碳三键
(1)烯烃:
分子里含有一个碳碳双键的不饱和链烃叫烯烃
(2) 烯烃通式:
C=C
H3C
H
CH3
H
C=C
H3C
CH3
H
H
二者的结构一样吗?
和
烯烃的立体异构
2.烯烃的立体异构
通过碳碳双键 连接的原子或原子团不能绕键轴旋转会导致其空间排列方式不同,产生顺反异构现象。
(1)顺反异构现象
(2)顺反异构体
相同的原子或原子团位于双键同一侧的称为顺式结构,相同的原子或原子团位于双键两侧的称为反式结构,例如顺 -2 -丁烯和反 -2 -丁烯的结构简式分别是 和
(3)顺反异构的条件
①具有碳碳双键
②组成双键的每个碳原子必须连接两个不同的原子或原子团。
有顺反异构的类型
无顺反异构的类型
(4)性质顺反异构体的化学性质基本相同,物理性质有一定的差异。
顺-2-丁烯
(bp 3.7℃)
反-2-丁烯
(bp 0.88℃)
练习:下列化合物中存在顺、反异构的写出构型式:
(1) CH2 = CH-CH2-CH3
(2) CH3-CH2-CH=CH-CH3
(3) CH3-CH = CCl2
(4) 2-甲基-1-丙烯
无
有
无
无
烯烃的同分异构
构造异构
立体异构
碳架异构
位置异构
官能团异构
顺反异构
3. 烯烃的同分异构体类型
烯烃分子结构中因存在碳碳双键,又与环烷烃的分子通式相同,故其构造异构共三种类型:碳架异构、位置异构、官能团异构。
同分异构体的书写方法 ---位置异构
先根据给定的碳原子数,写出具有此碳原子数可能的碳链形式(碳骨架),再根据碳链对称性
将官能团(双键)插入碳链中,再根据碳原子形成4个共价键,补写各碳原子所结合的氢原子数。
插入法( 适用于烯烃、炔烃、酯等 )
试着写出分子式为C5H10的烯烃同分异构体
命名方法:与烷烃相似,即“长、近、简、多、小”的命名原则。但不同点是主链必须含有官能团(如:双键或三键)。
命名步骤:
1、选主链,含官能团;
2、定编号,近官能团;
3、写名称,标官能团。
4、其它要求与烷烃相同!
CH3—C=CH—CH—CH2—CH3
CH3
CH3
某己烯
2
3
4
1
6
5
CH3—C=CH—CH—CH2—CH3
CH3
CH3
2,4-二甲基-2-己烯
知识补充
烯烃的命名
CH3—CH—CH2—CH—CH=CH2
CH3
CH3
2
3
4
1
6
5
3,5-二甲基-1-己烯
例:
CH3—C=CH—C=CH—CH3
CH3
CH3
1 2 3 4 5 6
2,4-二甲基-2,4-己二烯
用系统命名法命名
CH3—C C —CH2—CH3
CH3 CH3
2,3—二甲基—2—戊烯
H
H
取代基位置
取代基名称
双键位置
主链名称
取代基数目
2,3 -二甲基- 1 -丁烯
5,6- 二甲基 -3 -乙基 -1 -庚炔
学习任务二:烯烃的性质
1.物理性质
随着分子中碳原子数的递增,
1、相对分子质量越大, 分子间作用力越强, 沸点逐渐升高。
2、密度逐渐增大,都小于水的密度。
3、常温下的状态:气态→液态→固态。
碳原子数相同时,支链越多,熔沸点越低。
标准状况下 C2—C4呈气态
4、溶解性:
不溶于水,易溶于有机溶剂
乙烯的化学性质
烯烃的结构特征
烯烃的化学性质
预测
有碳碳双键
有碳氢单键
在空气中能燃烧
能发生加成反应或加聚反应
能被酸性高锰酸钾溶液氧化
一定条件下能发生取代反应
在空气中能燃烧
能发生加成反应或加聚反应
能被酸性高锰酸钾溶液氧化
①氧化反应
a.丙烯燃烧的反应方程式
b.烯烃都能使酸性KMnO4溶液褪色。
O2
nCO2+nH2O
CnH2n+
烯烃燃烧的通式
2.烯烃的化学性质
烯烃中含有不饱和键,相较于烷烃,性质更加活泼,易被酸性高锰酸钾等氧化剂氧化。可用此方法可以检验烯烃与烷烃。
②加成反应:丙烯与溴的四氯化碳反应:
注:烯烃可使Br2的CCl4溶液或Br2的水溶液褪色,用此方法可以检验烯烃与烷烃
H
H
C C
︱
︱
Br
Br
︱
︱
CH3
H
︱
H
CH3
C=C-H
+
Br-Br
︱
H
1,2-二溴乙烷
无色液体,密度比水大,难溶于水。
(主要)
(次要)
练1、丙烯与溴化氢反应后,会生成什么产物呢?试写出丙烯与溴化氢的加成反应的化学方程式,并思考原因。
可以通过调控反应条件得到不同产物,当不对称烯烃与卤化氢发生加成反应时,通常“氢加到含氢多的不饱和碳原子一侧。
练2、根据上述所学知识,能否写出丙烯与水的加成反应的化学方程式呢?
CH2══CHCH3+H2 (CH3) 2CH—OH
CH2══CHCH3+H2 CH3CH2CH2—OH
注意
催化剂
△
催化剂
△
③加聚反应:丙烯加聚反应:
分别写出下列物质发生加聚反应的化学方程式
CH2=CHCH2CH3
CH3C=CHCH3
CH3
nCH2=CHCH2CH3
催化剂
[CH2—CH ]n
CH2CH3
nCH3C=CHCH3
催化剂
[ C — CH ]n
CH3
CH3
CH3
CH3
nCH=CH2 [CH CH2]n
催化剂
△, P
(聚丙烯)
CH3
CH3
加聚反应是获得高分子材料的重要途径之一,人们日常生活中经常接触到的聚乙烯、聚氯乙烯、聚苯乙烯、ABS工程塑料、顺丁橡胶等材料,以及一些重要新型材料如导电高聚物等都是通过加聚反应得到的。
聚乙烯塑料
合成橡胶
CH2=CH—CH=CH2+Cl2
CH2—CH—CH=CH2
Cl
Cl
(1)1,2-加成
CH2=CH—CH=CH2+Cl2
CH2—CH=CH—CH2
Cl
Cl
(2)1,4-加成
1. 定义:分子中含有两个碳碳双键的烯烃
2. 代表物——CH2=CH-CH=CH2 1,3-丁二烯
3. 化学性质:加成反应
1,3-丁二烯的1,2-加成和1,4-加成是竞争反应,到底哪一种加成占优势,取决于反应条件。在温度较高的条件下大多发生1,4-加成,在温度较低的条件下大多发生1,2-加成。
二烯烃
nCH2=CH-CH=CH2→
(3)完全加成:CH2=CH-CH=CH2+2Cl2→CH2Cl-CHCl-CHCl-CH2Cl
加聚反应:
1.1 mol丙烯与Cl2发生加成反应,得到的产物再与Cl2发生取代反应,两个过程最多消耗Cl2的物质的量为( )
A.2 mol B.4 mol C.7 mol D.8 mol
2.下列烯烃中存在顺反异构体的是( )
A.丙烯 B.1 -丁烯
C.2 -戊烯 D.2 -甲基- 2 -丁烯
C
C
3.某烃的结构用键线式可表示为 ,则该烃与Br2加成时(物质的量之比为1∶1)所得产物有
A.3种 B.4种 C.5种 D.6种
C
4.下列各组物质在一定条件下反应,可以制得较纯净的1,2-二氯乙烷的是
A.乙烷与氯气在光照条件下反应 B.乙烯与氯化氢气体混合
C.乙烯与氯气混合 D.乙烯通入浓盐酸
C
这一事实可用于解释人眼的夜视功能和叶绿素在光合作用中极高的光能利用率。下列说法错误的是
A.X和Y互为同分异构体 B.X和Y中所有原子都可能共面
C.利用溴水可以区分X和Y D.X和Y都可以发生加聚反应
5.泽维尔证实了光可诱发下列变化:
C
X
Y
6.用系统命名法给下列结构简式命名和根据名称写结构简式
【课堂回眸】
