化学人教版(2019)选择性必修3 2.2.2炔烃的结构与性质(共28张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 2.2.2炔烃的结构与性质(共28张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 6.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-07 11:09:35 | ||
图片预览




文档简介
(共28张PPT)
走进奇妙的化学世界
选择性必修3
第二章 烃
第二节 烯烃 炔烃
乙炔的发现
1836年,英国著名化学家汉弗莱戴维的堂弟,化学家埃德蒙·戴维在加热木炭和碳酸钾取金属钾的过程中,将残渣(含碳化钾)投入水中后产生了一种气体,并发生爆炸。他分析后确定这一气体的化学组成是C2H(当时使用的碳的相对原子质量为6),称它为“一种新的氢的二碳化物”。早在1825年,英国科学家法拉第从加压蒸馏鲸鱼油产生的气体中获得了一种碳和氢的化合物,测得其化学组成是C2H,并将其命名为“氢的二碳化物”。实际上,法拉第发现的是苯(C6H6),埃德蒙·戴维发现的是乙炔(C2H2)。
学习
目标
第2课时
炔烃的结构与性质
PART
01
PART
02
以乙炔为例,掌握炔烃的结构与性质,培养宏观辨识与微观探析的能力。
掌握乙炔的实验室制法,培养科学探究与创新意识的能力。
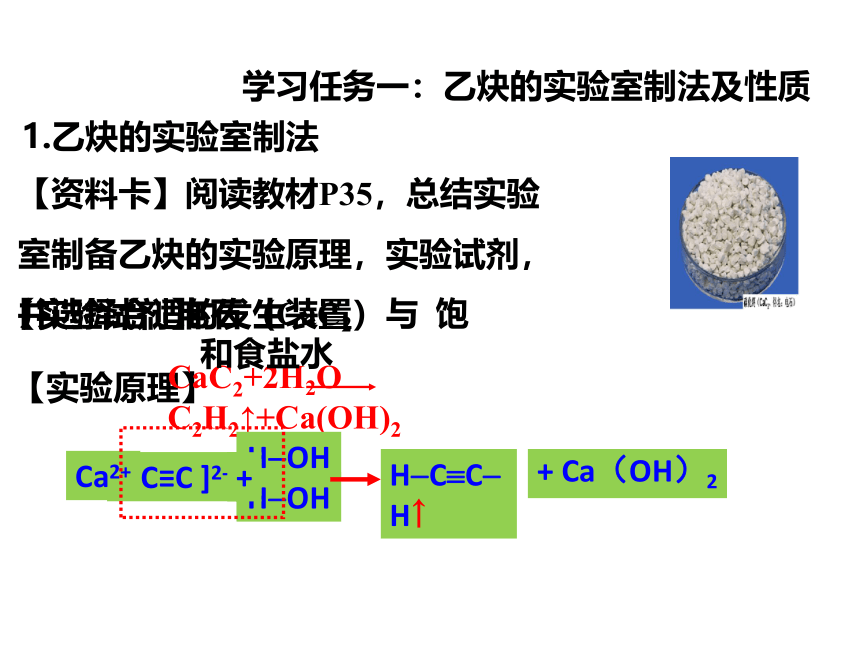
【资料卡】阅读教材P35,总结实验室制备乙炔的实验原理,实验试剂,并选择合适的发生装置
【实验原理】
【实验试剂】
CaC2+2H2O C2H2↑+Ca(OH)2
电石(CaC2)与 饱和食盐水
学习任务一:乙炔的实验室制法及性质
1.乙炔的实验室制法
H OH
H OH
[ C≡C ]2-
Ca2+
+
H C C H↑
+ Ca(OH)2
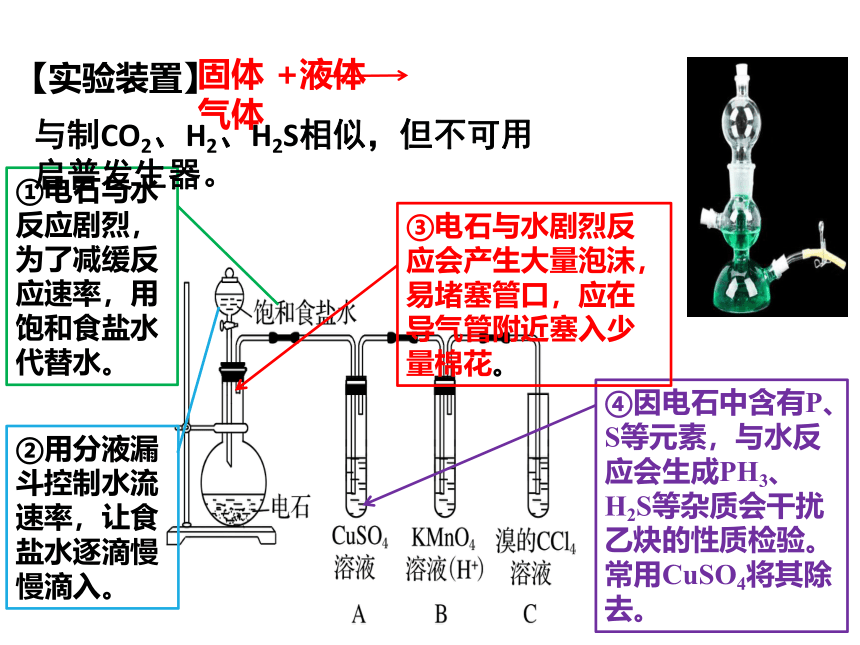
②用分液漏斗控制水流速率,让食盐水逐滴慢慢滴入。
④因电石中含有P、S等元素,与水反应会生成PH3、H2S等杂质会干扰乙炔的性质检验。常用CuSO4将其除去。
③电石与水剧烈反应会产生大量泡沫,易堵塞管口,应在导气管附近塞入少量棉花。
①电石与水反应剧烈,为了减缓反应速率,用饱和食盐水代替水。
【实验装置】
固体 +液体 气体
与制CO2、H2、H2S相似,但不可用启普发生器。
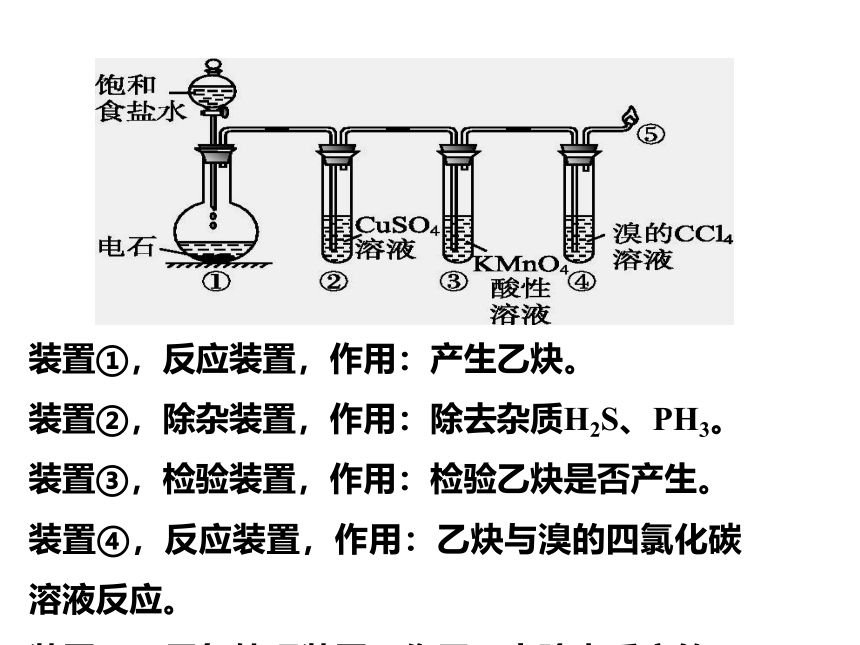
装置①,反应装置,作用:产生乙炔。
装置②,除杂装置,作用:除去杂质H2S、PH3。
装置③,检验装置,作用:检验乙炔是否产生。
装置④,反应装置,作用:乙炔与溴的四氯化碳溶液反应。
装置⑤,尾气处理装置,作用:去除未反应的乙炔。
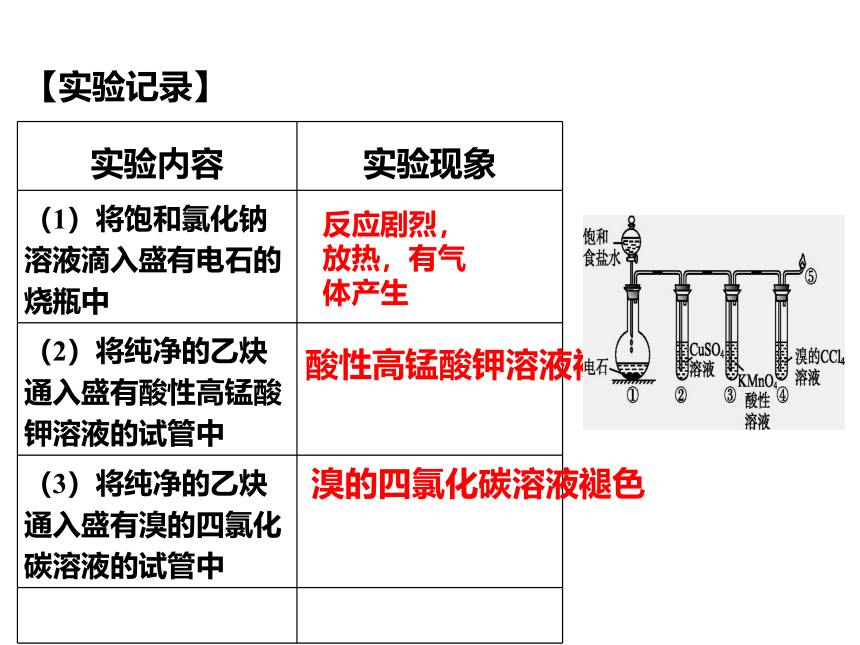
实验内容 实验现象
(1)将饱和氯化钠溶液滴入盛有电石的烧瓶中
(2)将纯净的乙炔通入盛有酸性高锰酸钾溶液的试管中
(3)将纯净的乙炔通入盛有溴的四氯化碳溶液的试管中
反应剧烈,放热,有气体产生
酸性高锰酸钾溶液褪色
溴的四氯化碳溶液褪色
【实验记录】
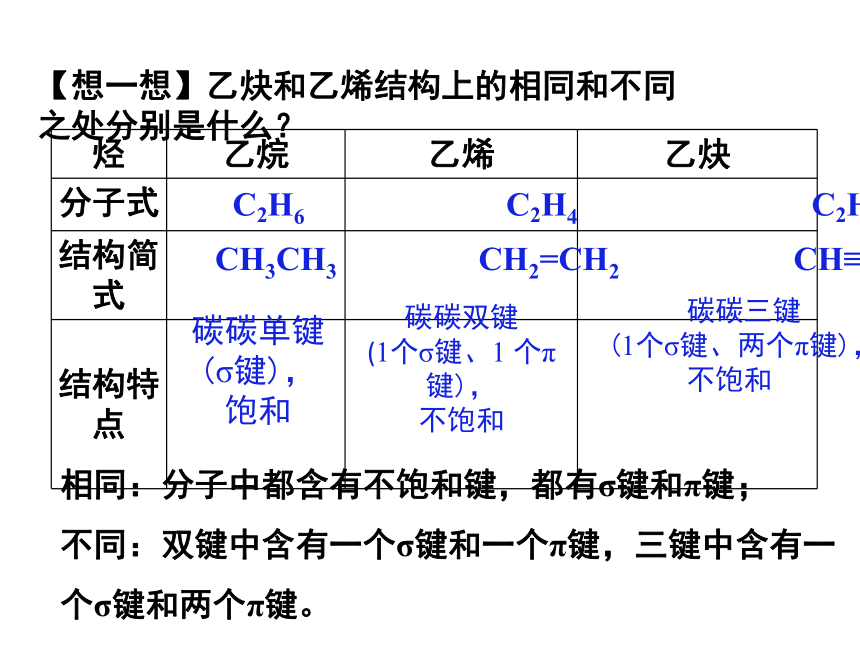
烃 乙烷 乙烯 乙炔
分子式
结构简式
结构特点
C2H6 C2H4 C2H2
CH3CH3 CH2=CH2 CH≡CH
碳碳单键(σ键),
饱和
碳碳双键
(1个σ键、1 个π键),
不饱和
碳碳三键
(1个σ键、两个π键),
不饱和
【想一想】乙炔和乙烯结构上的相同和不同之处分别是什么?
相同:分子中都含有不饱和键,都有σ键和π键;
不同:双键中含有一个σ键和一个π键,三键中含有一个σ键和两个π键。
碳碳双键的键能小于碳碳单键键能的2倍,说明π键的键能小于σ键的键能。
碳碳三键的键能小于碳碳单键键能的3倍,也说明π键的键能小于σ键的键能。
碳碳单键 碳碳双键 碳碳三键
348 615 812
碳碳单键、碳碳双键和碳碳三键的键能比较
键能(kJ/mol)
【想一想】根据表中数据,你可以得到什么结论?
乙烯和乙炔中π键不如σ键牢固,容易断裂。
类比乙烯的化学性质,推测乙炔的化学性质
不饱和烃 乙烯 乙炔
与O2反应
与酸性KMnO4溶液反应
加成反应(与H2、Br2、HCl、H2O等反应)
加聚反应
①可燃性
O2
4CO2+2H2O
2C2H2+ 5
甲烷
乙烯
乙炔
火焰明亮,并伴有浓烟
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,点燃前要验纯!
含碳量不同导致燃烧现象
有所不同,可用于三者鉴别
(1)乙炔的氧化反应
2.乙炔的化学性质
根据乙炔通入酸性高锰酸钾溶液时的实验现象,说明乙炔具有怎样的化学性质
乙炔易被氧化
溶液紫色逐渐褪去
图片来自网络
图片来自网络
②使酸性KMnO4溶液褪色
2KMnO4+ 3H2SO4+ C2H2→2MnSO4+ K2SO4+2CO2↑+ 4H2O
鉴别炔烃和烷烃,但不能除杂!!
根据乙炔通入溴的四氯化碳溶液时的实验现象,说明乙炔具有怎样的化学性质 请写出反应的化学方程式。
乙炔能发生加成反应
总反应 CH≡CH + 2Br2 → CHBr2CHBr2
1,2-二溴乙烯
1,1,2,2-四溴乙烷
溴的颜色逐渐褪去,生成无色易溶于四氯化碳的物质。
图片来自网络
图片来自网络
(2)加成反应(与反应物的量有关,可分步表示)
除去烷烃中的炔烃!
(2)加成反应(与反应物的量有关,可分步表示)
①催化加氢
②使溴水褪色
CH≡CH+Br2 CH=CH
Br
Br
CH=CH+Br2 CH—CH
Br
Br
Br
Br
Br
Br
1 , 2 —二溴乙烯
1 , 1 , 2 , 2 —四溴乙烷
CH≡CH+H2
催化剂
△
CH2=CH2
(少量氢气)
(足量氢气)
催化剂
△
CH≡CH+2H2
CH3CH3
△
CH≡CH+H2O CH3CHO
③与HX等的反应
△
CH≡CH+HCl CH2=CHCl
催化剂
氯乙烯
乙醛
乙炔与水加成后的产物乙烯醇
(CH2=CH—OH不稳定,很快转化为乙醛)
(2)加成反应(与反应物的量有关,可分步表示)
CH2=CH-OH
(乙烯醇)
不稳定
催化剂
[ CH=CH ]n
nCH≡CH
制备导电高分子材料
2000年的诺贝尔化学奖:
图片来自网络
(3)加聚反应
导电塑料——聚乙炔
聚乙炔可用于制备导电高分子材料。经溴或碘掺杂之后导电性会提高到金属水平。白川英树、艾伦·黑格和艾伦·麦克迪尔米德因“发现和发展导电聚合物”获得了2000年的诺贝尔化学奖。
如今聚乙炔已用于制备太阳能电池、半导体材料和电活性聚合物等。
1.乙炔的结构
结构式: H-C≡C-H
球棍模型 σ键 π键
直线形分子
分子式: C2H2
结构简式: CH≡CH
学习任务二: 探究炔烃、乙炔的结构和性质
乙炔分子为直线形结构,相邻两个键之间的夹角为180°。乙炔分子中的碳原子均采取sp杂化,碳原子和氢原子之间均以单键(σ键)相连接,碳原子和碳原子之间以三键(1个σ键和2个π键)相连接。
2.炔烃
(1炔烃的定义:分子里含有碳碳三键的一类脂肪烃
(2)官能团:碳碳三键(—C≡C—)
(3)单炔烃的通式:CnH2n-2(n≥2)
-C-C-
H
H
H
H
链状烷烃
CnH2n+2
-2H
-C = C-
H
H
单烯烃
CnH2n
-2H
-C≡C-
单炔烃
CnH2n-2(n≥2)
(4)炔烃的结构特点:分子里含有碳碳三键;除乙炔外,杂化方式为sp、sp3;碳碳三键两端的碳原子以及与之直接连接的两个原子共线。
2.炔烃的物理性质
(1) 常温下含有1~4个碳原子的烃都是气态,随着碳原子数的增多,逐渐过渡到液态、固态。
(2) 随着碳原子数的增多,沸点逐渐升高;同分异构体之间,支链越多,沸点越低。
(3) 随着碳原子数的增多,相对密度逐渐增大。
(4) 密度均比水小,均难溶于水。
3.炔烃的化学性质
炔烃能发生氧化反应、加成反应、加聚反应
CH≡CH + HCl
CH2=CHCl
学以致用
1.CH≡CH 与 HCl在一定条件下反应,可能的产物有哪些?
催化剂
+ HCl
CH2=CHCl
催化剂
+ HCl
CH2=CHCl
催化剂
CH3CHCl2
CH2ClCH2Cl
2.CH3C≡CH 与 HCl在一定条件下以1:1比例反应时,可能的产物有哪些?
CH3C≡CH + HCl
催化剂
CH3CCl=CH2
CH3C≡CH + HCl
催化剂
CH3CH=CHCl
【思考与交流】
1.某炔烃通过催化加氢反应得到2-甲基戊烷,请由此推断该炔烃可能的结构简式。
“三键碳原子”加氢后的特点:每个碳原子至少有2个氢原子
-C≡C- + 2H2 →
碳碳三键与足量氢气完全反应:
-C-C-
H
H
H
H
秘诀:掌握“三键碳原子”加氢后的特点
【思考与交流】
1.某炔烃通过催化加氢反应得到2-甲基戊烷,请由此推断该炔烃可能的结构简式。
步骤一:写出目标产物(2-甲基戊烷)的碳骨架
步骤二:找到碳碳三键可能的位置
↓
↓
秘诀:掌握“三键碳原子”加氢后的特点
C-C-C-C-C
C
C-C-C-C-C
C
(相邻碳原子上每个碳原子至少有2个氢原子)
步骤三:在碳骨架上补氢(满足“碳四价”)
CH≡C-CH2-CH-CH3
CH3
CH3-C≡C-CH-CH3
CH3
【思考与交流】
2.请写出戊炔所有属于炔烃的同分异构体的结构简式。
步骤一:写出含5个碳原子的碳骨架的碳架异构
秘诀:“思维有序”:碳架异构→官能团位置异构
步骤二:确定碳碳三键可能的位置
C-C-C-C-C
C-C-C-C-C
↓
↓
2种
1种
无
C-C-C
C
C
C-C-C-C
C
↓
C-C-C
C
C
C-C-C-C
C
步骤三:在碳骨架上补氢(满足“碳四价”)
CH≡C-CH2-CH2-CH3
CH3-C≡C-CH2-CH3
CH≡C-CH-CH3
CH3
【思考与交流】
3.根据碳碳单键、双键和三键的结构特征推测,化合物
CH3-CH=CH-C≡C-CH3分子中位于同一平面内的碳原子最多有( )个。
秘诀一:掌握典型分子的空间结构
典型分子 CH4 CH2=CH2 CH≡CH
空间结构
球棍模型
原子共面共线情况
正四面体形
有且只有3个原子共平面
平面形
6个原子共平面
直线形
4个原子共直线
秘诀二:将典型分子拓展
即氢原子部分或全部被其他原子或原子团替换
烃 烷烃 烯烃 炔烃
球棍模型
碳原子共面共线情况
5个碳原子构成正四面体,有且只有3个碳原子共平面
4个碳原子共平面
4个碳原子共直线
【思考与交流】
3.根据碳碳单键、双键和三键的结构特征推测,化合物
CH3-CH=CH-C≡C-CH3分子中位于同一平面内的碳原子最多有( )个。
6
【思考与交流】
4.我们已经学习了烷烃、烯烃和炔烃,哪些烃能被高锰酸钾酸性溶液氧化,它们有什么结构特点
烯烃、炔烃,它们都含有不饱和键。
5.在烯烃分子中如果双键碳上连接了两个不同的原子或原子团,将可以出现顺反异构。请问在炔烃分子中是否也存在顺反异构现象
炔烃没有顺反异构。
形成顺反异构的条件:
(1)含双键;(2)不饱和碳上连接了两个不同的原子或原子团。
课堂小结提升
【知识整合】
走进奇妙的化学世界
选择性必修3
第二章 烃
第二节 烯烃 炔烃
乙炔的发现
1836年,英国著名化学家汉弗莱戴维的堂弟,化学家埃德蒙·戴维在加热木炭和碳酸钾取金属钾的过程中,将残渣(含碳化钾)投入水中后产生了一种气体,并发生爆炸。他分析后确定这一气体的化学组成是C2H(当时使用的碳的相对原子质量为6),称它为“一种新的氢的二碳化物”。早在1825年,英国科学家法拉第从加压蒸馏鲸鱼油产生的气体中获得了一种碳和氢的化合物,测得其化学组成是C2H,并将其命名为“氢的二碳化物”。实际上,法拉第发现的是苯(C6H6),埃德蒙·戴维发现的是乙炔(C2H2)。
学习
目标
第2课时
炔烃的结构与性质
PART
01
PART
02
以乙炔为例,掌握炔烃的结构与性质,培养宏观辨识与微观探析的能力。
掌握乙炔的实验室制法,培养科学探究与创新意识的能力。
【资料卡】阅读教材P35,总结实验室制备乙炔的实验原理,实验试剂,并选择合适的发生装置
【实验原理】
【实验试剂】
CaC2+2H2O C2H2↑+Ca(OH)2
电石(CaC2)与 饱和食盐水
学习任务一:乙炔的实验室制法及性质
1.乙炔的实验室制法
H OH
H OH
[ C≡C ]2-
Ca2+
+
H C C H↑
+ Ca(OH)2
②用分液漏斗控制水流速率,让食盐水逐滴慢慢滴入。
④因电石中含有P、S等元素,与水反应会生成PH3、H2S等杂质会干扰乙炔的性质检验。常用CuSO4将其除去。
③电石与水剧烈反应会产生大量泡沫,易堵塞管口,应在导气管附近塞入少量棉花。
①电石与水反应剧烈,为了减缓反应速率,用饱和食盐水代替水。
【实验装置】
固体 +液体 气体
与制CO2、H2、H2S相似,但不可用启普发生器。
装置①,反应装置,作用:产生乙炔。
装置②,除杂装置,作用:除去杂质H2S、PH3。
装置③,检验装置,作用:检验乙炔是否产生。
装置④,反应装置,作用:乙炔与溴的四氯化碳溶液反应。
装置⑤,尾气处理装置,作用:去除未反应的乙炔。
实验内容 实验现象
(1)将饱和氯化钠溶液滴入盛有电石的烧瓶中
(2)将纯净的乙炔通入盛有酸性高锰酸钾溶液的试管中
(3)将纯净的乙炔通入盛有溴的四氯化碳溶液的试管中
反应剧烈,放热,有气体产生
酸性高锰酸钾溶液褪色
溴的四氯化碳溶液褪色
【实验记录】
烃 乙烷 乙烯 乙炔
分子式
结构简式
结构特点
C2H6 C2H4 C2H2
CH3CH3 CH2=CH2 CH≡CH
碳碳单键(σ键),
饱和
碳碳双键
(1个σ键、1 个π键),
不饱和
碳碳三键
(1个σ键、两个π键),
不饱和
【想一想】乙炔和乙烯结构上的相同和不同之处分别是什么?
相同:分子中都含有不饱和键,都有σ键和π键;
不同:双键中含有一个σ键和一个π键,三键中含有一个σ键和两个π键。
碳碳双键的键能小于碳碳单键键能的2倍,说明π键的键能小于σ键的键能。
碳碳三键的键能小于碳碳单键键能的3倍,也说明π键的键能小于σ键的键能。
碳碳单键 碳碳双键 碳碳三键
348 615 812
碳碳单键、碳碳双键和碳碳三键的键能比较
键能(kJ/mol)
【想一想】根据表中数据,你可以得到什么结论?
乙烯和乙炔中π键不如σ键牢固,容易断裂。
类比乙烯的化学性质,推测乙炔的化学性质
不饱和烃 乙烯 乙炔
与O2反应
与酸性KMnO4溶液反应
加成反应(与H2、Br2、HCl、H2O等反应)
加聚反应
①可燃性
O2
4CO2+2H2O
2C2H2+ 5
甲烷
乙烯
乙炔
火焰明亮,并伴有浓烟
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,点燃前要验纯!
含碳量不同导致燃烧现象
有所不同,可用于三者鉴别
(1)乙炔的氧化反应
2.乙炔的化学性质
根据乙炔通入酸性高锰酸钾溶液时的实验现象,说明乙炔具有怎样的化学性质
乙炔易被氧化
溶液紫色逐渐褪去
图片来自网络
图片来自网络
②使酸性KMnO4溶液褪色
2KMnO4+ 3H2SO4+ C2H2→2MnSO4+ K2SO4+2CO2↑+ 4H2O
鉴别炔烃和烷烃,但不能除杂!!
根据乙炔通入溴的四氯化碳溶液时的实验现象,说明乙炔具有怎样的化学性质 请写出反应的化学方程式。
乙炔能发生加成反应
总反应 CH≡CH + 2Br2 → CHBr2CHBr2
1,2-二溴乙烯
1,1,2,2-四溴乙烷
溴的颜色逐渐褪去,生成无色易溶于四氯化碳的物质。
图片来自网络
图片来自网络
(2)加成反应(与反应物的量有关,可分步表示)
除去烷烃中的炔烃!
(2)加成反应(与反应物的量有关,可分步表示)
①催化加氢
②使溴水褪色
CH≡CH+Br2 CH=CH
Br
Br
CH=CH+Br2 CH—CH
Br
Br
Br
Br
Br
Br
1 , 2 —二溴乙烯
1 , 1 , 2 , 2 —四溴乙烷
CH≡CH+H2
催化剂
△
CH2=CH2
(少量氢气)
(足量氢气)
催化剂
△
CH≡CH+2H2
CH3CH3
△
CH≡CH+H2O CH3CHO
③与HX等的反应
△
CH≡CH+HCl CH2=CHCl
催化剂
氯乙烯
乙醛
乙炔与水加成后的产物乙烯醇
(CH2=CH—OH不稳定,很快转化为乙醛)
(2)加成反应(与反应物的量有关,可分步表示)
CH2=CH-OH
(乙烯醇)
不稳定
催化剂
[ CH=CH ]n
nCH≡CH
制备导电高分子材料
2000年的诺贝尔化学奖:
图片来自网络
(3)加聚反应
导电塑料——聚乙炔
聚乙炔可用于制备导电高分子材料。经溴或碘掺杂之后导电性会提高到金属水平。白川英树、艾伦·黑格和艾伦·麦克迪尔米德因“发现和发展导电聚合物”获得了2000年的诺贝尔化学奖。
如今聚乙炔已用于制备太阳能电池、半导体材料和电活性聚合物等。
1.乙炔的结构
结构式: H-C≡C-H
球棍模型 σ键 π键
直线形分子
分子式: C2H2
结构简式: CH≡CH
学习任务二: 探究炔烃、乙炔的结构和性质
乙炔分子为直线形结构,相邻两个键之间的夹角为180°。乙炔分子中的碳原子均采取sp杂化,碳原子和氢原子之间均以单键(σ键)相连接,碳原子和碳原子之间以三键(1个σ键和2个π键)相连接。
2.炔烃
(1炔烃的定义:分子里含有碳碳三键的一类脂肪烃
(2)官能团:碳碳三键(—C≡C—)
(3)单炔烃的通式:CnH2n-2(n≥2)
-C-C-
H
H
H
H
链状烷烃
CnH2n+2
-2H
-C = C-
H
H
单烯烃
CnH2n
-2H
-C≡C-
单炔烃
CnH2n-2(n≥2)
(4)炔烃的结构特点:分子里含有碳碳三键;除乙炔外,杂化方式为sp、sp3;碳碳三键两端的碳原子以及与之直接连接的两个原子共线。
2.炔烃的物理性质
(1) 常温下含有1~4个碳原子的烃都是气态,随着碳原子数的增多,逐渐过渡到液态、固态。
(2) 随着碳原子数的增多,沸点逐渐升高;同分异构体之间,支链越多,沸点越低。
(3) 随着碳原子数的增多,相对密度逐渐增大。
(4) 密度均比水小,均难溶于水。
3.炔烃的化学性质
炔烃能发生氧化反应、加成反应、加聚反应
CH≡CH + HCl
CH2=CHCl
学以致用
1.CH≡CH 与 HCl在一定条件下反应,可能的产物有哪些?
催化剂
+ HCl
CH2=CHCl
催化剂
+ HCl
CH2=CHCl
催化剂
CH3CHCl2
CH2ClCH2Cl
2.CH3C≡CH 与 HCl在一定条件下以1:1比例反应时,可能的产物有哪些?
CH3C≡CH + HCl
催化剂
CH3CCl=CH2
CH3C≡CH + HCl
催化剂
CH3CH=CHCl
【思考与交流】
1.某炔烃通过催化加氢反应得到2-甲基戊烷,请由此推断该炔烃可能的结构简式。
“三键碳原子”加氢后的特点:每个碳原子至少有2个氢原子
-C≡C- + 2H2 →
碳碳三键与足量氢气完全反应:
-C-C-
H
H
H
H
秘诀:掌握“三键碳原子”加氢后的特点
【思考与交流】
1.某炔烃通过催化加氢反应得到2-甲基戊烷,请由此推断该炔烃可能的结构简式。
步骤一:写出目标产物(2-甲基戊烷)的碳骨架
步骤二:找到碳碳三键可能的位置
↓
↓
秘诀:掌握“三键碳原子”加氢后的特点
C-C-C-C-C
C
C-C-C-C-C
C
(相邻碳原子上每个碳原子至少有2个氢原子)
步骤三:在碳骨架上补氢(满足“碳四价”)
CH≡C-CH2-CH-CH3
CH3
CH3-C≡C-CH-CH3
CH3
【思考与交流】
2.请写出戊炔所有属于炔烃的同分异构体的结构简式。
步骤一:写出含5个碳原子的碳骨架的碳架异构
秘诀:“思维有序”:碳架异构→官能团位置异构
步骤二:确定碳碳三键可能的位置
C-C-C-C-C
C-C-C-C-C
↓
↓
2种
1种
无
C-C-C
C
C
C-C-C-C
C
↓
C-C-C
C
C
C-C-C-C
C
步骤三:在碳骨架上补氢(满足“碳四价”)
CH≡C-CH2-CH2-CH3
CH3-C≡C-CH2-CH3
CH≡C-CH-CH3
CH3
【思考与交流】
3.根据碳碳单键、双键和三键的结构特征推测,化合物
CH3-CH=CH-C≡C-CH3分子中位于同一平面内的碳原子最多有( )个。
秘诀一:掌握典型分子的空间结构
典型分子 CH4 CH2=CH2 CH≡CH
空间结构
球棍模型
原子共面共线情况
正四面体形
有且只有3个原子共平面
平面形
6个原子共平面
直线形
4个原子共直线
秘诀二:将典型分子拓展
即氢原子部分或全部被其他原子或原子团替换
烃 烷烃 烯烃 炔烃
球棍模型
碳原子共面共线情况
5个碳原子构成正四面体,有且只有3个碳原子共平面
4个碳原子共平面
4个碳原子共直线
【思考与交流】
3.根据碳碳单键、双键和三键的结构特征推测,化合物
CH3-CH=CH-C≡C-CH3分子中位于同一平面内的碳原子最多有( )个。
6
【思考与交流】
4.我们已经学习了烷烃、烯烃和炔烃,哪些烃能被高锰酸钾酸性溶液氧化,它们有什么结构特点
烯烃、炔烃,它们都含有不饱和键。
5.在烯烃分子中如果双键碳上连接了两个不同的原子或原子团,将可以出现顺反异构。请问在炔烃分子中是否也存在顺反异构现象
炔烃没有顺反异构。
形成顺反异构的条件:
(1)含双键;(2)不饱和碳上连接了两个不同的原子或原子团。
课堂小结提升
【知识整合】
