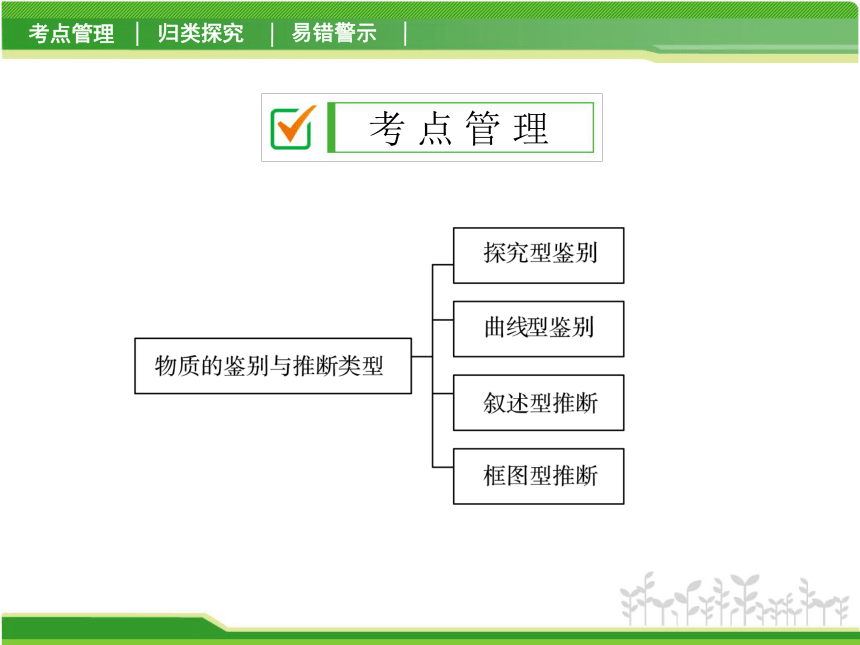
2014科学总复习专题提升八 物质的鉴别与推断
文档属性
| 名称 | 2014科学总复习专题提升八 物质的鉴别与推断 |  | |
| 格式 | zip | ||
| 文件大小 | 9.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2014-02-21 08:59:05 | ||
图片预览








文档简介
课件38张PPT。专题提升八 物质的鉴别与推断考 点 管 理1.常见的离子鉴别(掌握)
H+与OH-:用酸碱指示剂。
Cl-和SO42-:可用Ba(NO3)2(或BaCl2)溶液但不能用 AgNO3溶液。
CO32-:用稀盐酸和澄清石灰水,生成能使澄清石灰水变 浑浊的气体。
Fe3+和Cu2+:加NaOH溶液(可溶性碱溶液)能生成红褐色 沉淀或蓝色沉淀。
NH4+:与碱溶液混合(微热)产生使湿润的红色石蕊试纸变 蓝的气体。
常见沉淀的颜色:
白色沉淀:不溶于稀硝酸:BaSO4、AgCl。
可溶于盐酸:CaCO3、BaCO3、Al(OH)3等。
蓝色沉淀:Cu(OH)2。
红褐色沉淀:Fe(OH)3。
2.鉴别与推断的思路(理解)
鉴别物质:(1)分析鉴别物质的关键是区别不同物质所含的 不同离子。
(2)选用合适的试剂加以鉴别。
物质推断:(1)分析实验中出现的现象。
(2)确定存在的离子。
(3)根据题意,组合离子,确定物质。
【注意】 (1)鉴别应取样;
(2)鉴别物质应有明显的现象区别;
(3)连续滴加试剂鉴别时,应注意先加离子对后 面物质鉴别的干扰;
(4)推断几种物质存在时,应特别注意物质能否 共存。
1.[2013·达州]下列离子能在pH=11的溶液中大量共存的是 ( )
A.K+、NO3-、Na+、OH-
B.CO32-、K+、Cl-、Ca2+
C.H+、Ba2+、Cl-、SO42-
D.K+、OH-、SO42-、Cu2+
【解析】 pH=11的溶液是碱性溶液不能存在H+。A2.[2012·上海]在盛有稀硫酸的烧杯中,分别加入下列物质,最终只存在无色液体的是 ( )
A.BaCl2溶液、NaOH溶液
B.Na2CO3溶液、KOH溶液
C.Fe2(SO4)3溶液、NaNO3溶液
D.Cu片、Na2SO4溶液
【解析】 氯化钡溶液能与硫酸反应生成硫酸钡沉淀;硫酸与碳酸钠、氢氧化钾都能反应,生成硫酸钠、水、二氧化碳,硫酸钾和水,最后只存在无色液体;硫酸铁溶液属于黄色溶液;铜片不能与硫酸反应。
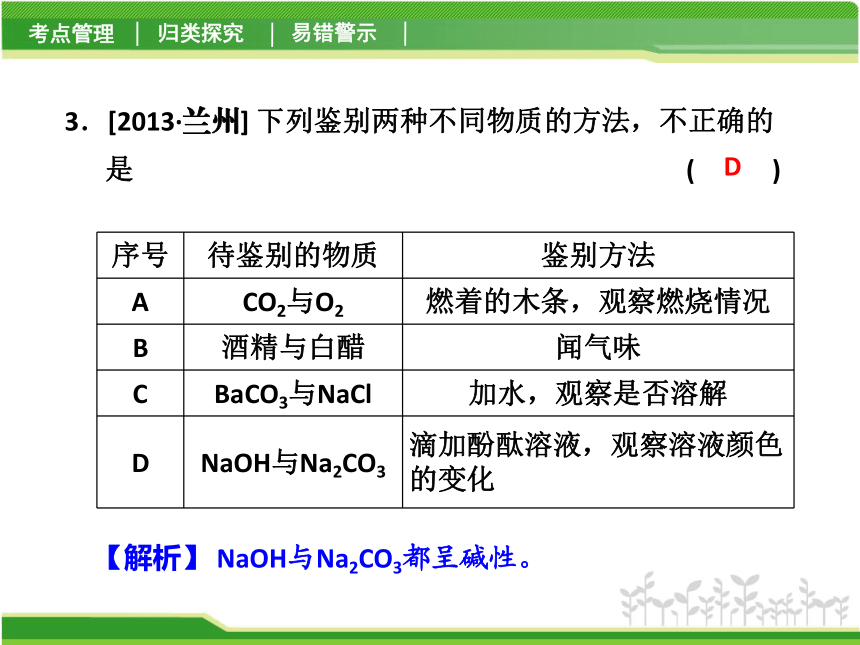
B3.[2013·兰州] 下列鉴别两种不同物质的方法,不正确的是 ( )
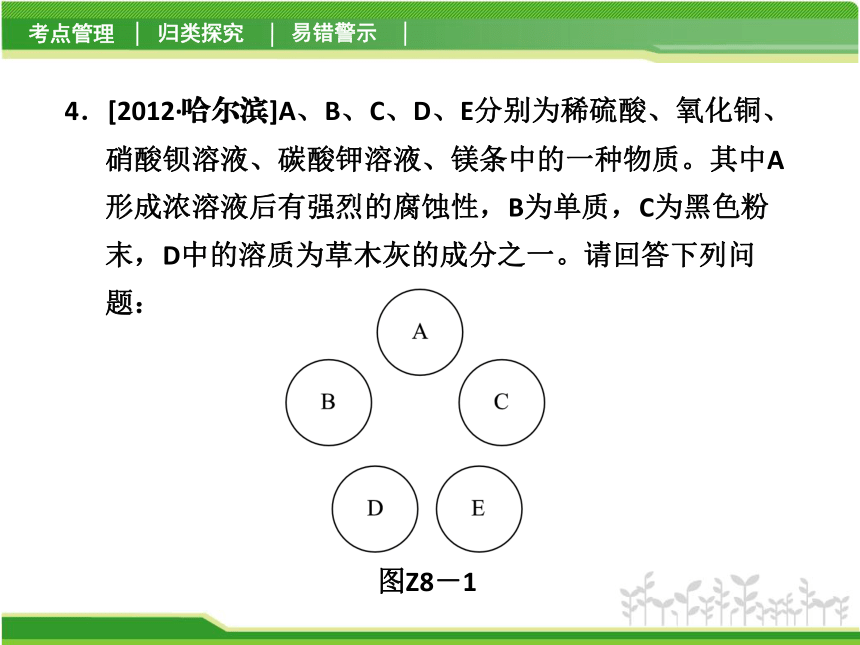
D【解析】 NaOH与Na2CO3都呈碱性。4.[2012·哈尔滨]A、B、C、D、E分别为稀硫酸、氧化铜、硝酸钡溶液、碳酸钾溶液、镁条中的一种物质。其中A形成浓溶液后有强烈的腐蚀性,B为单质,C为黑色粉末,D中的溶质为草木灰的成分之一。请回答下列问题:
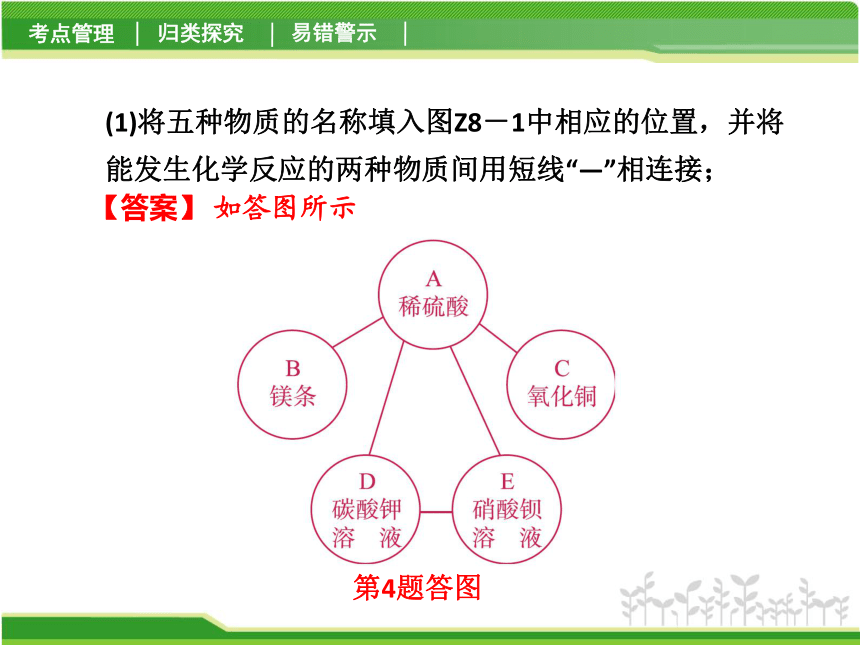
图Z8-1 (1)将五种物质的名称填入图Z8-1中相应的位置,并将能发生化学反应的两种物质间用短线“—”相连接;
第4题答图【答案】 如答图所示 (2)写出A与E发生反应的化学方程式__________ _____________________________;
(3)写出A与B发生反应的实验现象__________________ _______________________________________。
H2SO4+Ba(NO3)2===BaSO4↓+2HNO3银白色固体表面产生气泡,固体减少(或消失),同时放出热量5.[2013·佛山]我国大部分地区深受酸雨的危害,煤燃烧产生的SO2是形成酸雨的主要污染物,SO2与水结合生成弱酸性亚硫酸(H2SO3)。
已知:H2SO3易分解生成水和SO2,也易与空气中的氧气或稀硝酸反应生成H2SO4;H2SO3和SO2都能使红色的品红溶液褪色。亚硫酸钡是白色难溶于水,但可溶于酸的固体,在强酸性溶液中无法形成亚硫酸钡沉淀。
(1)酸雨是pH小于_______的降雨。
5.6 (2)常用脱硫方法减少废气中的SO2,以生石灰(CaO)为脱硫剂,高温下与废气中的SO2与O2化合生成CaSO4,
化学方程式为________________________________。
(3)实验室常用亚硫酸盐与HCl或H2SO4反应制备SO2,写出Na2SO3与盐酸反应的化学方程式___________ ____________________________。
(4)小鸿同学利用中和反应的原理,在空气中放置一段时间的酸雨(pH约为3)中加入足量的KOH,并就反应后混合溶液中的盐的成分进行探究:
Na2SO3+2HCl===2NaCl+SO2↑+H2O 【提出猜想】反应后混合溶液中盐的成分是什么?
【进行猜想】猜想1:只有K2SO3;
猜想2:______________;
猜想3:既有K2SO4,也有K2SO3。
【实验探究】限选试剂:稀硫酸、稀盐酸、稀硝酸、氯化钡溶液、澄清石灰水、品红溶液、紫色石蕊溶液。
只有K2SO4品红溶液褐色氯化钡溶液有气泡产生足量的稀盐酸归 类 探 究类型之一 框图型推断
[2013·宁波]在实验课中,各小组做了如下实验:
图Z8-2实验后,同学们按老师要求将废液都倒在指定的大烧杯中。小科猜想该烧杯中的废液可能有硫酸铜、硫酸锌、硫酸亚铁……应该可以从中提取出铁和铜。经思考后,他设计了如图Z8-3所示的实验,并设法使滤液甲和乙所含的溶质相同。
图Z8-3则:固体C是_______,操作③的名称是________,实验中所加的过量金属粉末是______。
【解析】 溶液中有关的三种金属的活动性锌最强,为了回收铁与铜,应在溶液中加入过量的锌,以全部置换出铁和铜,把过量的锌用稀硫酸除去。铁过滤锌实验室有一瓶无色溶液,由碱A和盐B两种化合物的水溶液混合而成;还有一瓶标签破损的未知稀酸溶液。通过实验发现:图Z8-4其中气体C能使澄清石灰水变浑浊,固体D为NaCl。请回答:
(1)将稀酸逐滴滴入A、B混合液中,产生气体与加入稀酸有如图Z8-5所示的关系,则化合物B可能是_____________________(写化学式)。
图Z8-5Na2CO3或NaHCO3(2)若实验前在混合液中滴入几滴紫色的石蕊试液,请描述稀酸逐滴滴入A、B混合液过程中溶液颜色变化。
【答案】 由蓝变紫、最后变红
【解析】 与稀酸反应后生成二氧化碳气体的盐是碳酸盐,且能和碱A共存的只能是碳酸钠或碳酸氢钠,加入稀酸后,首先发生酸和碱的中和反应。碱溶液中加入石蕊试液显蓝色,完全反应时,溶液呈中性,溶液为紫色,随着加入酸的过量,溶液显红色。
【点悟】 物质推断的依据是化学反应的原理。对物质的推断必须符合题意,如变式跟进中的A是碱,B是盐。
类型之二 叙述型推断
[2013·达州]有一包白色粉末,可能含有Ba(OH)2、KNO3、FeCl3、Na2CO3、Na2SO4中的一种或几种。为了确定其成分,进行如下实验:
①取一定量的白色粉末加入足量的水,振荡,静置,得白色沉淀,上层清液为无色。
②过滤,在白色沉淀中加入足量稀盐酸,白色沉淀全部溶解,且有气泡产生。
(1)据此推断,该白色粉末中一定含有____________ ________;可能含有__________;一定不含有__________ _________。Ba(OH)2、Na2CO3KNO3FeCl3、Na2SO4(2)写出步骤②中发生反应的化学方程式:__________ ____________________________。
【解析】 加水得白色沉淀和无色清液说明混合物中没有铁离子。白色沉淀可能是碳酸钡或硫酸钡,白色沉淀全部溶于稀盐酸,说明白色沉淀为碳酸钡,所以可以确定混合物中一定有Ba(OH)2、Na2CO3,一定没有FeCl3、Na2SO4。
BaCO3+2HCl===BaCl2+H2O+CO2↑现有一包白色粉末,其中含有CuSO4、BaCl2、NaOH、Na2CO3中的一种或几种。某化学小组为确定白色粉末的成分,进行了如下实验:
(Ⅰ)取一定量白色粉末,加入足量水,振荡,得到无色透明溶液;
(Ⅱ)取少量(Ⅰ)的溶液,加入足量盐酸,有气泡产生。
(提示:BaCO3难溶于水;Na2CO3的水溶液呈碱性)
(1)该白色粉末中肯定含有什么物质?____________ _________可能含有什么物质?__________________
(2)为确定可能含有的物质是否存在,还需做什么实验?请写出简要的实验步骤。
肯定含有可能含有NaOHNa2CO3【答案】 取少量(Ⅰ)的溶液,加入足量BaCl2溶液(或CaCl2溶液),静置,取上层清液滴加酚酞溶液
【解析】 溶于水得无色透明溶液既说明没有硫酸铜,也说明氯化钡和碳酸钠没有共存。加入盐酸产生气体,说明有碳酸钠,则说明没有氯化钡。
【点悟】 鉴别物质必须分析物质是否可以共存,也必须分析加水溶解后产生沉淀和所得滤液的颜色。
类型之三 探究型鉴别
[2013·衢州] 实验室有一瓶标签残缺的溶液,它可能是硫酸钠、碳酸钠和氯化钠溶液中的一种。龙龙、开开两位同学分别设计了下表方案进行鉴别。
根据上表回答问题:
(1)龙龙同学滴加的试剂可能是___________________ _________溶液(写出一种即可)。
(2)龙龙同学认为开开同学方案存在缺陷,理由是____ ________________________________________。
【解析】 三种钠盐的鉴别实质是鉴别硫酸根离子、碳酸根离子、氯离子。根据结论是硫酸钠溶液倒推加入的试剂是含钡离子的溶液,但为了避免对实验的干扰,实验中不能加入含硫酸根离子的稀硫酸。
BaCl2或Ba(NO3)2或Ba(OH)2加入的稀硫酸中的硫酸根离子对实验产生干扰[2012·北京]同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应。
(1)实验装备
①查阅资料:NaHCO3+NaOH===Na2CO3+H2O
②用一定溶质质量分数的NaHCO3、NaOH和Na2CO3三种溶液进行如下实验,为设计实验方案提供参考。
表中的现象Ⅰ为____________,现象Ⅱ发生反应的化学方程式为__________________________________ ___________。
(2)实验过程
【实验1】证明反应生成了Na2CO3同学们选用上表实验中的药品,设计了如图Z8-6所示实验,先在NaHCO3溶液中加入A溶液,无明显现象,再滴加NaOH溶液,溶液变浑浊,则A溶液是_________。有同学提出这个实验不足以证明有Na2CO3生成,其理由是________________________ ____________________________。
产生气泡Ca(OH)2+Na2CO3===2NaOH +CaCO3↓CaCl2CaCl2和NaOH反应生成Ca(OH)2,氢氧化钙是微溶物为了证明有Na2CO3生成,需要继续进行的操作是
_________________________________________________________________________________。
图Z8-6取少量反应后滤渣加入足量的稀盐酸,若产生无色气体证明有Na2CO3生成,反之则没有【实验2】证明反应后NaHCO3不存在。
同学们参考上表中的实验,又设计了一个实验,虽然没有观察到明显的实验现象,但可以证明反应发生了,该实验方案是________________________________________ ____________________________________________________________________。
(3)实验反思
通过实验1和实验2说明,对于没有明显现象的化学反应,可以从两个不同的角度证明反应的发生,这两个角度是_________________________________________________ _________________________。
取少量反应后的溶液加热至沸腾,将气体通入澄清石灰水,若澄清石灰水变浑浊,证明有NaHCO3存在,反之则没有一是可以通过检验反应物证明反应发生,二是可以通过检验产物证明反应发生【解析】 对于没有明显现象的化学反应,可以通过检验反应物是否存在证明反应是否发生,也可以通过证明是否有新物质生成证明反应是否发生。
【点悟】 通过实验探究鉴别或推断物质,需注意实验原理(反应原理)与实验现象。
易 错 警 示分析反应曲线致错
[2012·青岛]下列图像能正确反映其对应关系的是 ( )
图Z8-7A.向氢氧化钠溶液中不断加水,溶液pH与加入水的质量的关系
B.向盛有氧化铜的烧杯中加入稀盐酸至过量,生成氯化铜质量与加入稀盐酸质量的关系
C.一定量的稀硫酸与锌粒反应,溶液的质量与反应时间的关系
D.向氯化铜和硝酸铜的混合溶液中滴加氢氧化钠溶液,生成沉淀与加入氢氧化钠溶液的质量关系
【错解】 D【错因分析】 氯化铜和硝酸铜的混合溶液中滴加氢氧化钠溶液,立即生成沉淀。向氯化铜和稀盐酸的混合溶液中滴加氢氧化钠溶液,生成沉淀的曲线符合D图曲线,审题错误。
【正解】 C
用质量相等的锌粉和铁粉,分别与溶质质量分数相同且等质量的稀盐酸充分发生反应,产生氢气的质量与时间的关系如图Z8-8所示。请回答下列问题:
图Z8-8(1)表示锌粉与稀盐酸反应的曲线为______(填a或b)。
(2)对于a曲线表示的反应,物质________(填名称)有剩余。
【解析】 由于锌比铁活泼,根据图像知充分反应后首先反应完的是锌。当盐酸足量时等质量的锌粉和铁粉生成氢气少的是锌,所以表示锌粉与稀盐酸反应的曲线是a。等质量的锌粉完全反应比铁粉消耗盐酸的质量少,所以与锌粉反应的盐酸一定有剩余,而与铁粉反应的盐酸可能有剩余也可能正好反应。
a盐酸
H+与OH-:用酸碱指示剂。
Cl-和SO42-:可用Ba(NO3)2(或BaCl2)溶液但不能用 AgNO3溶液。
CO32-:用稀盐酸和澄清石灰水,生成能使澄清石灰水变 浑浊的气体。
Fe3+和Cu2+:加NaOH溶液(可溶性碱溶液)能生成红褐色 沉淀或蓝色沉淀。
NH4+:与碱溶液混合(微热)产生使湿润的红色石蕊试纸变 蓝的气体。
常见沉淀的颜色:
白色沉淀:不溶于稀硝酸:BaSO4、AgCl。
可溶于盐酸:CaCO3、BaCO3、Al(OH)3等。
蓝色沉淀:Cu(OH)2。
红褐色沉淀:Fe(OH)3。
2.鉴别与推断的思路(理解)
鉴别物质:(1)分析鉴别物质的关键是区别不同物质所含的 不同离子。
(2)选用合适的试剂加以鉴别。
物质推断:(1)分析实验中出现的现象。
(2)确定存在的离子。
(3)根据题意,组合离子,确定物质。
【注意】 (1)鉴别应取样;
(2)鉴别物质应有明显的现象区别;
(3)连续滴加试剂鉴别时,应注意先加离子对后 面物质鉴别的干扰;
(4)推断几种物质存在时,应特别注意物质能否 共存。
1.[2013·达州]下列离子能在pH=11的溶液中大量共存的是 ( )
A.K+、NO3-、Na+、OH-
B.CO32-、K+、Cl-、Ca2+
C.H+、Ba2+、Cl-、SO42-
D.K+、OH-、SO42-、Cu2+
【解析】 pH=11的溶液是碱性溶液不能存在H+。A2.[2012·上海]在盛有稀硫酸的烧杯中,分别加入下列物质,最终只存在无色液体的是 ( )
A.BaCl2溶液、NaOH溶液
B.Na2CO3溶液、KOH溶液
C.Fe2(SO4)3溶液、NaNO3溶液
D.Cu片、Na2SO4溶液
【解析】 氯化钡溶液能与硫酸反应生成硫酸钡沉淀;硫酸与碳酸钠、氢氧化钾都能反应,生成硫酸钠、水、二氧化碳,硫酸钾和水,最后只存在无色液体;硫酸铁溶液属于黄色溶液;铜片不能与硫酸反应。
B3.[2013·兰州] 下列鉴别两种不同物质的方法,不正确的是 ( )
D【解析】 NaOH与Na2CO3都呈碱性。4.[2012·哈尔滨]A、B、C、D、E分别为稀硫酸、氧化铜、硝酸钡溶液、碳酸钾溶液、镁条中的一种物质。其中A形成浓溶液后有强烈的腐蚀性,B为单质,C为黑色粉末,D中的溶质为草木灰的成分之一。请回答下列问题:
图Z8-1 (1)将五种物质的名称填入图Z8-1中相应的位置,并将能发生化学反应的两种物质间用短线“—”相连接;
第4题答图【答案】 如答图所示 (2)写出A与E发生反应的化学方程式__________ _____________________________;
(3)写出A与B发生反应的实验现象__________________ _______________________________________。
H2SO4+Ba(NO3)2===BaSO4↓+2HNO3银白色固体表面产生气泡,固体减少(或消失),同时放出热量5.[2013·佛山]我国大部分地区深受酸雨的危害,煤燃烧产生的SO2是形成酸雨的主要污染物,SO2与水结合生成弱酸性亚硫酸(H2SO3)。
已知:H2SO3易分解生成水和SO2,也易与空气中的氧气或稀硝酸反应生成H2SO4;H2SO3和SO2都能使红色的品红溶液褪色。亚硫酸钡是白色难溶于水,但可溶于酸的固体,在强酸性溶液中无法形成亚硫酸钡沉淀。
(1)酸雨是pH小于_______的降雨。
5.6 (2)常用脱硫方法减少废气中的SO2,以生石灰(CaO)为脱硫剂,高温下与废气中的SO2与O2化合生成CaSO4,
化学方程式为________________________________。
(3)实验室常用亚硫酸盐与HCl或H2SO4反应制备SO2,写出Na2SO3与盐酸反应的化学方程式___________ ____________________________。
(4)小鸿同学利用中和反应的原理,在空气中放置一段时间的酸雨(pH约为3)中加入足量的KOH,并就反应后混合溶液中的盐的成分进行探究:
Na2SO3+2HCl===2NaCl+SO2↑+H2O 【提出猜想】反应后混合溶液中盐的成分是什么?
【进行猜想】猜想1:只有K2SO3;
猜想2:______________;
猜想3:既有K2SO4,也有K2SO3。
【实验探究】限选试剂:稀硫酸、稀盐酸、稀硝酸、氯化钡溶液、澄清石灰水、品红溶液、紫色石蕊溶液。
只有K2SO4品红溶液褐色氯化钡溶液有气泡产生足量的稀盐酸归 类 探 究类型之一 框图型推断
[2013·宁波]在实验课中,各小组做了如下实验:
图Z8-2实验后,同学们按老师要求将废液都倒在指定的大烧杯中。小科猜想该烧杯中的废液可能有硫酸铜、硫酸锌、硫酸亚铁……应该可以从中提取出铁和铜。经思考后,他设计了如图Z8-3所示的实验,并设法使滤液甲和乙所含的溶质相同。
图Z8-3则:固体C是_______,操作③的名称是________,实验中所加的过量金属粉末是______。
【解析】 溶液中有关的三种金属的活动性锌最强,为了回收铁与铜,应在溶液中加入过量的锌,以全部置换出铁和铜,把过量的锌用稀硫酸除去。铁过滤锌实验室有一瓶无色溶液,由碱A和盐B两种化合物的水溶液混合而成;还有一瓶标签破损的未知稀酸溶液。通过实验发现:图Z8-4其中气体C能使澄清石灰水变浑浊,固体D为NaCl。请回答:
(1)将稀酸逐滴滴入A、B混合液中,产生气体与加入稀酸有如图Z8-5所示的关系,则化合物B可能是_____________________(写化学式)。
图Z8-5Na2CO3或NaHCO3(2)若实验前在混合液中滴入几滴紫色的石蕊试液,请描述稀酸逐滴滴入A、B混合液过程中溶液颜色变化。
【答案】 由蓝变紫、最后变红
【解析】 与稀酸反应后生成二氧化碳气体的盐是碳酸盐,且能和碱A共存的只能是碳酸钠或碳酸氢钠,加入稀酸后,首先发生酸和碱的中和反应。碱溶液中加入石蕊试液显蓝色,完全反应时,溶液呈中性,溶液为紫色,随着加入酸的过量,溶液显红色。
【点悟】 物质推断的依据是化学反应的原理。对物质的推断必须符合题意,如变式跟进中的A是碱,B是盐。
类型之二 叙述型推断
[2013·达州]有一包白色粉末,可能含有Ba(OH)2、KNO3、FeCl3、Na2CO3、Na2SO4中的一种或几种。为了确定其成分,进行如下实验:
①取一定量的白色粉末加入足量的水,振荡,静置,得白色沉淀,上层清液为无色。
②过滤,在白色沉淀中加入足量稀盐酸,白色沉淀全部溶解,且有气泡产生。
(1)据此推断,该白色粉末中一定含有____________ ________;可能含有__________;一定不含有__________ _________。Ba(OH)2、Na2CO3KNO3FeCl3、Na2SO4(2)写出步骤②中发生反应的化学方程式:__________ ____________________________。
【解析】 加水得白色沉淀和无色清液说明混合物中没有铁离子。白色沉淀可能是碳酸钡或硫酸钡,白色沉淀全部溶于稀盐酸,说明白色沉淀为碳酸钡,所以可以确定混合物中一定有Ba(OH)2、Na2CO3,一定没有FeCl3、Na2SO4。
BaCO3+2HCl===BaCl2+H2O+CO2↑现有一包白色粉末,其中含有CuSO4、BaCl2、NaOH、Na2CO3中的一种或几种。某化学小组为确定白色粉末的成分,进行了如下实验:
(Ⅰ)取一定量白色粉末,加入足量水,振荡,得到无色透明溶液;
(Ⅱ)取少量(Ⅰ)的溶液,加入足量盐酸,有气泡产生。
(提示:BaCO3难溶于水;Na2CO3的水溶液呈碱性)
(1)该白色粉末中肯定含有什么物质?____________ _________可能含有什么物质?__________________
(2)为确定可能含有的物质是否存在,还需做什么实验?请写出简要的实验步骤。
肯定含有可能含有NaOHNa2CO3【答案】 取少量(Ⅰ)的溶液,加入足量BaCl2溶液(或CaCl2溶液),静置,取上层清液滴加酚酞溶液
【解析】 溶于水得无色透明溶液既说明没有硫酸铜,也说明氯化钡和碳酸钠没有共存。加入盐酸产生气体,说明有碳酸钠,则说明没有氯化钡。
【点悟】 鉴别物质必须分析物质是否可以共存,也必须分析加水溶解后产生沉淀和所得滤液的颜色。
类型之三 探究型鉴别
[2013·衢州] 实验室有一瓶标签残缺的溶液,它可能是硫酸钠、碳酸钠和氯化钠溶液中的一种。龙龙、开开两位同学分别设计了下表方案进行鉴别。
根据上表回答问题:
(1)龙龙同学滴加的试剂可能是___________________ _________溶液(写出一种即可)。
(2)龙龙同学认为开开同学方案存在缺陷,理由是____ ________________________________________。
【解析】 三种钠盐的鉴别实质是鉴别硫酸根离子、碳酸根离子、氯离子。根据结论是硫酸钠溶液倒推加入的试剂是含钡离子的溶液,但为了避免对实验的干扰,实验中不能加入含硫酸根离子的稀硫酸。
BaCl2或Ba(NO3)2或Ba(OH)2加入的稀硫酸中的硫酸根离子对实验产生干扰[2012·北京]同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应。
(1)实验装备
①查阅资料:NaHCO3+NaOH===Na2CO3+H2O
②用一定溶质质量分数的NaHCO3、NaOH和Na2CO3三种溶液进行如下实验,为设计实验方案提供参考。
表中的现象Ⅰ为____________,现象Ⅱ发生反应的化学方程式为__________________________________ ___________。
(2)实验过程
【实验1】证明反应生成了Na2CO3同学们选用上表实验中的药品,设计了如图Z8-6所示实验,先在NaHCO3溶液中加入A溶液,无明显现象,再滴加NaOH溶液,溶液变浑浊,则A溶液是_________。有同学提出这个实验不足以证明有Na2CO3生成,其理由是________________________ ____________________________。
产生气泡Ca(OH)2+Na2CO3===2NaOH +CaCO3↓CaCl2CaCl2和NaOH反应生成Ca(OH)2,氢氧化钙是微溶物为了证明有Na2CO3生成,需要继续进行的操作是
_________________________________________________________________________________。
图Z8-6取少量反应后滤渣加入足量的稀盐酸,若产生无色气体证明有Na2CO3生成,反之则没有【实验2】证明反应后NaHCO3不存在。
同学们参考上表中的实验,又设计了一个实验,虽然没有观察到明显的实验现象,但可以证明反应发生了,该实验方案是________________________________________ ____________________________________________________________________。
(3)实验反思
通过实验1和实验2说明,对于没有明显现象的化学反应,可以从两个不同的角度证明反应的发生,这两个角度是_________________________________________________ _________________________。
取少量反应后的溶液加热至沸腾,将气体通入澄清石灰水,若澄清石灰水变浑浊,证明有NaHCO3存在,反之则没有一是可以通过检验反应物证明反应发生,二是可以通过检验产物证明反应发生【解析】 对于没有明显现象的化学反应,可以通过检验反应物是否存在证明反应是否发生,也可以通过证明是否有新物质生成证明反应是否发生。
【点悟】 通过实验探究鉴别或推断物质,需注意实验原理(反应原理)与实验现象。
易 错 警 示分析反应曲线致错
[2012·青岛]下列图像能正确反映其对应关系的是 ( )
图Z8-7A.向氢氧化钠溶液中不断加水,溶液pH与加入水的质量的关系
B.向盛有氧化铜的烧杯中加入稀盐酸至过量,生成氯化铜质量与加入稀盐酸质量的关系
C.一定量的稀硫酸与锌粒反应,溶液的质量与反应时间的关系
D.向氯化铜和硝酸铜的混合溶液中滴加氢氧化钠溶液,生成沉淀与加入氢氧化钠溶液的质量关系
【错解】 D【错因分析】 氯化铜和硝酸铜的混合溶液中滴加氢氧化钠溶液,立即生成沉淀。向氯化铜和稀盐酸的混合溶液中滴加氢氧化钠溶液,生成沉淀的曲线符合D图曲线,审题错误。
【正解】 C
用质量相等的锌粉和铁粉,分别与溶质质量分数相同且等质量的稀盐酸充分发生反应,产生氢气的质量与时间的关系如图Z8-8所示。请回答下列问题:
图Z8-8(1)表示锌粉与稀盐酸反应的曲线为______(填a或b)。
(2)对于a曲线表示的反应,物质________(填名称)有剩余。
【解析】 由于锌比铁活泼,根据图像知充分反应后首先反应完的是锌。当盐酸足量时等质量的锌粉和铁粉生成氢气少的是锌,所以表示锌粉与稀盐酸反应的曲线是a。等质量的锌粉完全反应比铁粉消耗盐酸的质量少,所以与锌粉反应的盐酸一定有剩余,而与铁粉反应的盐酸可能有剩余也可能正好反应。
a盐酸
