化学人教版(2019)必修第二册5.3.1.硅及其化合物(共38张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.3.1.硅及其化合物(共38张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 9.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-07 20:18:57 | ||
图片预览









文档简介
(共38张PPT)
新人教版必修第二册
第五章 化工生产中重要的非金属元素
第三节 无机非金属材料
第1课时 硅及其化合物
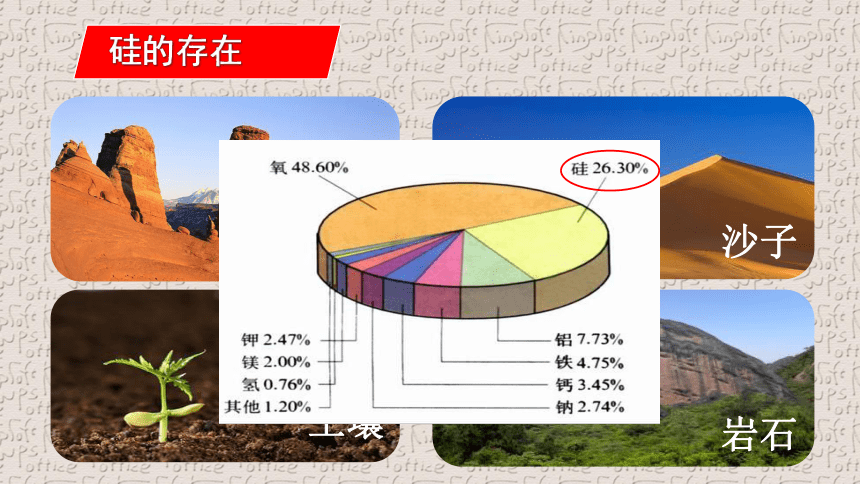
岩石
沙子
土壤
岩石
硅的存在
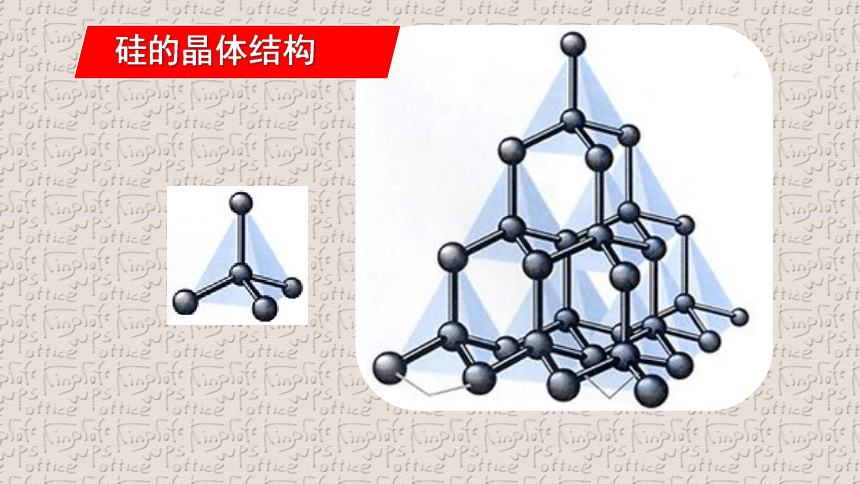
硅的晶体结构
硅单质
硅单质
晶体硅
无定形硅
灰黑色固体
金属光泽
硬而脆
熔点高
导电性介于
金属和
非金属之间
2.硅的物理性质
单晶硅芯片
3.硅的用途
太阳能光电池-硅板
3.硅的用途
光电池
3.硅的用途
硅铁合金
3.硅的用途
Si+2Cl2=== SiCl4
Si+O2 === SiO2
Si + 2F2 == SiF4
Si + 4HF == SiF4↑+ 2H2↑
Si + 2NaOH + H2O == Na2SiO3 + 2H2↑
常温下化学性质不活泼
加热
4.硅的化学性质
制粗硅:在工业上,用碳在高温下还原二氧化硅的方法制得粗硅
SiO2 +2C == Si + 2CO↑
高温
提 纯:生成的SiCl4液体通过蒸馏,除去其中的杂质。然后用氢气还原
Si+2Cl2==SiCl4
SiCl4+2H2==Si+4HCl
高温
(高纯硅)
硅的制备
(温度为 400~500℃)
2C+ SiO2=== Si+2CO↑
高温
Si+2Cl2===SiCl4
SiCl4+2H2===Si+4HCl
高温
一、硅单质与半导体材料
粗硅
纯硅
5.硅的制备方法
1.二氧化硅的存在形式
硅石(天然)
结晶形
无定形
二、二氧化硅 SiO2
硅石
石英
蔷薇石英
茶水晶
玛瑙
石英
水晶
石英、玛瑙
石英
光导纤维
1、用途
石英 水晶 玛瑙 光导纤维
Si
O
二氧化硅的晶体结构示意图
SiO2是正四面体的空间网状结构,
因此性质很稳定
2.二氧化硅化学性质
▲ 不溶于水也不与水反应
SiO2+2NaOH=Na2SiO3+H2O
SiO2+CaO===CaSiO3
高温
① 是酸性氧化物
▲ ②与酸反应:只与氢氟酸反应
SiO2 + 4HF == SiF4 ↑ + 2H2O
在高温下与碳酸盐的反应
SiO2+Na2CO3==CO2 ↑ +Na2SiO3
高温
SiO2+CaCO3===CO2 ↑+ CaSiO3
高温
在玻璃表面涂上一层石蜡
在石蜡上雕刻出花纹,向挖空部分加少量氢氟酸
洗掉酸并去掉石蜡
1、实验室盛装NaOH溶液的试剂瓶用橡皮塞而不用玻璃塞,你知道为什么吗?
防止玻璃中的SiO2与NaOH溶液反应生成粘稠的Na2SiO3,使瓶塞和瓶口粘在一起。
2、玻璃很硬,玻璃中主要成分是SiO2,量筒上的刻度是如何刻出来的?
SiO2+4HF=SiF4↑+2H2O
3、实验室为什么不用玻璃瓶盛装HF?
HF能腐蚀玻璃,因此盛装HF不能用玻璃试剂瓶而用塑料瓶
三、硅酸(H2SiO3)
硅酸浓度小:聚合成胶体溶液—硅酸溶胶
浓度大:软而透明胶冻状—硅酸凝胶
干燥后:脱水得硅酸干凝胶—硅胶
硅
胶
干
燥
剂
硅酸凝胶经干燥脱水就形成干胶,称为“硅胶”。
酸性较弱,比碳酸的酸性还弱。不溶于水,不能是指示剂变色,是一种白色粉末状固体
三、硅酸(H2SiO3)
干燥硅胶
湿硅胶
(2)硅酸的制备(强酸制弱酸)
Na2SiO3+2HCl=2NaCl+H2SiO3↓
H2SiO3===H2O+SiO2
△
Na2SiO3 + H2O + CO2 == Na2CO3 + H2SiO3↓
(3)硅酸的性质
①不稳定性
②弱酸性
H2SiO3+2NaOH=2 H2O +Na2SiO3
四、硅酸盐
1、 定义:
由硅、氧和金属元素组成的化合物的总称
2、 表示:金属氧化物和SiO2的组合形式
结构复杂、大多不溶于水、化学性质稳定
原则:金属氧化物(较活泼→不活泼)、SiO2、水
四、硅酸盐
Na2SiO3
(1)物理性质
(2)化学性质:
白色固体、易溶于水、水溶液俗称水玻璃或泡花碱
不能燃烧——防火材料;
与酸反应可制备硅酸
四、硅酸盐
三大硅酸盐产品
①水泥
②玻璃
③陶瓷
石灰石+黏土(水泥回转窑)
石灰石+纯碱+石英(玻璃窑)
黏土
芯片
历史篇
硅材料
玻璃、水泥
水晶、玛瑙
石器、岩片
现代篇
光导纤维
硅酸盐
石英坩埚
硅单质
化合态
二氧化硅
硅酸
硅胶
未来篇
自然篇
——从沙中崛起!
新人教版必修第二册
第五章 化工生产中重要的非金属元素
第三节 无机非金属材料
第1课时 硅及其化合物
岩石
沙子
土壤
岩石
硅的存在
硅的晶体结构
硅单质
硅单质
晶体硅
无定形硅
灰黑色固体
金属光泽
硬而脆
熔点高
导电性介于
金属和
非金属之间
2.硅的物理性质
单晶硅芯片
3.硅的用途
太阳能光电池-硅板
3.硅的用途
光电池
3.硅的用途
硅铁合金
3.硅的用途
Si+2Cl2=== SiCl4
Si+O2 === SiO2
Si + 2F2 == SiF4
Si + 4HF == SiF4↑+ 2H2↑
Si + 2NaOH + H2O == Na2SiO3 + 2H2↑
常温下化学性质不活泼
加热
4.硅的化学性质
制粗硅:在工业上,用碳在高温下还原二氧化硅的方法制得粗硅
SiO2 +2C == Si + 2CO↑
高温
提 纯:生成的SiCl4液体通过蒸馏,除去其中的杂质。然后用氢气还原
Si+2Cl2==SiCl4
SiCl4+2H2==Si+4HCl
高温
(高纯硅)
硅的制备
(温度为 400~500℃)
2C+ SiO2=== Si+2CO↑
高温
Si+2Cl2===SiCl4
SiCl4+2H2===Si+4HCl
高温
一、硅单质与半导体材料
粗硅
纯硅
5.硅的制备方法
1.二氧化硅的存在形式
硅石(天然)
结晶形
无定形
二、二氧化硅 SiO2
硅石
石英
蔷薇石英
茶水晶
玛瑙
石英
水晶
石英、玛瑙
石英
光导纤维
1、用途
石英 水晶 玛瑙 光导纤维
Si
O
二氧化硅的晶体结构示意图
SiO2是正四面体的空间网状结构,
因此性质很稳定
2.二氧化硅化学性质
▲ 不溶于水也不与水反应
SiO2+2NaOH=Na2SiO3+H2O
SiO2+CaO===CaSiO3
高温
① 是酸性氧化物
▲ ②与酸反应:只与氢氟酸反应
SiO2 + 4HF == SiF4 ↑ + 2H2O
在高温下与碳酸盐的反应
SiO2+Na2CO3==CO2 ↑ +Na2SiO3
高温
SiO2+CaCO3===CO2 ↑+ CaSiO3
高温
在玻璃表面涂上一层石蜡
在石蜡上雕刻出花纹,向挖空部分加少量氢氟酸
洗掉酸并去掉石蜡
1、实验室盛装NaOH溶液的试剂瓶用橡皮塞而不用玻璃塞,你知道为什么吗?
防止玻璃中的SiO2与NaOH溶液反应生成粘稠的Na2SiO3,使瓶塞和瓶口粘在一起。
2、玻璃很硬,玻璃中主要成分是SiO2,量筒上的刻度是如何刻出来的?
SiO2+4HF=SiF4↑+2H2O
3、实验室为什么不用玻璃瓶盛装HF?
HF能腐蚀玻璃,因此盛装HF不能用玻璃试剂瓶而用塑料瓶
三、硅酸(H2SiO3)
硅酸浓度小:聚合成胶体溶液—硅酸溶胶
浓度大:软而透明胶冻状—硅酸凝胶
干燥后:脱水得硅酸干凝胶—硅胶
硅
胶
干
燥
剂
硅酸凝胶经干燥脱水就形成干胶,称为“硅胶”。
酸性较弱,比碳酸的酸性还弱。不溶于水,不能是指示剂变色,是一种白色粉末状固体
三、硅酸(H2SiO3)
干燥硅胶
湿硅胶
(2)硅酸的制备(强酸制弱酸)
Na2SiO3+2HCl=2NaCl+H2SiO3↓
H2SiO3===H2O+SiO2
△
Na2SiO3 + H2O + CO2 == Na2CO3 + H2SiO3↓
(3)硅酸的性质
①不稳定性
②弱酸性
H2SiO3+2NaOH=2 H2O +Na2SiO3
四、硅酸盐
1、 定义:
由硅、氧和金属元素组成的化合物的总称
2、 表示:金属氧化物和SiO2的组合形式
结构复杂、大多不溶于水、化学性质稳定
原则:金属氧化物(较活泼→不活泼)、SiO2、水
四、硅酸盐
Na2SiO3
(1)物理性质
(2)化学性质:
白色固体、易溶于水、水溶液俗称水玻璃或泡花碱
不能燃烧——防火材料;
与酸反应可制备硅酸
四、硅酸盐
三大硅酸盐产品
①水泥
②玻璃
③陶瓷
石灰石+黏土(水泥回转窑)
石灰石+纯碱+石英(玻璃窑)
黏土
芯片
历史篇
硅材料
玻璃、水泥
水晶、玛瑙
石器、岩片
现代篇
光导纤维
硅酸盐
石英坩埚
硅单质
化合态
二氧化硅
硅酸
硅胶
未来篇
自然篇
——从沙中崛起!
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
