化学人教版(2019)选择性必修2 1.2.1原子结构与元素周期表(共27张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 1.2.1原子结构与元素周期表(共27张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-08 00:00:00 | ||
图片预览



文档简介
(共27张PPT)
第二节 原子结构与原子的性质
第1课时 原子结构与元素周期表
2019人教版 选择性必修 2 第一章 原子结构与性质
1869年,门捷列夫发现,按相对原子质量从小到大的顺序将元素排列起来,得到一个元素序列,并从最轻的元素氢开始进行编号,称为原子序数。这个序列中的元素性质随着原子序数递增发生周期性的重复,这一规律被门捷列夫称作元素周期律。
1913年,英国物理学家莫塞莱证明原子序数即原子核电荷数。随后元素周期律表述为元素的性质随元素原子的核电荷数递增发生周期性递变。元素的这一按其原子核电荷数递增排列的序列称为元素周期系。
原子序数=核电荷数=质子数
门捷列夫
莫塞莱
一、原子结构与元素周期律
1.元素周期律
元素的性质随元素原子的核电荷数递增发生周期性递变。
2.元素周期系
元素按其原子核电荷数递增排列的序列。
3,元素周期表
呈现元素周期系的表格。
(一)元素周期律、元素周期系和元素周期表
元素周期系只有一个,
元素周期表多种多样。
特征:
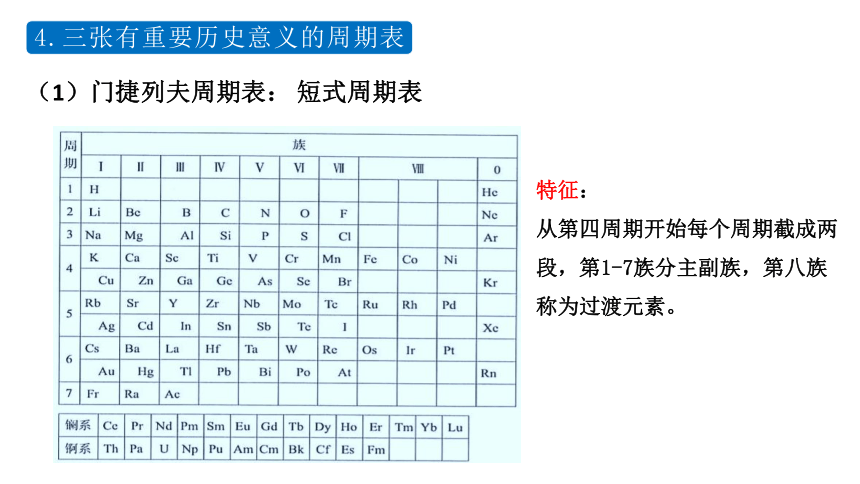
从第四周期开始每个周期截成两段,第1-7族分主副族,第八族称为过渡元素。
(1)门捷列夫周期表:
短式周期表
4.三张有重要历史意义的周期表
特征:
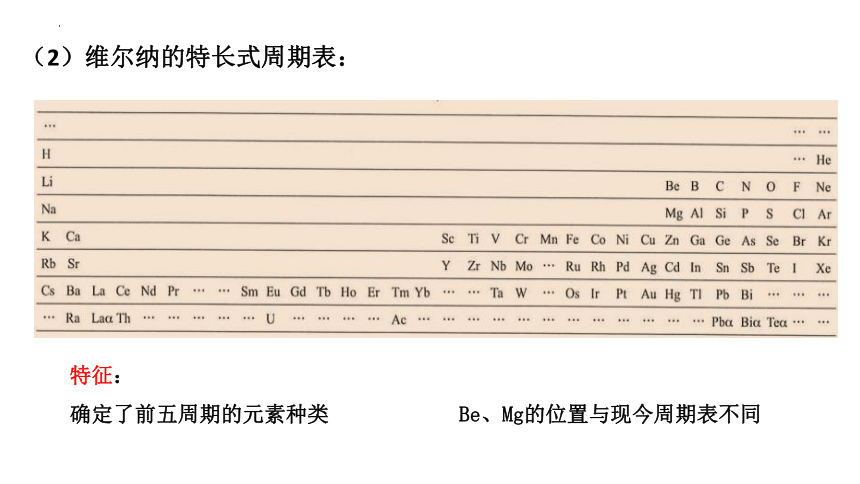
确定了前五周期的元素种类 Be、Mg的位置与现今周期表不同
(2)维尔纳的特长式周期表:
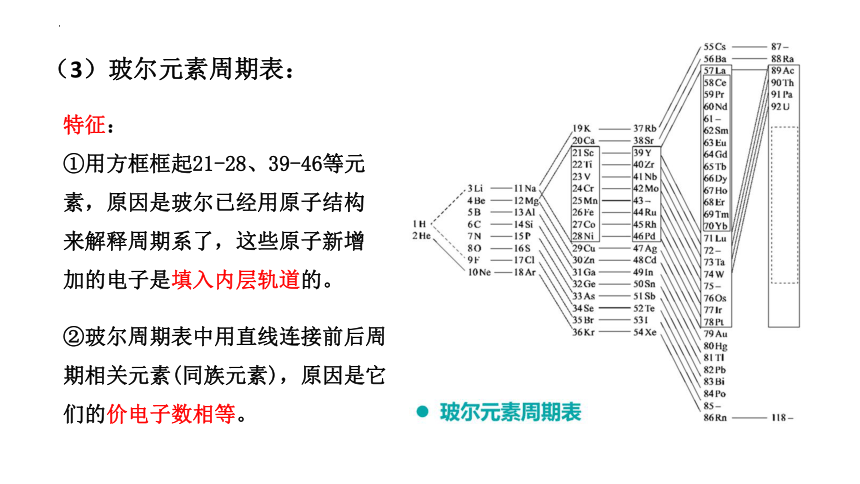
(3)玻尔元素周期表:
特征:
①用方框框起21-28、39-46等元素,原因是玻尔已经用原子结构来解释周期系了,这些原子新增加的电子是填入内层轨道的。
②玻尔周期表中用直线连接前后周期相关元素(同族元素),原因是它们的价电子数相等。
形形色色的元素周期表:
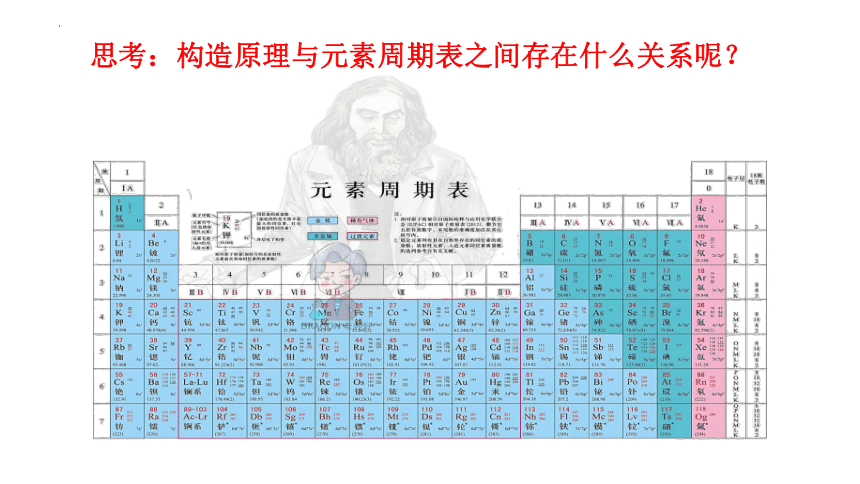
思考:构造原理与元素周期表之间存在什么关系呢?
1s1
2s1
3s1
4s1
1s2
2s2
3s2
4s2
2s2
2p6
3s2
3p6
4s2
4p6
2s2
2p1
2s2
2p2
2s2
2p3
2s2
2p4
2s2
2p5
3s2
3p1
3s2
3p2
3s2
3p3
3s2
3p4
3s2
3p5
4s2
4p1
4s2
4p2
4s2
4p3
4s2
4p4
4s2
4p5
3d1
4s2
3d2
4s2
3d3
4s2
3d5
4s1
3d5
4s2
3d6
4s2
3d7
4s2
3d8
4s2
3d10
4s1
3d10
4s2
第一周期:从 开始,以 结束
1s1
1s2
其余各周期:从 能级开始,以 能级结束
ns
np
(n=周期序数=电子层数)
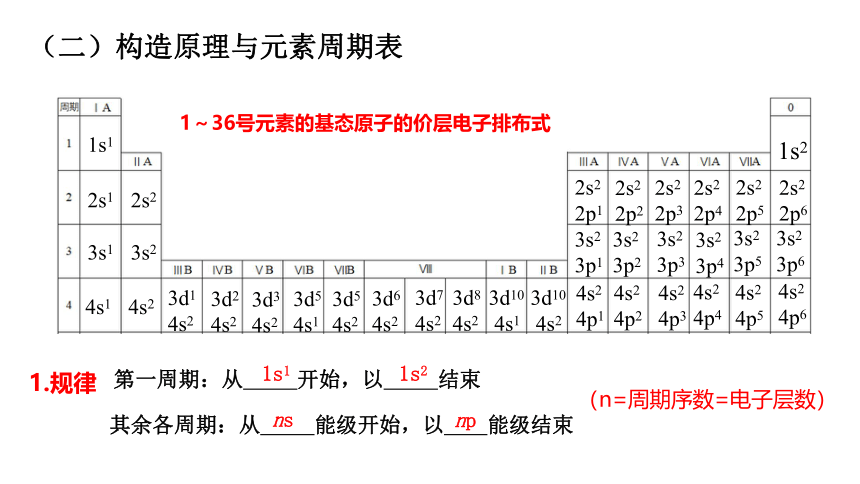
(二)构造原理与元素周期表
1~36号元素的基态原子的价层电子排布式
1.规律
周 期 价电子排布 各周期的能级 对应能级组 最多容纳电子数 元素
种类
第ⅠA族 0族
一 1s1 1s2 1s 2 2
二 2s1 2s22p6 2s、2p 8 8
三 3s1 3s23p6 3s、3p 8 8
四 4s1 4s24p6 4s、3d、4p 18 18
五 5s1 5s25p6 5s、4d、5p 18 18
六 6s1 6s26p6 6s、4f、5d、6p 32 32
七 7s1 7s27p6 7s、5f、6d、7p 32 32
2.原子核外电子排布与周期的关系
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f→5d→6p→7s→5f→6d→7p
p
f
d
s
s
p
s
d
p
f
s
d
p
d
s
p
p
s
s
以一个方格代表一种元素,每个周期排一个横行,并按s、p、d、f分段,左侧对齐
3.元素周期表的形成
p段与p段对齐,d段与d段对齐、f段单独列出
(1)元素周期表共有几个周期?每个周期各有多少种元素?为什么第一周期结尾元素的电子排布跟同族的其他周期元素的不同
周期
短周期
长周期
第1周期:2 种元素
第2周期:8 种元素
第3周期:8 种元素
第4周期:18 种元素
第5周期:18 种元素
第6周期:32 种元素
第7周期:32 种元素
7横行
第一周期结尾元素只有一个1s能级,最多只能容纳2个电子。
(三)再探元素周期表 课本P21 探究
(2)元素周期表共有多少个列 各列的价层电子数各为多少 同列元素价层电子数是否相等 元素周期表可分为哪些族 族序有什么规律
(三)再探元素周期表 课本P21 探究
元素周期表共有18列,可分为7主、7副、第Ⅷ族、0族,共16个族。
(2)元素周期表共有多少个列 各列的价层电子数各为多少 同列元素价层电子数是否相等 元素周期表可分为哪些族 族序有什么规律
(三)再探元素周期表 课本P21 探究
ⅠA 0
1s1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 1s2
2s1 2s2 2s2 2p1 2s2 2p2 2s2 2p3 2s2 2p4 2s22p5 2s2
2p6
3s1 3s2 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB 3s2 3p1 3s2 3p2 3s2 3p3 3s2 3p4 3s23p5 3s2
3p6
4s1 4s2 3d1 4s2 3d2 4s2 3d3 4s2 3d5 4s1 3d5 4s2 3d6 4s2 3d7 4s2 3d8 4s2 3d10 4s1 3d104s2 4s2 4p1 4s2 4p2 4s2 4p3 4s2 4p4 4s24p5 4s2
4p6
主族元素: ns1~2、ns2np1~6
族序数=主族元素的价层电子数
副族元素ⅢB→ⅦB:族序数=价层电子数
ⅠB→ⅡB,族序数=最外层电子数
族序数规律:
过渡元素的价电子通式: (n-1)d1~10ns1~2(镧系和锕系除外)
1.元素周期表的结构
元素周期表
(三)再探元素周期表
ⅠA 0
1s1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 1s2
2s1 2s2 2s2 2p1 2s2 2p2 2s2 2p3 2s2 2p4 2s22p5 2s2
2p6
3s1 3s2 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB 3s2 3p1 3s2 3p2 3s2 3p3 3s2 3p4 3s23p5 3s2
3p6
4s1 4s2 3d1 4s2 3d2 4s2 3d3 4s2 3d5 4s1 3d5 4s2 3d6 4s2 3d7 4s2 3d8 4s2 3d10 4s1 3d104s2 4s2 4p1 4s2 4p2 4s2 4p3 4s2 4p4 4s24p5 4s2
4p6
ns1~2
ns2np6
(n-1)d1~10ns1~2
金属元素,也称过渡元素
ns2np1~5
多数是非金属元素
金属元素
2.元素周期表的分区
(1)根据元素的金属性和非金属性分区
ⅠA 0
ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
s
d
ds
p
f
ns1
ns2
ns2np1
ns2np5
ns2np6
(n-1)d1~9ns1~2(除镧系和锕系)
(n-1)d10ns1~2
过渡金属(n-1)d1~10ns1~2(除镧系和锕系)
2.元素周期表的分区
(2)根据元素原子的核外电子排布分区
以最后填入的电子的能级符号作为该区的符号。
元素周期表可分为5个区。
s区有2列,d区有8列,ds区有2列、 p区有6列。
①s区:
包括ⅠA、ⅡA族元素,价电子排布式为ns1~2,除氢元素外均属于活泼金属元素。
各区元素的价电子排布特点
②p区:
包括ⅢA~ⅦA族以及0族元素,价电子排布式为ns2np1~6(除He外),最后一个电子填在np能级上,为非金属元素和少数金属元素,最外层电子参与反应。
③d区:金属元素
包括ⅢB~Ⅷ族元素(除镧系、锕系外),价电子排布式为(n-1)d1~9ns1~2(钯除外),d轨道可以不同程度地参与化学键的形成,全是金属元素。
④ds区:
包括ⅠB、ⅡB族元素,价电子排布式为(n-1)d10ns1~2。由于d轨道已填满电子,因此d轨道一般不参与化学键的形成,全为金属元素。
⑤f区:
包括镧系和锕系元素,价电子排布式为(n-2)f0~14(n-1)d0~2ns2。
课本P21讨论:
(3) 处于非金属与金属分界线上的元素常被称为半金属或类金属,为什么?
处于非金属与金属分界线上的元素:
既能表现出一定的非金属性,又能表现出一定的金属性
(4) Cr和Cu的价层电子排布符合构造原理么?还有哪些不符合?
Nb、Mo、Ru、Pd、Ag、Pt、Au等
不符合;
(5) 预言119号元素基态原子最外层电子排布,并预测第八周期有多少种元素。
8s1
50 种
课本P21讨论:
(5) 预言119号元素基态原子最外层电子排布,并预测第八周期有多少种元素。
1s 2s→ 2p 3s→ 3p 4s→3d →4p 5s→ 4d→5p 6s→4f→ 5d→6p 7s→5f→
6d→7p
周期 一 二 三 四 五 六 七
元素数 2 8 8 18 18 32 32
价层电子填入的能级顺序:
8s → 5g → 6f → 7d → 8p
元素个数为:
2 + 18 + 14 + 10 + 6 = 50 种
课本P22 思考与讨论
在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的这种相似性被称为对角线规则。
①对角线规则是从相关元素及其化合物的许多性质中总结出来的经验规则,不是定理。
②相似性:例如Li、Mg在空气中燃烧的产物分别为Li2O和MgO;铍和铝的氢氧化物均为两性氢氧化物;B和Si的含氧酸都是弱酸。
4Li+O2 2Li2O
点燃
2Mg+O2 2MgO
点燃
Al(OH)3+3HCl = AlCl3+3H2O,Al(OH)3+NaOH = NaAlO2+2H2O
Be(OH)2+2HCl = BeCl2+2H2O,Be(OH)2+2NaOH = Na2BeO2+2H2O
课本P22 思考与讨论
在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的这种相似性被称为对角线规则。
①对角线规则是从相关元素及其化合物的许多性质中总结出来的经验规则,不是定理。
②相似性:例如Li、Mg在空气中燃烧的产物分别为Li2O和MgO;铍和铝的氢氧化物均为两性氢氧化物;B和Si的含氧酸都是弱酸。
自然界中B与Si均以化合物的形式存在;B与Si的单质都易与强碱反应,且不与稀酸反应:
2B+2KOH+2H2O = 2KBO2+3H2↑,
Si+2KOH+H2O= K2SiO3+2H2↑
原子结构与元素周期表
电子排布与周期
电子排布与族
电子排布与元素分区
排满=0族
ⅠA∽ⅦA; ⅢB∽ⅦB=价层电子数
s区:ⅠA∽ⅡA
d区:ⅢB∽ⅦB、Ⅷ
ds区:ⅠB∽ⅡB
p区: ⅢA∽ⅦA
f区:镧系和锕系
ⅠB∽ⅡB=ns电子数
周期序数=能层数
课堂小结
1、外围电子排布为4d55s1的元素在周期表中的位置是( )
A、第四周期ⅠB族 B、第五周期ⅠB族
C、第四周期ⅥB族 D、第五周期ⅥB族
D
2、已知M2+的3d轨道中有6个电子。试推断:
(1)M原子的电子排布式。
1s22s22p63s23p63d64s2
(2)M原子的最外层电子数为多少?
2
(3)M元素在周期表中的位置。
第四周期Ⅷ族
随堂检测
3、仔细观察下图,回答下列问题:
(1)B的原子结构示意图为________,B元素位于元素周期表的第_____周期______族。
二
ⅢA
(3)根据周期律知识,硼酸酸性比碳酸____,理由是__________________。
(4)根据Mg在空气中的燃烧情况,Li在空气中燃烧生成的产物为_____________(用化学式表示)。
弱
硼的非金属性比碳弱
Li2O、Li3N
(2)铍的最高价氧化物的水化物是______(填“酸性”“碱性”或“两性”)化合物,证明这一结论的有关离子方程式是___________________________________________
_______________________________________________________。
两性
Be(OH)2+2H+=Be2++2H2O
Be(OH)2+2OH-=BeO22-+ 2H2O
随堂检测
4、下列对元素周期表的认识正确的是( )
A、有9行7个周期
B、有16列16个族
C、有三个短周期四个长周期
D、非金属元素存在于主族与副族中
C
5、下列叙述中正确的是( )
A、除0族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B、除短周期外,其他周期均有18种元素
C、副族元素中没有非金属元素
D、碱金属元素是指第ⅠA族的所有元素
C
随堂检测
第二节 原子结构与原子的性质
第1课时 原子结构与元素周期表
2019人教版 选择性必修 2 第一章 原子结构与性质
1869年,门捷列夫发现,按相对原子质量从小到大的顺序将元素排列起来,得到一个元素序列,并从最轻的元素氢开始进行编号,称为原子序数。这个序列中的元素性质随着原子序数递增发生周期性的重复,这一规律被门捷列夫称作元素周期律。
1913年,英国物理学家莫塞莱证明原子序数即原子核电荷数。随后元素周期律表述为元素的性质随元素原子的核电荷数递增发生周期性递变。元素的这一按其原子核电荷数递增排列的序列称为元素周期系。
原子序数=核电荷数=质子数
门捷列夫
莫塞莱
一、原子结构与元素周期律
1.元素周期律
元素的性质随元素原子的核电荷数递增发生周期性递变。
2.元素周期系
元素按其原子核电荷数递增排列的序列。
3,元素周期表
呈现元素周期系的表格。
(一)元素周期律、元素周期系和元素周期表
元素周期系只有一个,
元素周期表多种多样。
特征:
从第四周期开始每个周期截成两段,第1-7族分主副族,第八族称为过渡元素。
(1)门捷列夫周期表:
短式周期表
4.三张有重要历史意义的周期表
特征:
确定了前五周期的元素种类 Be、Mg的位置与现今周期表不同
(2)维尔纳的特长式周期表:
(3)玻尔元素周期表:
特征:
①用方框框起21-28、39-46等元素,原因是玻尔已经用原子结构来解释周期系了,这些原子新增加的电子是填入内层轨道的。
②玻尔周期表中用直线连接前后周期相关元素(同族元素),原因是它们的价电子数相等。
形形色色的元素周期表:
思考:构造原理与元素周期表之间存在什么关系呢?
1s1
2s1
3s1
4s1
1s2
2s2
3s2
4s2
2s2
2p6
3s2
3p6
4s2
4p6
2s2
2p1
2s2
2p2
2s2
2p3
2s2
2p4
2s2
2p5
3s2
3p1
3s2
3p2
3s2
3p3
3s2
3p4
3s2
3p5
4s2
4p1
4s2
4p2
4s2
4p3
4s2
4p4
4s2
4p5
3d1
4s2
3d2
4s2
3d3
4s2
3d5
4s1
3d5
4s2
3d6
4s2
3d7
4s2
3d8
4s2
3d10
4s1
3d10
4s2
第一周期:从 开始,以 结束
1s1
1s2
其余各周期:从 能级开始,以 能级结束
ns
np
(n=周期序数=电子层数)
(二)构造原理与元素周期表
1~36号元素的基态原子的价层电子排布式
1.规律
周 期 价电子排布 各周期的能级 对应能级组 最多容纳电子数 元素
种类
第ⅠA族 0族
一 1s1 1s2 1s 2 2
二 2s1 2s22p6 2s、2p 8 8
三 3s1 3s23p6 3s、3p 8 8
四 4s1 4s24p6 4s、3d、4p 18 18
五 5s1 5s25p6 5s、4d、5p 18 18
六 6s1 6s26p6 6s、4f、5d、6p 32 32
七 7s1 7s27p6 7s、5f、6d、7p 32 32
2.原子核外电子排布与周期的关系
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f→5d→6p→7s→5f→6d→7p
p
f
d
s
s
p
s
d
p
f
s
d
p
d
s
p
p
s
s
以一个方格代表一种元素,每个周期排一个横行,并按s、p、d、f分段,左侧对齐
3.元素周期表的形成
p段与p段对齐,d段与d段对齐、f段单独列出
(1)元素周期表共有几个周期?每个周期各有多少种元素?为什么第一周期结尾元素的电子排布跟同族的其他周期元素的不同
周期
短周期
长周期
第1周期:2 种元素
第2周期:8 种元素
第3周期:8 种元素
第4周期:18 种元素
第5周期:18 种元素
第6周期:32 种元素
第7周期:32 种元素
7横行
第一周期结尾元素只有一个1s能级,最多只能容纳2个电子。
(三)再探元素周期表 课本P21 探究
(2)元素周期表共有多少个列 各列的价层电子数各为多少 同列元素价层电子数是否相等 元素周期表可分为哪些族 族序有什么规律
(三)再探元素周期表 课本P21 探究
元素周期表共有18列,可分为7主、7副、第Ⅷ族、0族,共16个族。
(2)元素周期表共有多少个列 各列的价层电子数各为多少 同列元素价层电子数是否相等 元素周期表可分为哪些族 族序有什么规律
(三)再探元素周期表 课本P21 探究
ⅠA 0
1s1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 1s2
2s1 2s2 2s2 2p1 2s2 2p2 2s2 2p3 2s2 2p4 2s22p5 2s2
2p6
3s1 3s2 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB 3s2 3p1 3s2 3p2 3s2 3p3 3s2 3p4 3s23p5 3s2
3p6
4s1 4s2 3d1 4s2 3d2 4s2 3d3 4s2 3d5 4s1 3d5 4s2 3d6 4s2 3d7 4s2 3d8 4s2 3d10 4s1 3d104s2 4s2 4p1 4s2 4p2 4s2 4p3 4s2 4p4 4s24p5 4s2
4p6
主族元素: ns1~2、ns2np1~6
族序数=主族元素的价层电子数
副族元素ⅢB→ⅦB:族序数=价层电子数
ⅠB→ⅡB,族序数=最外层电子数
族序数规律:
过渡元素的价电子通式: (n-1)d1~10ns1~2(镧系和锕系除外)
1.元素周期表的结构
元素周期表
(三)再探元素周期表
ⅠA 0
1s1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 1s2
2s1 2s2 2s2 2p1 2s2 2p2 2s2 2p3 2s2 2p4 2s22p5 2s2
2p6
3s1 3s2 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB 3s2 3p1 3s2 3p2 3s2 3p3 3s2 3p4 3s23p5 3s2
3p6
4s1 4s2 3d1 4s2 3d2 4s2 3d3 4s2 3d5 4s1 3d5 4s2 3d6 4s2 3d7 4s2 3d8 4s2 3d10 4s1 3d104s2 4s2 4p1 4s2 4p2 4s2 4p3 4s2 4p4 4s24p5 4s2
4p6
ns1~2
ns2np6
(n-1)d1~10ns1~2
金属元素,也称过渡元素
ns2np1~5
多数是非金属元素
金属元素
2.元素周期表的分区
(1)根据元素的金属性和非金属性分区
ⅠA 0
ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
s
d
ds
p
f
ns1
ns2
ns2np1
ns2np5
ns2np6
(n-1)d1~9ns1~2(除镧系和锕系)
(n-1)d10ns1~2
过渡金属(n-1)d1~10ns1~2(除镧系和锕系)
2.元素周期表的分区
(2)根据元素原子的核外电子排布分区
以最后填入的电子的能级符号作为该区的符号。
元素周期表可分为5个区。
s区有2列,d区有8列,ds区有2列、 p区有6列。
①s区:
包括ⅠA、ⅡA族元素,价电子排布式为ns1~2,除氢元素外均属于活泼金属元素。
各区元素的价电子排布特点
②p区:
包括ⅢA~ⅦA族以及0族元素,价电子排布式为ns2np1~6(除He外),最后一个电子填在np能级上,为非金属元素和少数金属元素,最外层电子参与反应。
③d区:金属元素
包括ⅢB~Ⅷ族元素(除镧系、锕系外),价电子排布式为(n-1)d1~9ns1~2(钯除外),d轨道可以不同程度地参与化学键的形成,全是金属元素。
④ds区:
包括ⅠB、ⅡB族元素,价电子排布式为(n-1)d10ns1~2。由于d轨道已填满电子,因此d轨道一般不参与化学键的形成,全为金属元素。
⑤f区:
包括镧系和锕系元素,价电子排布式为(n-2)f0~14(n-1)d0~2ns2。
课本P21讨论:
(3) 处于非金属与金属分界线上的元素常被称为半金属或类金属,为什么?
处于非金属与金属分界线上的元素:
既能表现出一定的非金属性,又能表现出一定的金属性
(4) Cr和Cu的价层电子排布符合构造原理么?还有哪些不符合?
Nb、Mo、Ru、Pd、Ag、Pt、Au等
不符合;
(5) 预言119号元素基态原子最外层电子排布,并预测第八周期有多少种元素。
8s1
50 种
课本P21讨论:
(5) 预言119号元素基态原子最外层电子排布,并预测第八周期有多少种元素。
1s 2s→ 2p 3s→ 3p 4s→3d →4p 5s→ 4d→5p 6s→4f→ 5d→6p 7s→5f→
6d→7p
周期 一 二 三 四 五 六 七
元素数 2 8 8 18 18 32 32
价层电子填入的能级顺序:
8s → 5g → 6f → 7d → 8p
元素个数为:
2 + 18 + 14 + 10 + 6 = 50 种
课本P22 思考与讨论
在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的这种相似性被称为对角线规则。
①对角线规则是从相关元素及其化合物的许多性质中总结出来的经验规则,不是定理。
②相似性:例如Li、Mg在空气中燃烧的产物分别为Li2O和MgO;铍和铝的氢氧化物均为两性氢氧化物;B和Si的含氧酸都是弱酸。
4Li+O2 2Li2O
点燃
2Mg+O2 2MgO
点燃
Al(OH)3+3HCl = AlCl3+3H2O,Al(OH)3+NaOH = NaAlO2+2H2O
Be(OH)2+2HCl = BeCl2+2H2O,Be(OH)2+2NaOH = Na2BeO2+2H2O
课本P22 思考与讨论
在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的这种相似性被称为对角线规则。
①对角线规则是从相关元素及其化合物的许多性质中总结出来的经验规则,不是定理。
②相似性:例如Li、Mg在空气中燃烧的产物分别为Li2O和MgO;铍和铝的氢氧化物均为两性氢氧化物;B和Si的含氧酸都是弱酸。
自然界中B与Si均以化合物的形式存在;B与Si的单质都易与强碱反应,且不与稀酸反应:
2B+2KOH+2H2O = 2KBO2+3H2↑,
Si+2KOH+H2O= K2SiO3+2H2↑
原子结构与元素周期表
电子排布与周期
电子排布与族
电子排布与元素分区
排满=0族
ⅠA∽ⅦA; ⅢB∽ⅦB=价层电子数
s区:ⅠA∽ⅡA
d区:ⅢB∽ⅦB、Ⅷ
ds区:ⅠB∽ⅡB
p区: ⅢA∽ⅦA
f区:镧系和锕系
ⅠB∽ⅡB=ns电子数
周期序数=能层数
课堂小结
1、外围电子排布为4d55s1的元素在周期表中的位置是( )
A、第四周期ⅠB族 B、第五周期ⅠB族
C、第四周期ⅥB族 D、第五周期ⅥB族
D
2、已知M2+的3d轨道中有6个电子。试推断:
(1)M原子的电子排布式。
1s22s22p63s23p63d64s2
(2)M原子的最外层电子数为多少?
2
(3)M元素在周期表中的位置。
第四周期Ⅷ族
随堂检测
3、仔细观察下图,回答下列问题:
(1)B的原子结构示意图为________,B元素位于元素周期表的第_____周期______族。
二
ⅢA
(3)根据周期律知识,硼酸酸性比碳酸____,理由是__________________。
(4)根据Mg在空气中的燃烧情况,Li在空气中燃烧生成的产物为_____________(用化学式表示)。
弱
硼的非金属性比碳弱
Li2O、Li3N
(2)铍的最高价氧化物的水化物是______(填“酸性”“碱性”或“两性”)化合物,证明这一结论的有关离子方程式是___________________________________________
_______________________________________________________。
两性
Be(OH)2+2H+=Be2++2H2O
Be(OH)2+2OH-=BeO22-+ 2H2O
随堂检测
4、下列对元素周期表的认识正确的是( )
A、有9行7个周期
B、有16列16个族
C、有三个短周期四个长周期
D、非金属元素存在于主族与副族中
C
5、下列叙述中正确的是( )
A、除0族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B、除短周期外,其他周期均有18种元素
C、副族元素中没有非金属元素
D、碱金属元素是指第ⅠA族的所有元素
C
随堂检测
