课题1 常见的酸和碱(常见的酸)(课件97页)
文档属性
| 名称 | 课题1 常见的酸和碱(常见的酸)(课件97页) |  | |
| 格式 | zip | ||
| 文件大小 | 18.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-09 16:56:06 | ||
图片预览










文档简介
(共97张PPT)
第十单元 酸与碱
课题1:常见的酸与碱
学习目标
3.掌握盐酸的组成、物理性质和用途。
4.掌握硫酸的组成、物理性质和用途。
柠檬
山楂
酸桔子
生活中
“尝起来酸酸的”
酸
1.生活中的酸有哪些?
“酸”一词从有酸味的酒而来。最早,在制酒的时候,有时把比较珍贵的酒放在窖中保存,在微生物的作用下,产生了酸。
生活中的酸有:食醋有酸味、食醋中的醋酸(CH3COOH);水果有酸味、水果中有果酸,如杨梅很酸——望梅止渴、苹果中有苹果酸、柠檬、柑桔等水果中有柠檬酸等。
2.实验室常见的酸有盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、还有碳酸(H2CO3)、醋酸(CH3COOH)、磷酸(H3PO4)等。
从名称上看它们最后一个字都是“酸”,从结构上看都含有氢元素(H)。
“摸起来滑滑的”
生活中
碱
从名称上看都叫“氢氧化某”;从结构上看都含有氢氧根(OH)
3.生活中的碱有哪些?
生活中的碱有:石灰水中有氢氧化钙,炉具清洁剂中含有氢氧化钠,它们都是碱。吃的皮蛋中也有碱。
“碱”一词在阿拉伯语中表示灰。人们将草木灰放到水中,利用灰汁洗浴、印染等。
4.常见的碱有氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氢氧化钾(KOH)、氢氧化铜[Cu(OH)2]、氨水(NH3·H2O)等。
Ca(OH)2
NaOH
NH3·H2O
如何区分酸和碱两类物质呢?
知识回顾
氨水能使无色酚酞变红色
碳酸能使紫色石蕊变红色
酸碱指示剂
简称:指示剂
酸碱指示剂
简称:指示剂
无色酚酞
紫石色蕊
一、酸、碱与指示剂作用
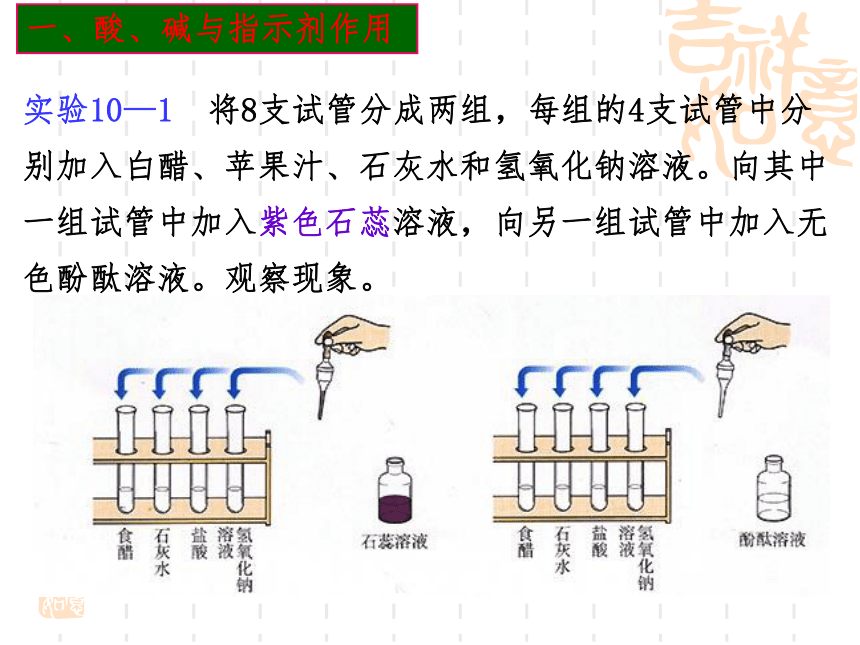
实验10—1 将8支试管分成两组,每组的4支试管中分别加入白醋、苹果汁、石灰水和氢氧化钠溶液。向其中一组试管中加入紫色石蕊溶液,向另一组试管中加入无色酚酞溶液。观察现象。
紫色石蕊
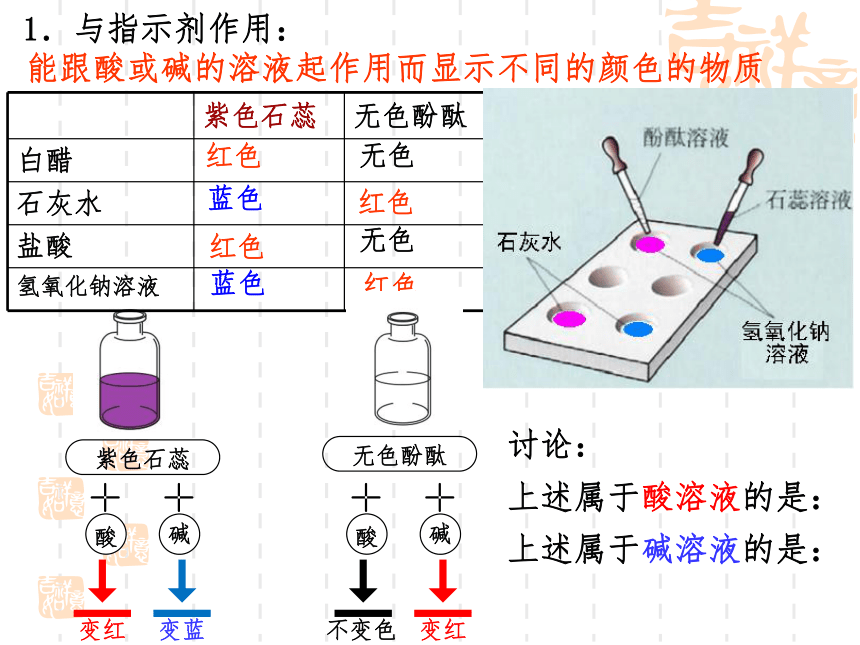
1.与指示剂作用:
紫色石蕊 无色酚酞
白醋
石灰水
盐酸
氢氧化钠溶液
能跟酸或碱的溶液起作用而显示不同的颜色的物质
红色
无色
红色
无色
蓝色
蓝色
红色
红色
无色酚酞
变红
变蓝
酸
碱
不变色
变红
酸
碱
讨论:
上述属于酸溶液的是:
上述属于碱溶液的是:
酸、碱与指示剂的作用
1.酸和碱与指示剂反应,从而使指示剂显示不同的颜色,因此是化学变化。
酸溶液一定是酸性溶液,酸性溶液不一定是酸溶液,
碱溶液一定是碱性溶液,碱性溶液不一定是碱溶液,
某些盐溶液也可以呈酸性或碱性,从而使指示剂变色。
2.指示剂颜色的变化,只能说明溶液显酸性还是碱性,不能说明该溶液就是酸或碱。
注意:
资料卡片
酸碱指示剂的发现
英国科学家波义耳在一次实验中不
慎将浓盐酸溅到一束紫罗兰花的花瓣上,
喜爱花的他马上进行冲洗,一会儿却发
现紫色的花瓣变红了。惊奇的他没有放
过这一偶然的发现,而是进行了进一步的实验和思考。结果发现,许多种花瓣的浸出液遇到酸性溶液或碱性溶液都能变色,其中变色效果最好的是地衣类生物——石蕊,这就是最早使用的酸碱指示剂。之后,人们从地衣类生物中提取蓝色粉末状的石蕊色素,制成了酸碱指示剂。
取几种植物的花瓣或果实(如牵牛花、月季花等),分别在研钵中捣烂,加入酒精(乙醇与水的体积比为1:1)浸泡;
自制酸碱指示剂
活动·探究
月季花
紫甘蓝
牵牛花
步骤一:
将植物的花瓣或果实放在研钵中捣烂
加入酒精
浸泡2~3分钟
步骤二:
用纱布将浸泡出的汁液过滤或挤出,得到指示剂;
步骤三:
试验指示剂在下表内4种溶液中的颜色变化。
将研钵中的物质转移到
套有纱布的烧杯中
用纱布将浸泡出的汁液
挤到烧杯中
植物花朵的酒精浸出液在酸碱溶液中的变色情况
思考:为什么上述汁液可以作为指示剂?
因为在酸、碱溶液里呈现不同的颜色。
指示剂 (汁液) 在不同溶液中的颜色变化 白醋 石灰水 盐酸 氢氧化钠溶液
牵牛花
月季花
紫甘蓝
红色
蓝色
草绿色
绿色
黄色
红色
红色
红色
红色
红色
蓝色
草绿色
检验溶液酸碱性的方法
① 取样
② 滴加指示剂
③ 观察现象
④ 得出结论
取少量该溶液于试管中,滴入几滴无色酚酞试液,若溶液呈红色,则该溶液为 。
取少量溶液于试管中,滴入几滴紫色石蕊试液,若溶液呈红色,则该溶液为 。
取少量该溶液于试管中,滴入几滴紫色石蕊试液,若溶液呈蓝色,则该溶液为 。
酸性溶液
碱性溶液
碱性溶液
2.滴入酚酞溶液无明显变化的溶液,若滴入紫色石蕊溶液,
下列说法正确的是( )
A. 一定显红色 B. 一定显蓝色 C. 一定显紫色 D. 无法确定
D
3.能使紫色石蕊溶液变蓝的溶液,它能使无色酚酞溶液 ( )
A.变红色 B.变蓝色 C.呈无色 D.变紫色
A
4.下列说法不正确的是 ( )
A.有一种溶液能使无色酚酞溶液变红,则该溶液呈碱性
B.有一种溶液能使紫色石蕊溶液变蓝,则该溶液呈碱性
C.有一种溶液不能使无色酚酞溶液变色,则该溶液呈酸性
D.有一种溶液能使紫色石蕊溶液变红,则该溶液呈酸性
C
1.下列方法能把稀盐酸、蒸馏水、石灰水一次区别开来的是( )
A.看颜色 B.闻气味 C.滴加酚酞试液 D.滴加石蕊试液
D
4. 某些植物的花汁可作为酸碱指示剂。取三种花汁用酒精、稀酸溶液、稀碱溶液检验,颜色如下表。请回答下列问题。
花的 种类 花汁在酒精 (中性)中的颜色 花汁在稀酸 溶液中的颜色 花汁在稀碱
溶液中的颜色
玫瑰花 粉红 粉红 绿
万寿菊花 黄 黄 黄
大红花 粉红 橙 绿
(1)为检验生活中食盐水、苹果汁、汽水、石灰水四种物质的酸碱性,应选择_______花汁,不选用其他花汁的原因是_______________________________________________________
被检验物质 食盐水 苹果汁 汽水 石灰水
所显颜色
大红花
粉红
橙
橙
绿
(2)取所选花汁少许分别滴入上述四种物质中,请将所显颜色填入下表中。
玫瑰花花汁鉴别不出酸性和中性溶液,万寿菊花花汁不能鉴别出酸性、碱性和中性溶液。
探究一:浓硫酸和浓盐酸的物理性质
观察浓硫酸和浓盐酸的状态、颜色,比较它们与同体积水的质量大小,打开瓶塞,观察发生的现象;闻一闻是否有气味?
注意:闻气体的方法
二、常见的酸
盐酸(HCl) 硫酸(H2SO4)
颜色、状态
打开试剂瓶后的现象
挥发性
密度 常用浓盐酸(37%~38%)1.19g/cm3 常用浓硫酸(98%)1.84g/cm3
无色、有刺激性
气味的液体
无色、黏稠、油状液体
瓶口有白雾出现
瓶口无明显现象
易挥发
难挥发
1、物理性质
为什么浓盐酸瓶口处会出现白雾?
浓盐酸具有很强的挥发性,挥发出来的HCl气体溶解在空气中的水蒸气中,形成盐酸小液滴。
浓盐酸需要密封保存,要密封保存,否则会变稀
根据你查阅的资料,说一说盐酸的用途。
稀盐酸用于除铁锈
稀盐酸用于制造药物
根据你查阅的资料,说一说硫酸的用途。
化肥
染料
农药
农药
炸药
用 途
盐 酸 HCl 重要化工产品。用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等;人体胃液中有盐酸,可帮助消化。
硫 酸 H2SO4 重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属表面除锈等。
浓硫酸有吸水性,在实验室中常用它做干燥剂。
2、用途
交流讨论
1.浓硫酸具有吸水性,可用来作什么用途?
不能干燥碱性气体NH3
气体的干燥剂
酸性气体或中性气体
(H2、O2、N2 、CO2)
气流方向为
“长进短出”
浓硫酸
2.浓盐酸和浓硫酸露置在空气中一段时间后,下列物理量的变化情况怎样的呢?其原理是什么?(不考虑温度变化和水的蒸发)
溶质质量 溶剂质量 溶液质量 溶质质量分数
浓盐酸
浓硫酸
变小
不变
变小
变小
不变
变大
变大
变小
为什么实验室制H2用稀硫酸,而制CO2用稀盐酸?
盐酸具有挥发性,会使收集到的气体不纯。因此制H2用稀硫酸。
稀硫酸与大理石反应会生成微溶的硫酸钙,因此制CO2用稀盐酸。
实 验 放置一会儿后的现象
用玻璃棒蘸 浓硫酸在纸上写字
用小木棍蘸 少量浓硫酸
将浓硫酸滴到 一小块布上
纸上显出黑色字迹
蘸有浓硫酸的部位变黑
滴有浓硫酸的部位
变黑甚至烧成洞
3、浓硫酸的特性:腐蚀性
浓硫酸有强烈的腐蚀性,它能夺取纸张、木材、布料、皮肤(都由含碳、氢、氧等元素的化合物)里的水分,生成黑色的炭。 浓硫酸将这些物质中的氢、氧元素,按照水的组成比(2:1)脱去,这种作用通常叫做脱水作用。
浓硫酸的腐蚀性(脱水性)是化学性质。
化学变化
4、稀释浓硫酸
把浓硫酸沿着烧杯壁缓缓注入盛有水的烧杯中,并用玻璃棒不断搅拌。并用手轻轻触碰烧杯外壁,有什么感觉?
实验10-4
手的感觉
分析
发热或烫
浓硫酸溶于水放出大量的热
玻璃棒的作用:
搅拌,散热
注意!
在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌。切不可将水倒进浓硫酸里。
将水注入浓硫酸中时,由于水的密度较小,水会浮在浓硫酸上面,溶解时放出大量的热使水立刻沸腾,使硫酸液滴四周飞溅。
如果不慎将浓硫酸沾到皮肤上,应该立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液。
Na2CO3 + H2SO4 == Na2SO4 + H2O + CO2 ↑
课堂精练
1、下列物质的性质属于物理性质的是( )
A.浓盐酸的挥发性 B. 浓硫酸的腐蚀性
C.浓硫酸的酸性 D. 碳酸的不稳定性
2、下列有关酸的说法错误的是( )
A. 盐酸是混合物
B. 盐酸和硫酸均可用于除铁锈
C. 人体胃液中的酸是盐酸
D. 打开盛有浓盐酸的试剂瓶的瓶盖,瓶口有白烟产生
A
D
3、化学实验过程要规范操作。下列做法正确的是( )
A.把鼻孔凑到瓶口闻盐酸的气味
B. 药液溅入眼睛,立即用水冲洗,并用手揉搓
C.浓硫酸沾到皮肤上,立即用大量水冲洗,再涂上3%- 5%的碳酸氢钠溶液
D. 稀释浓硫酸时,一定要把水注入浓硫酸中,并用玻璃棒不断搅拌
C
4、实验室的浓硫酸、浓盐酸若敞口放置一段时间后,对于两溶液的共同变化图象描述正确的是( )
A.
B.
C.
D.
C
浓盐酸 浓硫酸
颜色 状态 “纯净”:无色液体 工业用盐酸:黄色(含Fe3+) 无色粘稠、油状液体 密度比水大
气 味 有刺激性气味 无
特 性 挥发性(挥发出氯化氢气体)(敞口置于空气中,瓶口有白雾) 吸水性 、
脱水性(腐蚀性) 溶解时放热
用 途 ①、金属除锈 ②、制造药物 ③、人体胃中含有少量盐酸,助消化 ①、金属除锈
②、浓硫酸作干燥剂
③、生产化肥、精炼石油
浓硫酸的特性
吸水性(干燥剂:O2、H2、N2、CO2、CO)(NH3不行)
强烈的腐蚀性
脱水性
强氧化性
浓盐酸敞口放置
浓硫酸敞口放置
溶质质量
溶液质量
溶质的质量分数
减小
减小
减小
减小
增大
不变
1.酸与酸碱指示剂的反应:
点滴板
紫色石蕊试液 无色酚酞试液
稀盐酸
稀硫酸
变红
变红
不变色(无色)
不变色(无色)
结论:
酸溶液能使紫色石蕊试液变红;
无色酚酞试液不变色(仍为无色)
三、酸(稀)的化学性质
写出下列化学方程式:
与稀盐酸的反应 与稀硫酸的反应
镁
锌
铁
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑
Fe+H2SO4=FeSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
Mg+H2SO4=MgSO4+H2↑
结论: 酸能与氢前金属反应制取氢气
金属 + 酸→盐 + H2↑ (置换反应)
2.酸与金属单质的反应:
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al + 3H2SO4 = Al2(SO4 )3+ 3H2↑
写出铝与酸的反应方程式:
结论:镁、铝、锌、铁等活动性较强的金属都能与稀硫酸、盐酸发生置换反应,放出氢气,同时生成一种称为盐的化合物。
酸与金属反应
补充:
盐:
组成里含有金属离子和酸根离子的化合物。如:NaCl、CuSO4、CaCO3、KClO3、KMnO4
问题:稀硫酸和稀盐酸都可用于金属表面除锈,铁锈的主要成分是什么?其反应的原理又是什么?请分别写出稀硫酸和稀盐酸与铁锈的主要成分反应的化学方程式。
3.酸与金属氧化物的反应
现象 化学方程式
氧化铁+稀盐酸
氧化铁+稀硫酸
氧化铜+稀盐酸
氧化铜+稀硫酸
铁钉表面的铁锈被除去,溶液变为黄色
黑色粉末逐渐溶解,溶液由无色变为蓝色
CuO + H2SO4 = CuSO4 + H2O
CuO + 2HCl = CuCl2 + H2O
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
结论: 酸能与金属氧化物反应
金属氧化物 + 酸→盐 + 水
酸 +碱→盐 + 水
中和反应:
4.酸与碱的反应:
稀盐酸 稀硫酸
氢氧化钠
氢氧化钙
NaOH+HCl==NaCl+H2O
2NaOH+H2SO4==Na2SO4+2H2O
Ca(OH)2+2HCl==CaCl2+2H2O
Ca(OH)2+H2SO4==CaSO4+2H2O
酸与碱反应,生成盐和水
想一想:上述物质的反应,是怎样发生的?
NaOH + HCl
NaOH+HCl
+
Na H
OH
Cl
H2O
A
+
C
=
B
A
B
D
C
D
+
1、复分解反应:由两种化合物互相交换成分生成另外两种化合物的反应叫做。(属于基本反应类型)
2、通式:
3、特征:双交换,价不变
酸 +碱→盐 + 水
(属于复分解反应)
稀盐酸 稀硫酸
氢氧化铜
氢氧化铁
Fe(OH)3+3HCl=FeCl3+3H2O
Cu(OH)2+H2SO4=CuSO4+H2O
Fe(OH)3+H2SO4=Fe2(SO4)3+3H2O
Cu(OH)2+2HCl=CuCl2+H2O
CuO + H2SO4 = CuSO4 + H2O
CuO + 2HCl = CuCl2 + H2O
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
金属氧化物 + 酸→盐 + 水(复分解反应)
酸与金属氧化物反应属于什么基本反应类型?
根据上面的化学方程式特点,请你写出氧化铝与盐酸或硫酸反应的化学方程式。
结论:酸能与碱、金属氧化物反应有水生成
Al2O3+6HCl=2AlCl3+3H2O
Al2O3+3H2SO4=Al2(SO4)3+3H2O
(1)、在试管中放入少量CaCO3粉末,再加入1mL稀盐酸(或稀硫酸)。
(2)、在试管中加入0.5mLNa2CO3溶液,再加入1mL稀盐酸(或稀硫酸)。
【实验】
CaCO3+2HCl
=CaCl2+H2CO3
酸 + 盐 → 新酸 + 新盐(复分解反应)
=2NaCl+H2O+CO2↑
=CaCl2+H2O+CO2↑
=Na2SO4+H2O+CO2↑
=CaSO4+H2O+CO2↑
Na2CO3+2HCl
=2NaCl+H2CO3
Na2CO3+H2SO4
=Na2SO4+H2CO3
CaCO3+H2SO4
=CaSO4+H2CO3
酸 + 碳酸盐 → 新盐 + 水 + 二氧化碳
5.酸与盐的反应:
与CaCO3反应 与Na2CO3反应
稀盐酸
稀硫酸
硝酸银和稀盐酸反应
补充实验
氯化钡和稀硫酸反应
AgNO3 + HCl = AgCl ↓+ HNO3
BaCl2 + H2SO4 = BaSO4↓+ 2HCl
指示剂
金属
金属氧化物
碱
盐
小结:酸的化学性质
思考:为何盐酸、硫酸等酸具有相似的化学性质?
酸
1.下列物质中,能直接用金属与盐酸反应制得的是( )
A
FeCl3
B
CuCl2
C
AgCl
D
ZnCl2
2.蚂蚁能分泌出蚁酸。蚁酸的化学性质与盐酸相似,能腐蚀很多物质。 下列最不容易被蚁酸腐蚀的是()
A
镀锌水管
B
铜制塑像
C
大理石栏杆
D
铝合金门窗
D
B
(2)清洗水垢时盐酸的用量不能过多,否则会损坏水壶,原因是:
,反应的化学方程式
.
3.家用铝制电热水壶,长期使用后会在壶底结一层水垢(主要成分是CaCO3)
(1)用适量的稀盐酸可以除去水垢,反应的化学方程式为 .
盐酸先与铝表面的氧化膜反应,后与内部的铝反应
CaCO3+2HCl= CaCl2+H2O+CO2↑
Al2O3+6HCl= 2AlCl3+3H2O
2Al+6HCl= 2AlCl3+3H2↑
4.如图是稀硫酸与不同物质之间发生化学反应的颜色变化
红色溶液
稀硫酸
蓝色溶液
浅绿色溶液
② 单质
③
氧化物
①
指示剂
(1)①处所使用的指示剂是 ;
(2)请你在编号②③处各填入一种物质。
②是 ;③是 ;
(3)反应②涉及的基本反应类型是 ;
(4)如果想要得到黄色溶液,那么有稀硫酸参与反应的
方程式 ;
紫色石蕊溶液
铁
氧化铜
置换反应
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
5.学习完酸的化学性质,
小凯构建了如图所示的
知识网络图。请回答:
(1)溶液X是一种酸,
试剂A的名称是 。
(2)若X是稀硫酸、B是氧化物,则B的化学式为 。
紫色石蕊溶液
Fe2O3
(3)若X是稀盐酸、C是单质,则C的名称为 。
(4)若X是稀盐酸、D是碳酸钙,则X与D反应的化学方程式为 _________________________________。
2HCl+CaCO3 CaCl2+H2O+CO2↑
铁
第十单元 酸与碱
课题1:常见的酸与碱(碱)
学习目标
1.掌握氢氧化钠的组成、俗称、物理性质和用途。
2.掌握氢氧化钙的组成、俗称、物理性质和用途
二、常见的碱
Ca(OH)2
NaOH
NH3·H2O
1.几种常见的碱
⑴、氢氧化钠(NaOH)
实验 现象 分析
观察NaOH的颜色和状态
将NaOH放在表面皿上, 放置一会儿
将NaOH放入盛有少量水的试里,并用手轻轻触碰试管外壁
白色固体
表面潮湿
逐渐溶解
试管发烫
容易吸收空气中的水分
溶于水时放出大量的热
实验:用镊子夹取3小块NaOH分别进行实验(切勿用手拿)。
NaOH曝露在空气中容易吸收水分,表面潮湿并逐渐溶解,这种现象叫做潮解。(物理性质)
氢氧化钠是白色固体,易溶于水,并放出大量热。
氢氧化钠在空气中易潮解(曝露在空气中容易吸收水分,表面潮湿并逐渐溶解)——可作某些气体(O2、N2、CO等)的干燥剂。
②、腐蚀性:
氢氧化钠有强烈的腐蚀性,
所以,它的俗名叫做苛性钠、火碱或烧碱。
如果不慎将碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液。
①、物理性质:
注意!在使用氢氧化钠时必须十分小心,防止眼睛、皮肤、衣服被它腐蚀。实验时最好戴防护眼镜。
②.氢氧化钠的保存方法
氢氧化钠的保存方法:
1、氢氧化钠固体易吸水潮解
2、与空气中二氧化碳反应而变质
2NaOH+CO2=Na2CO3+H2O
密封保存
原因:
肥 皂
石 油
造 纸
纺 织
印 染
含NaOH
③、用途:
氢氧化钠是一种重要的化工原料,广泛应用于肥皂、石油、造纸、纺织和印染等工业。氢氧化钠能与油脂反应,在生活中可以用来去除油污,如炉具清洁剂中就含有氢氧化钠。
讨论交流
NaOH固体、浓硫酸是溶解放热;生石灰是与水反应放热 。
汽油能溶解油污;洗涤剂是乳化油污;NaOH是使油污分解。
1、NaOH固体、浓硫酸和生石灰中加水都放出大量的热,
这三种放热有什么区别?
2、汽油、洗涤剂、 NaOH都能去油污。
其原理有什么不同?
2、氢氧化钙 [ Ca(OH)2 ]
在检验二氧化碳时用到的石灰水就是氢氧化钙的水溶液。
生石灰 CaO
CaO + H2O Ca(OH)2
生石灰与水反应得到氢氧化钙。
产生大量的热
注意安全
氢氧化钙
俗称熟石灰或
消石灰。
氢氧化钙对皮肤、衣服等也有腐蚀作用。
取一小药匙氢氧化钙,观察它的颜色和状态,然后放入小烧杯中,加入约30 mL水,用玻璃棒搅拌,观察氢氧化钙在水中的溶解情况。
现象
颜色、状态
在水中的溶解情况
向澄清石灰水通CO2
白色粉末状固体
部分溶解,液体浑浊
产生白色浑浊
实验10-6 氢氧化钙的性质
微溶于水
水溶液俗称石灰水,当存在较多未溶解的
熟石灰时,称为石灰乳或石灰浆
氢氧化钙的用途:
配制农药波尔多液
石灰水粉刷墙壁
在树木上涂刷石灰浆,保护树木
改良酸性土壤
用熟石灰与沙子混合来砌砖
制取氢氧化钠:
Ca(OH)2 + Na2CO3==2NaOH + CaCO3↓
氢氧化钙的生成
CaO + H2O == Ca(OH)2
CaCO3 === CaO + CO2↑
高温
Ca(OH)2+ CO2= CaCO3↓ + H2O
石灰吟
[明] 于谦
石灰石的主要成分
生石灰
熟石灰
千锤万凿出深山,
烈火焚烧若等闲。
粉身碎骨全不怕,
要留清白在人间。
3、几种常见的碱
常用的碱有:氢氧化钠、氢氧化钙、
氢氧化钾 [KOH]、氨水[NH3·H2O] 等。
Mg(OH)2 Al(OH)3 Cu(OH)2 Fe(OH)2 Fe(OH)3
蓝色
红褐色
可溶性碱:
NaOH KOH Ba(OH)2 NH3·H2O
微溶性碱:
Ca(OH)2
难溶性碱:
实验内容 实验现象 烧碱、消石灰、氨水物理性质的比较 氢氧化钠 氢氧化钙 氨水
颜色 白色 白色 无色
状态 片状固体 粉末状固体 液体
气味 无味 无味 有气味
溶解性 易溶 微溶 易溶
俗名 烧碱、火碱 熟石灰、消石灰
烧碱、氨水露置在空气中发生的变化 烧碱露置在空气中,表面出现潮湿,这个现象称为潮解。同时氢氧化钠也会吸收空气中二氧化碳而发生化学变化,生成碳酸钠。 氨水露置在空气中,会使其溶质质量分数变。 烧碱的溶解情况 放出大量的热,水溶液具有滑腻感。 4、归纳与小结
干燥剂
种类 浓硫酸 (H2SO4) 铁粉 (Fe) 氧化钙 (CaO) 氢氧化钠
(NaOH)
原理 吸水,物理变化 铁生锈,既吸水又吸收氧气,化学变化 CaO+H2O=Ca(OH)2 化学变化 吸水,物理变化
注意事项 不能干燥NH3 等 双吸剂,常用食品干燥剂、还能使食品保鲜。 不能干燥CO2、SO2、HCl等,常用食品干燥剂。 不能干燥CO2、SO2 、HCl等
液体干燥剂
固体干燥剂
装置图
干燥剂
可干燥物
不可干燥物
浓硫酸
固体氯化钙、氧化钙、氢氧化钠、碱石灰
中性或酸性气体
大多数气体
中性或碱性气体
NH3
NH3
HCl、SO2、CO2
常见干燥剂及使用装置
巩固: (课本第4题)
1.在某些食品的包装袋内,有一个装有白色颗粒状固体的小纸袋,上面写着“干燥剂,主要成分为生石灰”。为什么生石灰能做干燥剂?如果将小纸袋拿出来放在空气中,经过一段时间后,会发现纸袋内的白色颗粒粘在一起成为块状。这是为什么?试写出有关反应的化学方程式。
因为生石灰能与水发生化合反应生成氢氧化钙,
CaO + H2O === Ca(OH)2
氢氧化钙又能与空气中的二氧化碳反应生成碳酸钙和水。
Ca(OH)2+CO2==CaCO3↓+H2O
蓝色
蓝色
红色
红色
⑴、碱与指示剂反应:
滴入紫色 石蕊溶液后 滴入无色
酚酞溶液后
氢氧化钠溶液
氢氧化钙溶液
碱溶液能使紫色石蕊溶液变蓝色;
能使无色酚酞溶液变红色。
四、碱的化学性质
Ca(OH)2+CO2==CaCO3↓+H2O
①、回忆:二氧化碳使澄清石灰水变浑浊
氢氧化钙能与空气中的二氧化碳反应,生成坚硬的碳酸钙。将氢氧化钙粘土和沙子混凝,用来做建筑材料,就是利用氢氧化钙的这一性质。
(2)、碱与某些非金属氧化物反应
Ca(OH)2溶液
②、氢氧化钠在空气中不仅吸收水分而潮解,还会与空气中的CO2发生反应而变质:
NaOH与CO2发生了反应没有现象,请你设计实验证明NaOH与CO2反应了,而不是CO2与H2O反应。
NaOH溶液
NaOH
H2O
软塑料瓶
软塑料瓶
甲
乙
方案一
反应前的溶液
稀盐酸
反应后的溶液
稀盐酸
有气泡产生
方案二
水
鼓起程度大
2NaOH+CO2==Na2CO3+H2O
所以,氢氧化钠必须密封保存。
如:2NaOH + CO2 == Na2CO3 + H2O;
Ca(OH)2 + SO2 == CaSO3↓ + H2O;
讨论:上面两个反应有什么共同之处?三氧化硫、二氧化硫与碱的反应与上面的两个反应类似,试写出三氧化硫与氢氧化钠反应的化学方程式:
_________________________________
2NaOH+SO3==Na2SO4+H2O
与某些非金属氧化物反应
碱 + 非金属氧化物 → 盐 + 水
化学方程式
CO2 + 石灰水
CO2+ NaOH溶液
SO3+ NaOH溶液
Ca(OH)2 + CO2 = CaCO3 + 2H2O
2NaOH + CO2 = Na2CO3 + H2O
2NaOH + SO3 = Na2SO4 + H2O
书写规律
讨论交流
实验室检验CO2应选择什么试剂?除去CO2应选择什么试剂?为什么?
检验CO2应选择澄清石灰水,而不选择NaOH溶液。
因为CO2与Ca(OH)2反应会产生白色沉淀,而CO2与NaOH反应无明显现象。
除去CO2应选择NaOH溶液,而不选择Ca(OH)2溶液。因为
Ca(OH)2微溶于水,溶液浓度小,会导致吸收不彻底。
实验探究3
试管中加少量氢氧化钙溶液,滴加两滴酚酞试液,然后逐滴加入稀盐酸;
试管中加少量氢氧化钠溶液,滴加两滴酚酞试液,然后逐滴加入稀硫酸。
现象
溶液由红色逐渐变为无色。
如:NaOH + HCl == NaCl + H2O;
Ca(OH)2 + H2SO4 == CaSO4 + 2H2O;
(3)、与酸反应(中和反应)
碱 + 酸 → 盐 + 水(复分解反应)
CuSO4溶液
?
滴加NaOH
FeCl3溶液
?
滴加NaOH
?
滴加Ca(OH)2
Na2CO3溶液
实验探究4
现象
蓝色絮状沉淀
红褐色沉淀
白色沉淀
FeCl3 + 3NaOH == Fe(OH)3↓+ Na2SO4
CuSO4 + 2NaOH == Cu(OH)2↓+ Na2SO4
Ca(OH)2 + Na2CO3==2NaOH + CaCO3↓
Ca(OH)2 + CuSO4 =Cu(OH)2↓+ CaSO4
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
Ca(OH)2 + Na2CO3==2NaOH + CaCO3↓
(4)、能与某些盐反应
碱 + 盐→ 新碱 + 新盐(复分解反应)
课堂小结
1.氢氧化钠:
俗名:火碱、烧碱、苛性钠。白色固体,易溶于水,溶于水放热。吸水性(潮解)、强腐蚀性
2.氢氧化钙
俗名:熟石灰、消石灰。白色固体,微溶于水。
指示剂
非金属氧化物
酸
盐
3.碱的化学性质
思考:为何氢氧化钠、氢氧化钙等酸具有相似的化学性质?
碱
1. 下列关于氢氧化钠的描述中不正确是( )
A.可用于改良酸性土壤
A
C.能去除油污,可用作炉具清洁剂
2. 下列关于氢氧化钙的描述中错误的是( )
A.氢氧化钙与硫酸铜等可配制成具有杀菌作用的波尔多液
C.氢氧化钙在农业上可改良酸性土壤
B.易溶于水,溶解时放出大量的热
D.对皮肤有强烈的腐蚀作用
B.氢氧化钙俗称熟石灰或消石灰
D.氢氧化钙易溶于水
D
课堂精练
3.将空气依次通过盛固体氢氧化钠的干燥管、灼热的铜网、盛浓硫酸的洗气瓶,并充分接触和反应,最终剩余的气体是( )
A.O2、N2
C
B.CO2、N2
C.稀有气体、N2
D.稀有气体和水蒸气
4.下列各组名称中,称呼的是同一种物质的是( )
A.氢氧化钠、苛性钠、烧碱、火碱
B.碳酸钙、石灰石、大理石、生石灰
C.氢氧化钙、消石灰、熟石灰、石灰石
D.氧化钙、生石灰、石灰石、消石灰
A
5.10%的氢氧化钠溶液可用来作叶脉书签,这是利用了氢氧化钠 性质中的( )
A.易溶于水 B. 易潮解 C.腐蚀性 D. 溶于水放热
6.下列说法错误的是( )
A.氢氧化钠除油污是因为它可与油污反应
B. 氢氧化钠可做某些气体的干燥剂,是因为它具有吸水性
C.树木上刷石灰浆可以防止害虫生卵
D. 实验室称量氢氧化钠时应放在纸上称量
C
D
7.某同学为了区别氢氧化钠溶液和澄清石灰水,设计了如下图所示的四组实验方案,其中能达到目的的是( )
A. B. C. D.
C
盐酸
酚酞
石蕊
二氧化碳
酸碱溶液中的粒子
酸溶液为什么具有一些相似的化学性质 碱溶液为什么也具有一些相似的化学性质
物质 盐酸 硫酸 NaOH溶液 Ca(OH)2溶液 蒸馏水 乙醇
导电性
酸溶液、碱溶液为什么能导电?
而蒸馏水、乙醇为什么不导电?
×
×
物质 硫酸铜 氯化钠
导电性
能导电的物质中一定存在自由移动的带电粒子。
金属能导电
金属中有自由移动的电子
酸、碱、盐溶液能导电
溶液中存在自由移动的带电粒子
离子
酸碱盐
溶于水
溶液能导电
自由移动的离子
电离
H2SO4
SO42-
SO42-
H2SO4
H+和Cl-
H+和SO42-
分子中没有自由移动的离子
能够自由移动的离子
酸在溶液中会发生电离:
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
酸→ H+ + 酸根离子
四、酸碱溶液中的粒子
酸:电离出来的阳离子全部为H+的物质。
在不同的酸溶液中都含有相同的H+,所以,酸有一些相似的性质。
能够自由移动的离子
Ca(OH)2
Ca(OH)2
Ca2+
Ca2+
Na+和OH-
Ca2+和OH-
固体中没有自由移动的离子
在不同的碱溶液中都含有相同的OH—,所以碱也有一些相似的性质。
NaOH = Na+ + OH-
Ca(OH)2 = Ca2+ + 2OH-
碱在溶液中会发生电离:
碱→金属离子+ OH-
碱:电离出来的阴离子全部为OH—的物质。
能够自由移动的离子
固体中没有自由移动的离子
Na+和Cl-
Cu2+和SO42-
NaCl === Na+ + Cl-
CuSO4=== + SO42—
Cu2+
盐在溶液中会发生电离:
盐→金属阳离子+酸根阴离子
盐:电离生成金属离子(包括铵根离子( ))和酸根离子的化合物。
NH4+
物理性质
化学性质
常见的碱、溶液导电性原因
氢氧化钠
氢氧化钙
物理性质
化学性质
碱的通性
能与酸碱指示剂作用
能与某些非金属氧化物反应
溶液导电的原因
溶液中有自由移动的离子
复习巩固:1.蒸馏水______(填“能”或“不能”,以下同)导电;乙醇______导电; 氯化钠溶液_____导电;氢氧化钠溶液______导电;有些溶液能导电是因为这些溶液中存在有自由移动的__________。
2.下列检验物质导电性的实验中,不亮的灯泡是 ( )
不能
不能
能
能
离子
A
3.酸溶液具有相似的化学性质是因为酸在水溶液中能解离出________和__________,即在不同的酸溶液中都含有相同的_________;
碱溶液具有相似的化学性质是因为碱在水溶液中能解离出_________和___________,即在不同的碱溶液中都含有相同的___________。
氢离子
酸根离子
氢离子
金属离子
氢氧根离子
氢氧根离子
4.酸具有酸的通性的原因是( )
A.酸都能电离出H+ B.酸都含有酸根
C.酸中都含有氢元素 D.酸中都含有氧元素
A
5.氢氧化钠溶液和氢氧化钙溶液具有相似的化学性质,
其本质原因是( )
A 都能与指示剂 作用 B 都能解离出氢氧根离子
C 都能解离出金属阳离子 D 都含有氢元素和氧元素
B
6.将一套如图所示的密闭装置放在天平上,使天平平衡,经过一段时间后出现的情况是( )
A.指针偏左,食盐溶液一定变稀,烧碱潮解
B.指针偏左,食盐溶液一定变浓,烧碱潮解
C.指针偏右,食盐溶液一定变浓,烧碱潮解
D.指针偏右,食盐溶液一定饱和,烧碱潮解
C
7.用一种试剂(或试纸)就能一次性把Ca(OH)2、NaCl、HCl三种溶液区别开,这种试剂(或试纸)是 ( )
A. 酚酞试液
B.紫色石蕊试液
C.水
D.pH试纸
B、D
第十单元 酸与碱
课题1:常见的酸与碱
学习目标
3.掌握盐酸的组成、物理性质和用途。
4.掌握硫酸的组成、物理性质和用途。
柠檬
山楂
酸桔子
生活中
“尝起来酸酸的”
酸
1.生活中的酸有哪些?
“酸”一词从有酸味的酒而来。最早,在制酒的时候,有时把比较珍贵的酒放在窖中保存,在微生物的作用下,产生了酸。
生活中的酸有:食醋有酸味、食醋中的醋酸(CH3COOH);水果有酸味、水果中有果酸,如杨梅很酸——望梅止渴、苹果中有苹果酸、柠檬、柑桔等水果中有柠檬酸等。
2.实验室常见的酸有盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、还有碳酸(H2CO3)、醋酸(CH3COOH)、磷酸(H3PO4)等。
从名称上看它们最后一个字都是“酸”,从结构上看都含有氢元素(H)。
“摸起来滑滑的”
生活中
碱
从名称上看都叫“氢氧化某”;从结构上看都含有氢氧根(OH)
3.生活中的碱有哪些?
生活中的碱有:石灰水中有氢氧化钙,炉具清洁剂中含有氢氧化钠,它们都是碱。吃的皮蛋中也有碱。
“碱”一词在阿拉伯语中表示灰。人们将草木灰放到水中,利用灰汁洗浴、印染等。
4.常见的碱有氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氢氧化钾(KOH)、氢氧化铜[Cu(OH)2]、氨水(NH3·H2O)等。
Ca(OH)2
NaOH
NH3·H2O
如何区分酸和碱两类物质呢?
知识回顾
氨水能使无色酚酞变红色
碳酸能使紫色石蕊变红色
酸碱指示剂
简称:指示剂
酸碱指示剂
简称:指示剂
无色酚酞
紫石色蕊
一、酸、碱与指示剂作用
实验10—1 将8支试管分成两组,每组的4支试管中分别加入白醋、苹果汁、石灰水和氢氧化钠溶液。向其中一组试管中加入紫色石蕊溶液,向另一组试管中加入无色酚酞溶液。观察现象。
紫色石蕊
1.与指示剂作用:
紫色石蕊 无色酚酞
白醋
石灰水
盐酸
氢氧化钠溶液
能跟酸或碱的溶液起作用而显示不同的颜色的物质
红色
无色
红色
无色
蓝色
蓝色
红色
红色
无色酚酞
变红
变蓝
酸
碱
不变色
变红
酸
碱
讨论:
上述属于酸溶液的是:
上述属于碱溶液的是:
酸、碱与指示剂的作用
1.酸和碱与指示剂反应,从而使指示剂显示不同的颜色,因此是化学变化。
酸溶液一定是酸性溶液,酸性溶液不一定是酸溶液,
碱溶液一定是碱性溶液,碱性溶液不一定是碱溶液,
某些盐溶液也可以呈酸性或碱性,从而使指示剂变色。
2.指示剂颜色的变化,只能说明溶液显酸性还是碱性,不能说明该溶液就是酸或碱。
注意:
资料卡片
酸碱指示剂的发现
英国科学家波义耳在一次实验中不
慎将浓盐酸溅到一束紫罗兰花的花瓣上,
喜爱花的他马上进行冲洗,一会儿却发
现紫色的花瓣变红了。惊奇的他没有放
过这一偶然的发现,而是进行了进一步的实验和思考。结果发现,许多种花瓣的浸出液遇到酸性溶液或碱性溶液都能变色,其中变色效果最好的是地衣类生物——石蕊,这就是最早使用的酸碱指示剂。之后,人们从地衣类生物中提取蓝色粉末状的石蕊色素,制成了酸碱指示剂。
取几种植物的花瓣或果实(如牵牛花、月季花等),分别在研钵中捣烂,加入酒精(乙醇与水的体积比为1:1)浸泡;
自制酸碱指示剂
活动·探究
月季花
紫甘蓝
牵牛花
步骤一:
将植物的花瓣或果实放在研钵中捣烂
加入酒精
浸泡2~3分钟
步骤二:
用纱布将浸泡出的汁液过滤或挤出,得到指示剂;
步骤三:
试验指示剂在下表内4种溶液中的颜色变化。
将研钵中的物质转移到
套有纱布的烧杯中
用纱布将浸泡出的汁液
挤到烧杯中
植物花朵的酒精浸出液在酸碱溶液中的变色情况
思考:为什么上述汁液可以作为指示剂?
因为在酸、碱溶液里呈现不同的颜色。
指示剂 (汁液) 在不同溶液中的颜色变化 白醋 石灰水 盐酸 氢氧化钠溶液
牵牛花
月季花
紫甘蓝
红色
蓝色
草绿色
绿色
黄色
红色
红色
红色
红色
红色
蓝色
草绿色
检验溶液酸碱性的方法
① 取样
② 滴加指示剂
③ 观察现象
④ 得出结论
取少量该溶液于试管中,滴入几滴无色酚酞试液,若溶液呈红色,则该溶液为 。
取少量溶液于试管中,滴入几滴紫色石蕊试液,若溶液呈红色,则该溶液为 。
取少量该溶液于试管中,滴入几滴紫色石蕊试液,若溶液呈蓝色,则该溶液为 。
酸性溶液
碱性溶液
碱性溶液
2.滴入酚酞溶液无明显变化的溶液,若滴入紫色石蕊溶液,
下列说法正确的是( )
A. 一定显红色 B. 一定显蓝色 C. 一定显紫色 D. 无法确定
D
3.能使紫色石蕊溶液变蓝的溶液,它能使无色酚酞溶液 ( )
A.变红色 B.变蓝色 C.呈无色 D.变紫色
A
4.下列说法不正确的是 ( )
A.有一种溶液能使无色酚酞溶液变红,则该溶液呈碱性
B.有一种溶液能使紫色石蕊溶液变蓝,则该溶液呈碱性
C.有一种溶液不能使无色酚酞溶液变色,则该溶液呈酸性
D.有一种溶液能使紫色石蕊溶液变红,则该溶液呈酸性
C
1.下列方法能把稀盐酸、蒸馏水、石灰水一次区别开来的是( )
A.看颜色 B.闻气味 C.滴加酚酞试液 D.滴加石蕊试液
D
4. 某些植物的花汁可作为酸碱指示剂。取三种花汁用酒精、稀酸溶液、稀碱溶液检验,颜色如下表。请回答下列问题。
花的 种类 花汁在酒精 (中性)中的颜色 花汁在稀酸 溶液中的颜色 花汁在稀碱
溶液中的颜色
玫瑰花 粉红 粉红 绿
万寿菊花 黄 黄 黄
大红花 粉红 橙 绿
(1)为检验生活中食盐水、苹果汁、汽水、石灰水四种物质的酸碱性,应选择_______花汁,不选用其他花汁的原因是_______________________________________________________
被检验物质 食盐水 苹果汁 汽水 石灰水
所显颜色
大红花
粉红
橙
橙
绿
(2)取所选花汁少许分别滴入上述四种物质中,请将所显颜色填入下表中。
玫瑰花花汁鉴别不出酸性和中性溶液,万寿菊花花汁不能鉴别出酸性、碱性和中性溶液。
探究一:浓硫酸和浓盐酸的物理性质
观察浓硫酸和浓盐酸的状态、颜色,比较它们与同体积水的质量大小,打开瓶塞,观察发生的现象;闻一闻是否有气味?
注意:闻气体的方法
二、常见的酸
盐酸(HCl) 硫酸(H2SO4)
颜色、状态
打开试剂瓶后的现象
挥发性
密度 常用浓盐酸(37%~38%)1.19g/cm3 常用浓硫酸(98%)1.84g/cm3
无色、有刺激性
气味的液体
无色、黏稠、油状液体
瓶口有白雾出现
瓶口无明显现象
易挥发
难挥发
1、物理性质
为什么浓盐酸瓶口处会出现白雾?
浓盐酸具有很强的挥发性,挥发出来的HCl气体溶解在空气中的水蒸气中,形成盐酸小液滴。
浓盐酸需要密封保存,要密封保存,否则会变稀
根据你查阅的资料,说一说盐酸的用途。
稀盐酸用于除铁锈
稀盐酸用于制造药物
根据你查阅的资料,说一说硫酸的用途。
化肥
染料
农药
农药
炸药
用 途
盐 酸 HCl 重要化工产品。用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等;人体胃液中有盐酸,可帮助消化。
硫 酸 H2SO4 重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属表面除锈等。
浓硫酸有吸水性,在实验室中常用它做干燥剂。
2、用途
交流讨论
1.浓硫酸具有吸水性,可用来作什么用途?
不能干燥碱性气体NH3
气体的干燥剂
酸性气体或中性气体
(H2、O2、N2 、CO2)
气流方向为
“长进短出”
浓硫酸
2.浓盐酸和浓硫酸露置在空气中一段时间后,下列物理量的变化情况怎样的呢?其原理是什么?(不考虑温度变化和水的蒸发)
溶质质量 溶剂质量 溶液质量 溶质质量分数
浓盐酸
浓硫酸
变小
不变
变小
变小
不变
变大
变大
变小
为什么实验室制H2用稀硫酸,而制CO2用稀盐酸?
盐酸具有挥发性,会使收集到的气体不纯。因此制H2用稀硫酸。
稀硫酸与大理石反应会生成微溶的硫酸钙,因此制CO2用稀盐酸。
实 验 放置一会儿后的现象
用玻璃棒蘸 浓硫酸在纸上写字
用小木棍蘸 少量浓硫酸
将浓硫酸滴到 一小块布上
纸上显出黑色字迹
蘸有浓硫酸的部位变黑
滴有浓硫酸的部位
变黑甚至烧成洞
3、浓硫酸的特性:腐蚀性
浓硫酸有强烈的腐蚀性,它能夺取纸张、木材、布料、皮肤(都由含碳、氢、氧等元素的化合物)里的水分,生成黑色的炭。 浓硫酸将这些物质中的氢、氧元素,按照水的组成比(2:1)脱去,这种作用通常叫做脱水作用。
浓硫酸的腐蚀性(脱水性)是化学性质。
化学变化
4、稀释浓硫酸
把浓硫酸沿着烧杯壁缓缓注入盛有水的烧杯中,并用玻璃棒不断搅拌。并用手轻轻触碰烧杯外壁,有什么感觉?
实验10-4
手的感觉
分析
发热或烫
浓硫酸溶于水放出大量的热
玻璃棒的作用:
搅拌,散热
注意!
在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌。切不可将水倒进浓硫酸里。
将水注入浓硫酸中时,由于水的密度较小,水会浮在浓硫酸上面,溶解时放出大量的热使水立刻沸腾,使硫酸液滴四周飞溅。
如果不慎将浓硫酸沾到皮肤上,应该立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液。
Na2CO3 + H2SO4 == Na2SO4 + H2O + CO2 ↑
课堂精练
1、下列物质的性质属于物理性质的是( )
A.浓盐酸的挥发性 B. 浓硫酸的腐蚀性
C.浓硫酸的酸性 D. 碳酸的不稳定性
2、下列有关酸的说法错误的是( )
A. 盐酸是混合物
B. 盐酸和硫酸均可用于除铁锈
C. 人体胃液中的酸是盐酸
D. 打开盛有浓盐酸的试剂瓶的瓶盖,瓶口有白烟产生
A
D
3、化学实验过程要规范操作。下列做法正确的是( )
A.把鼻孔凑到瓶口闻盐酸的气味
B. 药液溅入眼睛,立即用水冲洗,并用手揉搓
C.浓硫酸沾到皮肤上,立即用大量水冲洗,再涂上3%- 5%的碳酸氢钠溶液
D. 稀释浓硫酸时,一定要把水注入浓硫酸中,并用玻璃棒不断搅拌
C
4、实验室的浓硫酸、浓盐酸若敞口放置一段时间后,对于两溶液的共同变化图象描述正确的是( )
A.
B.
C.
D.
C
浓盐酸 浓硫酸
颜色 状态 “纯净”:无色液体 工业用盐酸:黄色(含Fe3+) 无色粘稠、油状液体 密度比水大
气 味 有刺激性气味 无
特 性 挥发性(挥发出氯化氢气体)(敞口置于空气中,瓶口有白雾) 吸水性 、
脱水性(腐蚀性) 溶解时放热
用 途 ①、金属除锈 ②、制造药物 ③、人体胃中含有少量盐酸,助消化 ①、金属除锈
②、浓硫酸作干燥剂
③、生产化肥、精炼石油
浓硫酸的特性
吸水性(干燥剂:O2、H2、N2、CO2、CO)(NH3不行)
强烈的腐蚀性
脱水性
强氧化性
浓盐酸敞口放置
浓硫酸敞口放置
溶质质量
溶液质量
溶质的质量分数
减小
减小
减小
减小
增大
不变
1.酸与酸碱指示剂的反应:
点滴板
紫色石蕊试液 无色酚酞试液
稀盐酸
稀硫酸
变红
变红
不变色(无色)
不变色(无色)
结论:
酸溶液能使紫色石蕊试液变红;
无色酚酞试液不变色(仍为无色)
三、酸(稀)的化学性质
写出下列化学方程式:
与稀盐酸的反应 与稀硫酸的反应
镁
锌
铁
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑
Fe+H2SO4=FeSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
Mg+H2SO4=MgSO4+H2↑
结论: 酸能与氢前金属反应制取氢气
金属 + 酸→盐 + H2↑ (置换反应)
2.酸与金属单质的反应:
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al + 3H2SO4 = Al2(SO4 )3+ 3H2↑
写出铝与酸的反应方程式:
结论:镁、铝、锌、铁等活动性较强的金属都能与稀硫酸、盐酸发生置换反应,放出氢气,同时生成一种称为盐的化合物。
酸与金属反应
补充:
盐:
组成里含有金属离子和酸根离子的化合物。如:NaCl、CuSO4、CaCO3、KClO3、KMnO4
问题:稀硫酸和稀盐酸都可用于金属表面除锈,铁锈的主要成分是什么?其反应的原理又是什么?请分别写出稀硫酸和稀盐酸与铁锈的主要成分反应的化学方程式。
3.酸与金属氧化物的反应
现象 化学方程式
氧化铁+稀盐酸
氧化铁+稀硫酸
氧化铜+稀盐酸
氧化铜+稀硫酸
铁钉表面的铁锈被除去,溶液变为黄色
黑色粉末逐渐溶解,溶液由无色变为蓝色
CuO + H2SO4 = CuSO4 + H2O
CuO + 2HCl = CuCl2 + H2O
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
结论: 酸能与金属氧化物反应
金属氧化物 + 酸→盐 + 水
酸 +碱→盐 + 水
中和反应:
4.酸与碱的反应:
稀盐酸 稀硫酸
氢氧化钠
氢氧化钙
NaOH+HCl==NaCl+H2O
2NaOH+H2SO4==Na2SO4+2H2O
Ca(OH)2+2HCl==CaCl2+2H2O
Ca(OH)2+H2SO4==CaSO4+2H2O
酸与碱反应,生成盐和水
想一想:上述物质的反应,是怎样发生的?
NaOH + HCl
NaOH+HCl
+
Na H
OH
Cl
H2O
A
+
C
=
B
A
B
D
C
D
+
1、复分解反应:由两种化合物互相交换成分生成另外两种化合物的反应叫做。(属于基本反应类型)
2、通式:
3、特征:双交换,价不变
酸 +碱→盐 + 水
(属于复分解反应)
稀盐酸 稀硫酸
氢氧化铜
氢氧化铁
Fe(OH)3+3HCl=FeCl3+3H2O
Cu(OH)2+H2SO4=CuSO4+H2O
Fe(OH)3+H2SO4=Fe2(SO4)3+3H2O
Cu(OH)2+2HCl=CuCl2+H2O
CuO + H2SO4 = CuSO4 + H2O
CuO + 2HCl = CuCl2 + H2O
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
金属氧化物 + 酸→盐 + 水(复分解反应)
酸与金属氧化物反应属于什么基本反应类型?
根据上面的化学方程式特点,请你写出氧化铝与盐酸或硫酸反应的化学方程式。
结论:酸能与碱、金属氧化物反应有水生成
Al2O3+6HCl=2AlCl3+3H2O
Al2O3+3H2SO4=Al2(SO4)3+3H2O
(1)、在试管中放入少量CaCO3粉末,再加入1mL稀盐酸(或稀硫酸)。
(2)、在试管中加入0.5mLNa2CO3溶液,再加入1mL稀盐酸(或稀硫酸)。
【实验】
CaCO3+2HCl
=CaCl2+H2CO3
酸 + 盐 → 新酸 + 新盐(复分解反应)
=2NaCl+H2O+CO2↑
=CaCl2+H2O+CO2↑
=Na2SO4+H2O+CO2↑
=CaSO4+H2O+CO2↑
Na2CO3+2HCl
=2NaCl+H2CO3
Na2CO3+H2SO4
=Na2SO4+H2CO3
CaCO3+H2SO4
=CaSO4+H2CO3
酸 + 碳酸盐 → 新盐 + 水 + 二氧化碳
5.酸与盐的反应:
与CaCO3反应 与Na2CO3反应
稀盐酸
稀硫酸
硝酸银和稀盐酸反应
补充实验
氯化钡和稀硫酸反应
AgNO3 + HCl = AgCl ↓+ HNO3
BaCl2 + H2SO4 = BaSO4↓+ 2HCl
指示剂
金属
金属氧化物
碱
盐
小结:酸的化学性质
思考:为何盐酸、硫酸等酸具有相似的化学性质?
酸
1.下列物质中,能直接用金属与盐酸反应制得的是( )
A
FeCl3
B
CuCl2
C
AgCl
D
ZnCl2
2.蚂蚁能分泌出蚁酸。蚁酸的化学性质与盐酸相似,能腐蚀很多物质。 下列最不容易被蚁酸腐蚀的是()
A
镀锌水管
B
铜制塑像
C
大理石栏杆
D
铝合金门窗
D
B
(2)清洗水垢时盐酸的用量不能过多,否则会损坏水壶,原因是:
,反应的化学方程式
.
3.家用铝制电热水壶,长期使用后会在壶底结一层水垢(主要成分是CaCO3)
(1)用适量的稀盐酸可以除去水垢,反应的化学方程式为 .
盐酸先与铝表面的氧化膜反应,后与内部的铝反应
CaCO3+2HCl= CaCl2+H2O+CO2↑
Al2O3+6HCl= 2AlCl3+3H2O
2Al+6HCl= 2AlCl3+3H2↑
4.如图是稀硫酸与不同物质之间发生化学反应的颜色变化
红色溶液
稀硫酸
蓝色溶液
浅绿色溶液
② 单质
③
氧化物
①
指示剂
(1)①处所使用的指示剂是 ;
(2)请你在编号②③处各填入一种物质。
②是 ;③是 ;
(3)反应②涉及的基本反应类型是 ;
(4)如果想要得到黄色溶液,那么有稀硫酸参与反应的
方程式 ;
紫色石蕊溶液
铁
氧化铜
置换反应
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
5.学习完酸的化学性质,
小凯构建了如图所示的
知识网络图。请回答:
(1)溶液X是一种酸,
试剂A的名称是 。
(2)若X是稀硫酸、B是氧化物,则B的化学式为 。
紫色石蕊溶液
Fe2O3
(3)若X是稀盐酸、C是单质,则C的名称为 。
(4)若X是稀盐酸、D是碳酸钙,则X与D反应的化学方程式为 _________________________________。
2HCl+CaCO3 CaCl2+H2O+CO2↑
铁
第十单元 酸与碱
课题1:常见的酸与碱(碱)
学习目标
1.掌握氢氧化钠的组成、俗称、物理性质和用途。
2.掌握氢氧化钙的组成、俗称、物理性质和用途
二、常见的碱
Ca(OH)2
NaOH
NH3·H2O
1.几种常见的碱
⑴、氢氧化钠(NaOH)
实验 现象 分析
观察NaOH的颜色和状态
将NaOH放在表面皿上, 放置一会儿
将NaOH放入盛有少量水的试里,并用手轻轻触碰试管外壁
白色固体
表面潮湿
逐渐溶解
试管发烫
容易吸收空气中的水分
溶于水时放出大量的热
实验:用镊子夹取3小块NaOH分别进行实验(切勿用手拿)。
NaOH曝露在空气中容易吸收水分,表面潮湿并逐渐溶解,这种现象叫做潮解。(物理性质)
氢氧化钠是白色固体,易溶于水,并放出大量热。
氢氧化钠在空气中易潮解(曝露在空气中容易吸收水分,表面潮湿并逐渐溶解)——可作某些气体(O2、N2、CO等)的干燥剂。
②、腐蚀性:
氢氧化钠有强烈的腐蚀性,
所以,它的俗名叫做苛性钠、火碱或烧碱。
如果不慎将碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液。
①、物理性质:
注意!在使用氢氧化钠时必须十分小心,防止眼睛、皮肤、衣服被它腐蚀。实验时最好戴防护眼镜。
②.氢氧化钠的保存方法
氢氧化钠的保存方法:
1、氢氧化钠固体易吸水潮解
2、与空气中二氧化碳反应而变质
2NaOH+CO2=Na2CO3+H2O
密封保存
原因:
肥 皂
石 油
造 纸
纺 织
印 染
含NaOH
③、用途:
氢氧化钠是一种重要的化工原料,广泛应用于肥皂、石油、造纸、纺织和印染等工业。氢氧化钠能与油脂反应,在生活中可以用来去除油污,如炉具清洁剂中就含有氢氧化钠。
讨论交流
NaOH固体、浓硫酸是溶解放热;生石灰是与水反应放热 。
汽油能溶解油污;洗涤剂是乳化油污;NaOH是使油污分解。
1、NaOH固体、浓硫酸和生石灰中加水都放出大量的热,
这三种放热有什么区别?
2、汽油、洗涤剂、 NaOH都能去油污。
其原理有什么不同?
2、氢氧化钙 [ Ca(OH)2 ]
在检验二氧化碳时用到的石灰水就是氢氧化钙的水溶液。
生石灰 CaO
CaO + H2O Ca(OH)2
生石灰与水反应得到氢氧化钙。
产生大量的热
注意安全
氢氧化钙
俗称熟石灰或
消石灰。
氢氧化钙对皮肤、衣服等也有腐蚀作用。
取一小药匙氢氧化钙,观察它的颜色和状态,然后放入小烧杯中,加入约30 mL水,用玻璃棒搅拌,观察氢氧化钙在水中的溶解情况。
现象
颜色、状态
在水中的溶解情况
向澄清石灰水通CO2
白色粉末状固体
部分溶解,液体浑浊
产生白色浑浊
实验10-6 氢氧化钙的性质
微溶于水
水溶液俗称石灰水,当存在较多未溶解的
熟石灰时,称为石灰乳或石灰浆
氢氧化钙的用途:
配制农药波尔多液
石灰水粉刷墙壁
在树木上涂刷石灰浆,保护树木
改良酸性土壤
用熟石灰与沙子混合来砌砖
制取氢氧化钠:
Ca(OH)2 + Na2CO3==2NaOH + CaCO3↓
氢氧化钙的生成
CaO + H2O == Ca(OH)2
CaCO3 === CaO + CO2↑
高温
Ca(OH)2+ CO2= CaCO3↓ + H2O
石灰吟
[明] 于谦
石灰石的主要成分
生石灰
熟石灰
千锤万凿出深山,
烈火焚烧若等闲。
粉身碎骨全不怕,
要留清白在人间。
3、几种常见的碱
常用的碱有:氢氧化钠、氢氧化钙、
氢氧化钾 [KOH]、氨水[NH3·H2O] 等。
Mg(OH)2 Al(OH)3 Cu(OH)2 Fe(OH)2 Fe(OH)3
蓝色
红褐色
可溶性碱:
NaOH KOH Ba(OH)2 NH3·H2O
微溶性碱:
Ca(OH)2
难溶性碱:
实验内容 实验现象 烧碱、消石灰、氨水物理性质的比较 氢氧化钠 氢氧化钙 氨水
颜色 白色 白色 无色
状态 片状固体 粉末状固体 液体
气味 无味 无味 有气味
溶解性 易溶 微溶 易溶
俗名 烧碱、火碱 熟石灰、消石灰
烧碱、氨水露置在空气中发生的变化 烧碱露置在空气中,表面出现潮湿,这个现象称为潮解。同时氢氧化钠也会吸收空气中二氧化碳而发生化学变化,生成碳酸钠。 氨水露置在空气中,会使其溶质质量分数变。 烧碱的溶解情况 放出大量的热,水溶液具有滑腻感。 4、归纳与小结
干燥剂
种类 浓硫酸 (H2SO4) 铁粉 (Fe) 氧化钙 (CaO) 氢氧化钠
(NaOH)
原理 吸水,物理变化 铁生锈,既吸水又吸收氧气,化学变化 CaO+H2O=Ca(OH)2 化学变化 吸水,物理变化
注意事项 不能干燥NH3 等 双吸剂,常用食品干燥剂、还能使食品保鲜。 不能干燥CO2、SO2、HCl等,常用食品干燥剂。 不能干燥CO2、SO2 、HCl等
液体干燥剂
固体干燥剂
装置图
干燥剂
可干燥物
不可干燥物
浓硫酸
固体氯化钙、氧化钙、氢氧化钠、碱石灰
中性或酸性气体
大多数气体
中性或碱性气体
NH3
NH3
HCl、SO2、CO2
常见干燥剂及使用装置
巩固: (课本第4题)
1.在某些食品的包装袋内,有一个装有白色颗粒状固体的小纸袋,上面写着“干燥剂,主要成分为生石灰”。为什么生石灰能做干燥剂?如果将小纸袋拿出来放在空气中,经过一段时间后,会发现纸袋内的白色颗粒粘在一起成为块状。这是为什么?试写出有关反应的化学方程式。
因为生石灰能与水发生化合反应生成氢氧化钙,
CaO + H2O === Ca(OH)2
氢氧化钙又能与空气中的二氧化碳反应生成碳酸钙和水。
Ca(OH)2+CO2==CaCO3↓+H2O
蓝色
蓝色
红色
红色
⑴、碱与指示剂反应:
滴入紫色 石蕊溶液后 滴入无色
酚酞溶液后
氢氧化钠溶液
氢氧化钙溶液
碱溶液能使紫色石蕊溶液变蓝色;
能使无色酚酞溶液变红色。
四、碱的化学性质
Ca(OH)2+CO2==CaCO3↓+H2O
①、回忆:二氧化碳使澄清石灰水变浑浊
氢氧化钙能与空气中的二氧化碳反应,生成坚硬的碳酸钙。将氢氧化钙粘土和沙子混凝,用来做建筑材料,就是利用氢氧化钙的这一性质。
(2)、碱与某些非金属氧化物反应
Ca(OH)2溶液
②、氢氧化钠在空气中不仅吸收水分而潮解,还会与空气中的CO2发生反应而变质:
NaOH与CO2发生了反应没有现象,请你设计实验证明NaOH与CO2反应了,而不是CO2与H2O反应。
NaOH溶液
NaOH
H2O
软塑料瓶
软塑料瓶
甲
乙
方案一
反应前的溶液
稀盐酸
反应后的溶液
稀盐酸
有气泡产生
方案二
水
鼓起程度大
2NaOH+CO2==Na2CO3+H2O
所以,氢氧化钠必须密封保存。
如:2NaOH + CO2 == Na2CO3 + H2O;
Ca(OH)2 + SO2 == CaSO3↓ + H2O;
讨论:上面两个反应有什么共同之处?三氧化硫、二氧化硫与碱的反应与上面的两个反应类似,试写出三氧化硫与氢氧化钠反应的化学方程式:
_________________________________
2NaOH+SO3==Na2SO4+H2O
与某些非金属氧化物反应
碱 + 非金属氧化物 → 盐 + 水
化学方程式
CO2 + 石灰水
CO2+ NaOH溶液
SO3+ NaOH溶液
Ca(OH)2 + CO2 = CaCO3 + 2H2O
2NaOH + CO2 = Na2CO3 + H2O
2NaOH + SO3 = Na2SO4 + H2O
书写规律
讨论交流
实验室检验CO2应选择什么试剂?除去CO2应选择什么试剂?为什么?
检验CO2应选择澄清石灰水,而不选择NaOH溶液。
因为CO2与Ca(OH)2反应会产生白色沉淀,而CO2与NaOH反应无明显现象。
除去CO2应选择NaOH溶液,而不选择Ca(OH)2溶液。因为
Ca(OH)2微溶于水,溶液浓度小,会导致吸收不彻底。
实验探究3
试管中加少量氢氧化钙溶液,滴加两滴酚酞试液,然后逐滴加入稀盐酸;
试管中加少量氢氧化钠溶液,滴加两滴酚酞试液,然后逐滴加入稀硫酸。
现象
溶液由红色逐渐变为无色。
如:NaOH + HCl == NaCl + H2O;
Ca(OH)2 + H2SO4 == CaSO4 + 2H2O;
(3)、与酸反应(中和反应)
碱 + 酸 → 盐 + 水(复分解反应)
CuSO4溶液
?
滴加NaOH
FeCl3溶液
?
滴加NaOH
?
滴加Ca(OH)2
Na2CO3溶液
实验探究4
现象
蓝色絮状沉淀
红褐色沉淀
白色沉淀
FeCl3 + 3NaOH == Fe(OH)3↓+ Na2SO4
CuSO4 + 2NaOH == Cu(OH)2↓+ Na2SO4
Ca(OH)2 + Na2CO3==2NaOH + CaCO3↓
Ca(OH)2 + CuSO4 =Cu(OH)2↓+ CaSO4
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
Ca(OH)2 + Na2CO3==2NaOH + CaCO3↓
(4)、能与某些盐反应
碱 + 盐→ 新碱 + 新盐(复分解反应)
课堂小结
1.氢氧化钠:
俗名:火碱、烧碱、苛性钠。白色固体,易溶于水,溶于水放热。吸水性(潮解)、强腐蚀性
2.氢氧化钙
俗名:熟石灰、消石灰。白色固体,微溶于水。
指示剂
非金属氧化物
酸
盐
3.碱的化学性质
思考:为何氢氧化钠、氢氧化钙等酸具有相似的化学性质?
碱
1. 下列关于氢氧化钠的描述中不正确是( )
A.可用于改良酸性土壤
A
C.能去除油污,可用作炉具清洁剂
2. 下列关于氢氧化钙的描述中错误的是( )
A.氢氧化钙与硫酸铜等可配制成具有杀菌作用的波尔多液
C.氢氧化钙在农业上可改良酸性土壤
B.易溶于水,溶解时放出大量的热
D.对皮肤有强烈的腐蚀作用
B.氢氧化钙俗称熟石灰或消石灰
D.氢氧化钙易溶于水
D
课堂精练
3.将空气依次通过盛固体氢氧化钠的干燥管、灼热的铜网、盛浓硫酸的洗气瓶,并充分接触和反应,最终剩余的气体是( )
A.O2、N2
C
B.CO2、N2
C.稀有气体、N2
D.稀有气体和水蒸气
4.下列各组名称中,称呼的是同一种物质的是( )
A.氢氧化钠、苛性钠、烧碱、火碱
B.碳酸钙、石灰石、大理石、生石灰
C.氢氧化钙、消石灰、熟石灰、石灰石
D.氧化钙、生石灰、石灰石、消石灰
A
5.10%的氢氧化钠溶液可用来作叶脉书签,这是利用了氢氧化钠 性质中的( )
A.易溶于水 B. 易潮解 C.腐蚀性 D. 溶于水放热
6.下列说法错误的是( )
A.氢氧化钠除油污是因为它可与油污反应
B. 氢氧化钠可做某些气体的干燥剂,是因为它具有吸水性
C.树木上刷石灰浆可以防止害虫生卵
D. 实验室称量氢氧化钠时应放在纸上称量
C
D
7.某同学为了区别氢氧化钠溶液和澄清石灰水,设计了如下图所示的四组实验方案,其中能达到目的的是( )
A. B. C. D.
C
盐酸
酚酞
石蕊
二氧化碳
酸碱溶液中的粒子
酸溶液为什么具有一些相似的化学性质 碱溶液为什么也具有一些相似的化学性质
物质 盐酸 硫酸 NaOH溶液 Ca(OH)2溶液 蒸馏水 乙醇
导电性
酸溶液、碱溶液为什么能导电?
而蒸馏水、乙醇为什么不导电?
×
×
物质 硫酸铜 氯化钠
导电性
能导电的物质中一定存在自由移动的带电粒子。
金属能导电
金属中有自由移动的电子
酸、碱、盐溶液能导电
溶液中存在自由移动的带电粒子
离子
酸碱盐
溶于水
溶液能导电
自由移动的离子
电离
H2SO4
SO42-
SO42-
H2SO4
H+和Cl-
H+和SO42-
分子中没有自由移动的离子
能够自由移动的离子
酸在溶液中会发生电离:
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
酸→ H+ + 酸根离子
四、酸碱溶液中的粒子
酸:电离出来的阳离子全部为H+的物质。
在不同的酸溶液中都含有相同的H+,所以,酸有一些相似的性质。
能够自由移动的离子
Ca(OH)2
Ca(OH)2
Ca2+
Ca2+
Na+和OH-
Ca2+和OH-
固体中没有自由移动的离子
在不同的碱溶液中都含有相同的OH—,所以碱也有一些相似的性质。
NaOH = Na+ + OH-
Ca(OH)2 = Ca2+ + 2OH-
碱在溶液中会发生电离:
碱→金属离子+ OH-
碱:电离出来的阴离子全部为OH—的物质。
能够自由移动的离子
固体中没有自由移动的离子
Na+和Cl-
Cu2+和SO42-
NaCl === Na+ + Cl-
CuSO4=== + SO42—
Cu2+
盐在溶液中会发生电离:
盐→金属阳离子+酸根阴离子
盐:电离生成金属离子(包括铵根离子( ))和酸根离子的化合物。
NH4+
物理性质
化学性质
常见的碱、溶液导电性原因
氢氧化钠
氢氧化钙
物理性质
化学性质
碱的通性
能与酸碱指示剂作用
能与某些非金属氧化物反应
溶液导电的原因
溶液中有自由移动的离子
复习巩固:1.蒸馏水______(填“能”或“不能”,以下同)导电;乙醇______导电; 氯化钠溶液_____导电;氢氧化钠溶液______导电;有些溶液能导电是因为这些溶液中存在有自由移动的__________。
2.下列检验物质导电性的实验中,不亮的灯泡是 ( )
不能
不能
能
能
离子
A
3.酸溶液具有相似的化学性质是因为酸在水溶液中能解离出________和__________,即在不同的酸溶液中都含有相同的_________;
碱溶液具有相似的化学性质是因为碱在水溶液中能解离出_________和___________,即在不同的碱溶液中都含有相同的___________。
氢离子
酸根离子
氢离子
金属离子
氢氧根离子
氢氧根离子
4.酸具有酸的通性的原因是( )
A.酸都能电离出H+ B.酸都含有酸根
C.酸中都含有氢元素 D.酸中都含有氧元素
A
5.氢氧化钠溶液和氢氧化钙溶液具有相似的化学性质,
其本质原因是( )
A 都能与指示剂 作用 B 都能解离出氢氧根离子
C 都能解离出金属阳离子 D 都含有氢元素和氧元素
B
6.将一套如图所示的密闭装置放在天平上,使天平平衡,经过一段时间后出现的情况是( )
A.指针偏左,食盐溶液一定变稀,烧碱潮解
B.指针偏左,食盐溶液一定变浓,烧碱潮解
C.指针偏右,食盐溶液一定变浓,烧碱潮解
D.指针偏右,食盐溶液一定饱和,烧碱潮解
C
7.用一种试剂(或试纸)就能一次性把Ca(OH)2、NaCl、HCl三种溶液区别开,这种试剂(或试纸)是 ( )
A. 酚酞试液
B.紫色石蕊试液
C.水
D.pH试纸
B、D
同课章节目录
