2022-2023学年下学期高二化学人教版(2019)选择性必修22.2分子的空间结构课件(23张PPT)
文档属性
| 名称 | 2022-2023学年下学期高二化学人教版(2019)选择性必修22.2分子的空间结构课件(23张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-08 10:57:59 | ||
图片预览


文档简介
(共23张PPT)
分子的空间结构
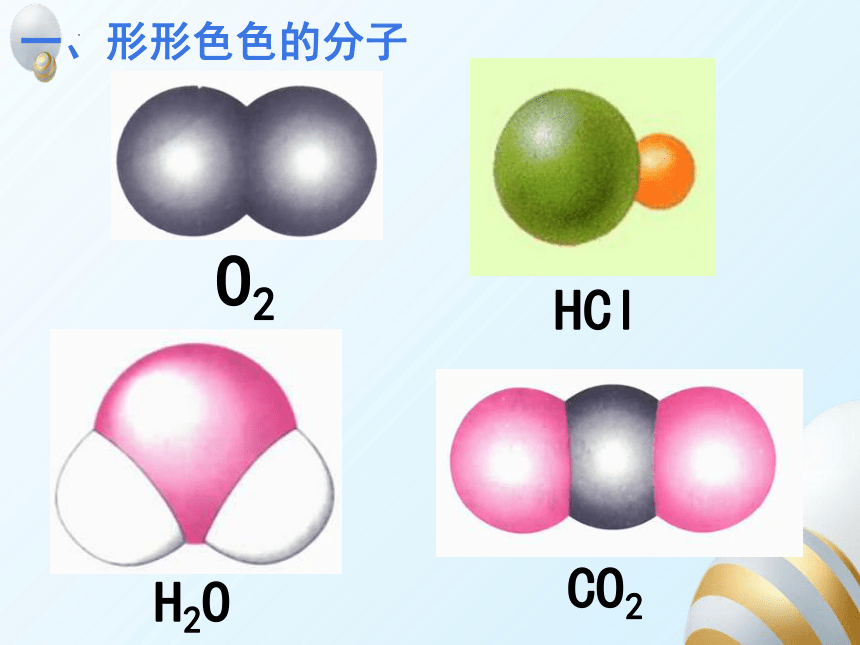
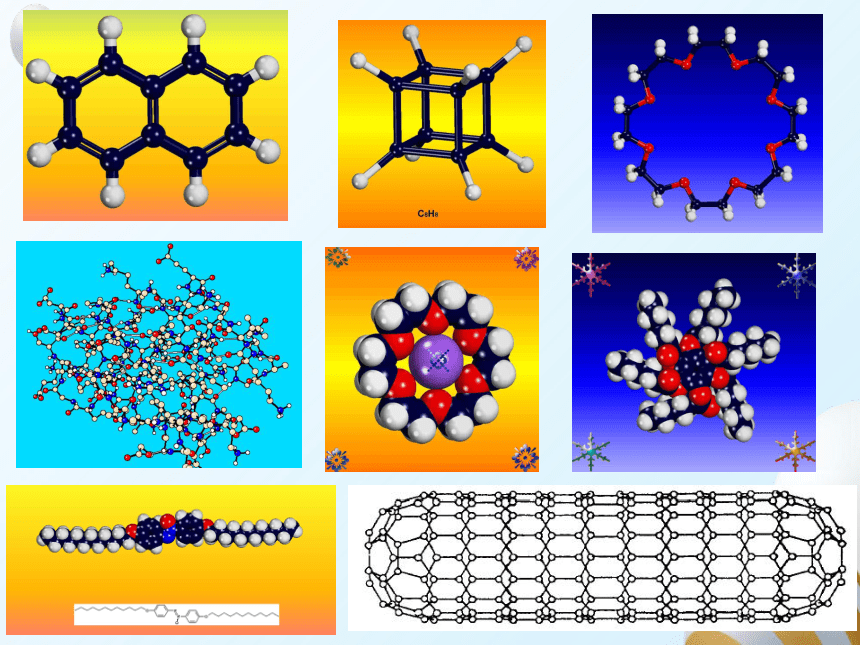
一、形形色色的分子
O2
HCl
H2O
CO2
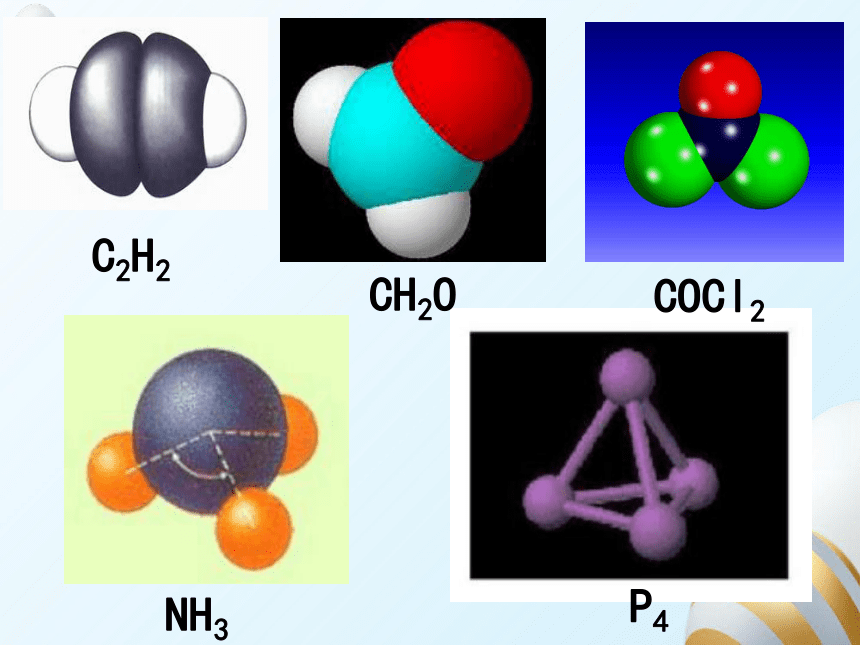
C2H2
CH2O
COCl2
NH3
P4
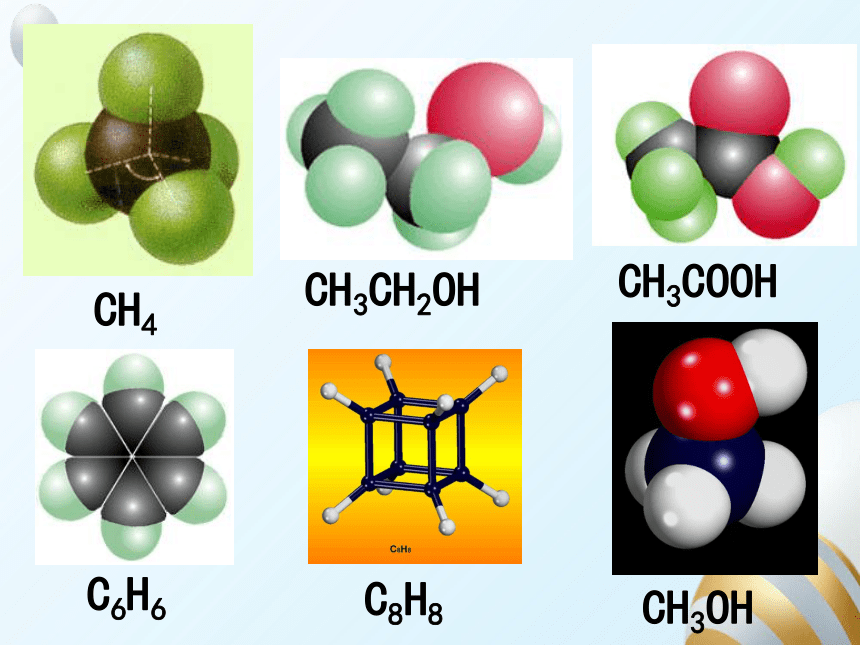
CH4
CH3CH2OH
CH3COOH
C6H6
C8H8
CH3OH
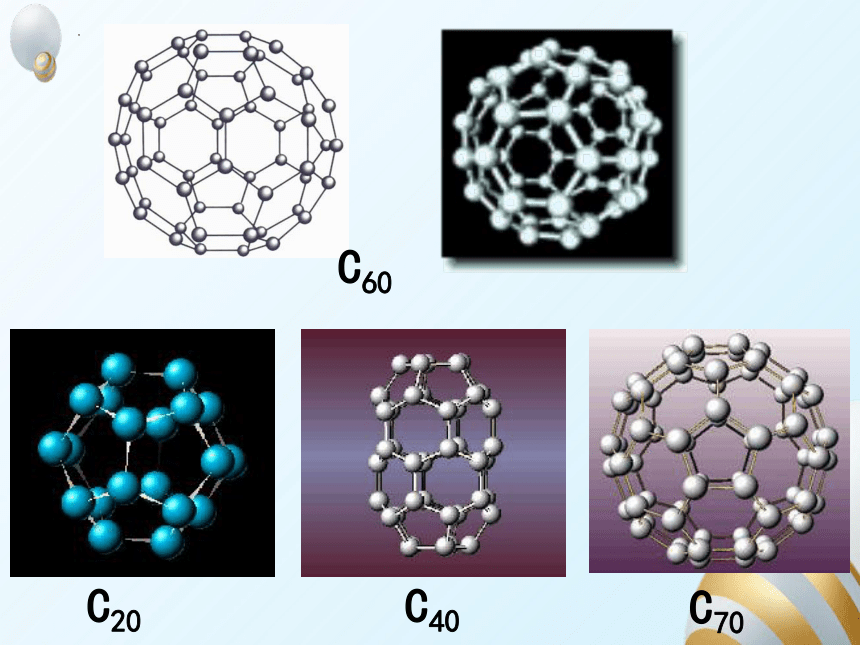
C60
C20
C40
C70
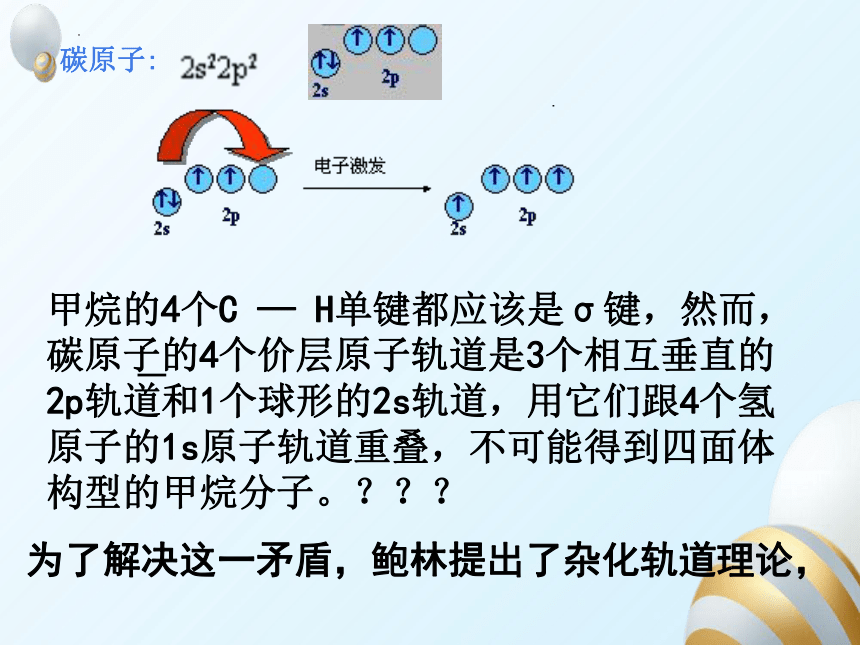
碳原子:
甲烷的4个C — H单键都应该是σ键,然而,碳原子的4个价层原子轨道是3个相互垂直的2p轨道和1个球形的2s轨道,用它们跟4个氢原子的1s原子轨道重叠,不可能得到四面体构型的甲烷分子。???
为了解决这一矛盾,鲍林提出了杂化轨道理论,
杂化轨道理论
杂化:原子内部能量相近的原子轨道,在外界条件影响下重新组合的过程叫原子轨道的杂化
杂化轨道:原子轨道组合杂化后形成的一组新轨道
杂化轨道类型:sp、sp2、sp3、sp3d2等
杂化结果:重新分配能量和空间方向,组成数目相等成键能力更强的原子轨道
杂化轨道只用于容纳σ键和孤对电子
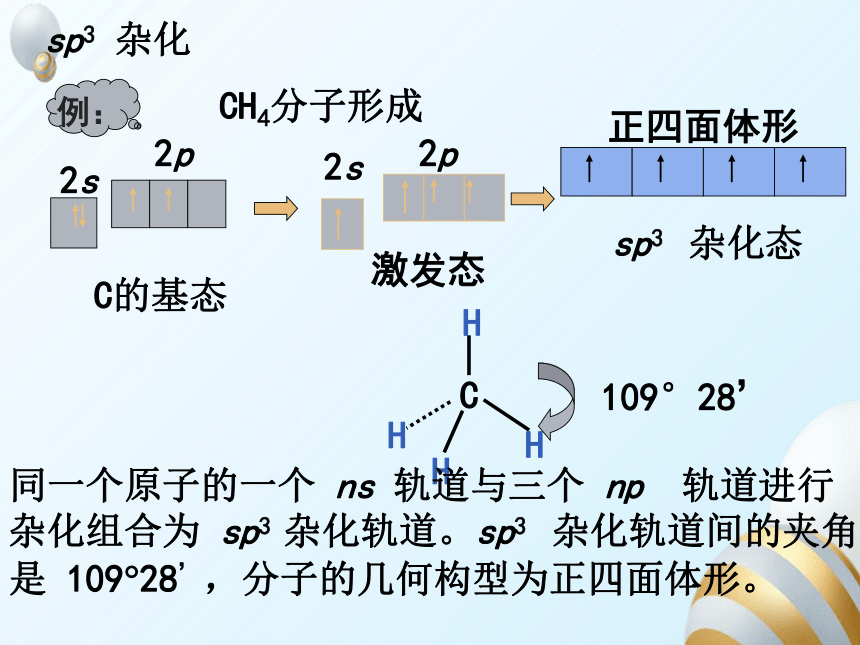
sp3 杂化
C的基态
例:
CH4分子形成
2s
2p
2s
2p
激发态
正四面体形
sp3 杂化态
C
H
H
H
H
109°28’
同一个原子的一个 ns 轨道与三个 np 轨道进行
杂化组合为 sp3 杂化轨道。sp3 杂化轨道间的夹角
是 109 28’,分子的几何构型为正四面体形。
一、共价键的形成条件
A、有自旋方向相反的未成对电子。
B、原子轨道要实现最大限度的重叠。
①头碰头重叠——σ键
相互
靠拢
H· + H· H:H
s—s
H· + ·Cl H Cl
·
·
·
·
·
·
·
·
·
·
·
·
·
·
p—s
p—p
+
Cl· + ·Cl Cl Cl
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
②肩并肩重叠——π键
分子构型与物质的性质
甲烷分子的空间构型是什么?
思考:甲烷分子中的C原子的电子排布式是1s22s22p2,只能形成两个共价键,且键角应该是大约900,而现在形成四个共价键,且键角是109.50,怎么解释?
分子构型与物质的性质
杂化轨道
原子在形成分子时,为了增强成键能力,使分子的稳定性增加,趋向于将不同类型的原子轨道重新组合成能量、形状和方向与原来不同的新原子轨道。这种重新组合称为杂化;杂化后的原子轨道称为杂化轨道。
分子构型与物质的性质
CH4分子中C原子的杂化和成键情况
CH4分子中的C原子是sp3杂化,4个sp3杂化轨道指向正四面体的4个顶点,与4个H原子的1s轨道形成4个相同的σ键。
CH4分子具有正四面体的空间构型
分子构型与物质的性质
关于杂化轨道的注意点
(1)只有能量相近的轨道才能相互杂化。
(2)形成的杂化轨道数目等于参加杂化的原子轨道数目。
(3)杂化轨道成键能力大于原来的原子轨道。因为杂化轨道的形状变成一头大一头小了,用大的一头与其他原子的轨道重叠,重叠部分显然会增大。
分子构型与物质的性质
思考题:为了满足生成BF3和BeCl2的要求,B和Be原子的价电子排布应如何改变?用轨道式表示B和Be原子的价电子结构的改变。
BF3中的B是sp2杂化,BeCl2中的Be是sp杂化。
分子构型与物质的性质
杂化轨道的空间取向
杂化类型 sp sp2 sp3
杂化轨道夹角
杂化轨道
空间取向
实例
180
120
109.5
直线
正四面体
BeCl2
BF3
CH4
平面
三角形
分子构型与物质的性质
思考题:观察书本P69图,回答乙烯与乙炔分子的成键情况。
乙烯 sp2杂化 5个σ键,1个π键
乙炔 sp杂化 3个σ键,2个π键
分子构型与物质的性质
挑战自我:NH3、H2O分子分别是三角锥形分子、V形分子,如何用杂化轨道的知识解释。
NH3、H2O分子中N、O原子都是sp3杂化,由于孤电子对的影响使键角都小于109.50。
NH3、H2O键角分别为107.30、104.50。
杂化类型 sp sp2 sp3
参与杂化的原子轨道 1个s和1个p 1个s和2个p 1个s和3个p
杂化轨道数 2个sp杂化 轨道 2个sp2杂化轨道 2个sp3杂化轨道
杂化轨道间的夹角 180 120 109.5
空间构型 直线形 正三角形 正四面体
实例 BeCl2 、乙炔 BF3、乙烯 CH4、CCl4
分子的空间结构
一、形形色色的分子
O2
HCl
H2O
CO2
C2H2
CH2O
COCl2
NH3
P4
CH4
CH3CH2OH
CH3COOH
C6H6
C8H8
CH3OH
C60
C20
C40
C70
碳原子:
甲烷的4个C — H单键都应该是σ键,然而,碳原子的4个价层原子轨道是3个相互垂直的2p轨道和1个球形的2s轨道,用它们跟4个氢原子的1s原子轨道重叠,不可能得到四面体构型的甲烷分子。???
为了解决这一矛盾,鲍林提出了杂化轨道理论,
杂化轨道理论
杂化:原子内部能量相近的原子轨道,在外界条件影响下重新组合的过程叫原子轨道的杂化
杂化轨道:原子轨道组合杂化后形成的一组新轨道
杂化轨道类型:sp、sp2、sp3、sp3d2等
杂化结果:重新分配能量和空间方向,组成数目相等成键能力更强的原子轨道
杂化轨道只用于容纳σ键和孤对电子
sp3 杂化
C的基态
例:
CH4分子形成
2s
2p
2s
2p
激发态
正四面体形
sp3 杂化态
C
H
H
H
H
109°28’
同一个原子的一个 ns 轨道与三个 np 轨道进行
杂化组合为 sp3 杂化轨道。sp3 杂化轨道间的夹角
是 109 28’,分子的几何构型为正四面体形。
一、共价键的形成条件
A、有自旋方向相反的未成对电子。
B、原子轨道要实现最大限度的重叠。
①头碰头重叠——σ键
相互
靠拢
H· + H· H:H
s—s
H· + ·Cl H Cl
·
·
·
·
·
·
·
·
·
·
·
·
·
·
p—s
p—p
+
Cl· + ·Cl Cl Cl
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
②肩并肩重叠——π键
分子构型与物质的性质
甲烷分子的空间构型是什么?
思考:甲烷分子中的C原子的电子排布式是1s22s22p2,只能形成两个共价键,且键角应该是大约900,而现在形成四个共价键,且键角是109.50,怎么解释?
分子构型与物质的性质
杂化轨道
原子在形成分子时,为了增强成键能力,使分子的稳定性增加,趋向于将不同类型的原子轨道重新组合成能量、形状和方向与原来不同的新原子轨道。这种重新组合称为杂化;杂化后的原子轨道称为杂化轨道。
分子构型与物质的性质
CH4分子中C原子的杂化和成键情况
CH4分子中的C原子是sp3杂化,4个sp3杂化轨道指向正四面体的4个顶点,与4个H原子的1s轨道形成4个相同的σ键。
CH4分子具有正四面体的空间构型
分子构型与物质的性质
关于杂化轨道的注意点
(1)只有能量相近的轨道才能相互杂化。
(2)形成的杂化轨道数目等于参加杂化的原子轨道数目。
(3)杂化轨道成键能力大于原来的原子轨道。因为杂化轨道的形状变成一头大一头小了,用大的一头与其他原子的轨道重叠,重叠部分显然会增大。
分子构型与物质的性质
思考题:为了满足生成BF3和BeCl2的要求,B和Be原子的价电子排布应如何改变?用轨道式表示B和Be原子的价电子结构的改变。
BF3中的B是sp2杂化,BeCl2中的Be是sp杂化。
分子构型与物质的性质
杂化轨道的空间取向
杂化类型 sp sp2 sp3
杂化轨道夹角
杂化轨道
空间取向
实例
180
120
109.5
直线
正四面体
BeCl2
BF3
CH4
平面
三角形
分子构型与物质的性质
思考题:观察书本P69图,回答乙烯与乙炔分子的成键情况。
乙烯 sp2杂化 5个σ键,1个π键
乙炔 sp杂化 3个σ键,2个π键
分子构型与物质的性质
挑战自我:NH3、H2O分子分别是三角锥形分子、V形分子,如何用杂化轨道的知识解释。
NH3、H2O分子中N、O原子都是sp3杂化,由于孤电子对的影响使键角都小于109.50。
NH3、H2O键角分别为107.30、104.50。
杂化类型 sp sp2 sp3
参与杂化的原子轨道 1个s和1个p 1个s和2个p 1个s和3个p
杂化轨道数 2个sp杂化 轨道 2个sp2杂化轨道 2个sp3杂化轨道
杂化轨道间的夹角 180 120 109.5
空间构型 直线形 正三角形 正四面体
实例 BeCl2 、乙炔 BF3、乙烯 CH4、CCl4
