化学人教版(2019)必修第二册7.2.1乙烯(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册7.2.1乙烯(共24张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-08 11:04:34 | ||
图片预览




文档简介
(共24张PPT)
第七章 有机化合物
第二节 乙烯与有机高分子材料
第1课时 乙烯
【引人】
为了促进香蕉成熟,可在密封袋子中放一些成熟的苹果
乙 烯
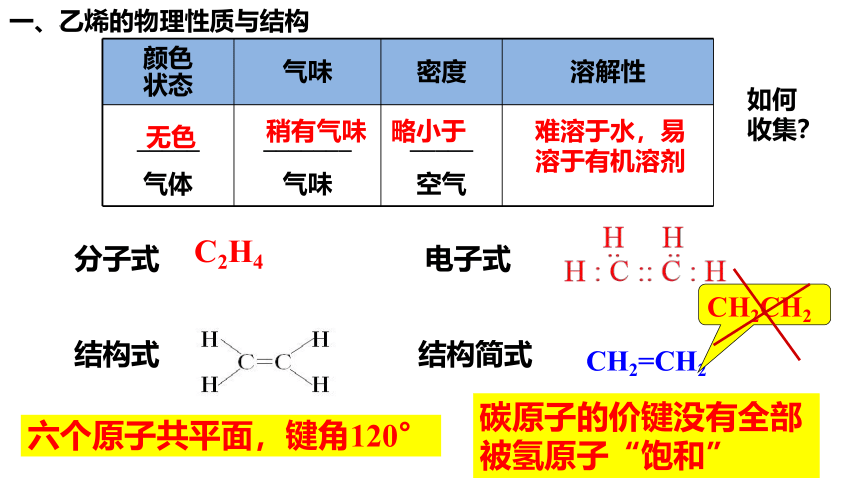
一、乙烯的物理性质与结构
颜色 状态 气味 密度 溶解性
_____ 气体 _______ 气味 _____ 空气
无色
稍有气味
略小于
难溶于水,易溶于有机溶剂
分子式 电子式
结构式 结构简式
C2H4
CH2=CH2
CH2CH2
六个原子共平面,键角120°
碳原子的价键没有全部被氢原子“饱和”
如何收集?
分子式 乙烷 乙烯
结构式
键的类别
键角
键长(10-10米)
键能(kJ/mol)
空间 各原子的位置
2C和4H在同一平面上
约109 28ˊ
1.54
348
2C和6H不在同一平面上
120
1.33
615
CH2=CH2
CH3-CH3
C—C
C=C
碳碳双键使乙烯变得更稳定还是更活泼?
可旋转
不可旋转
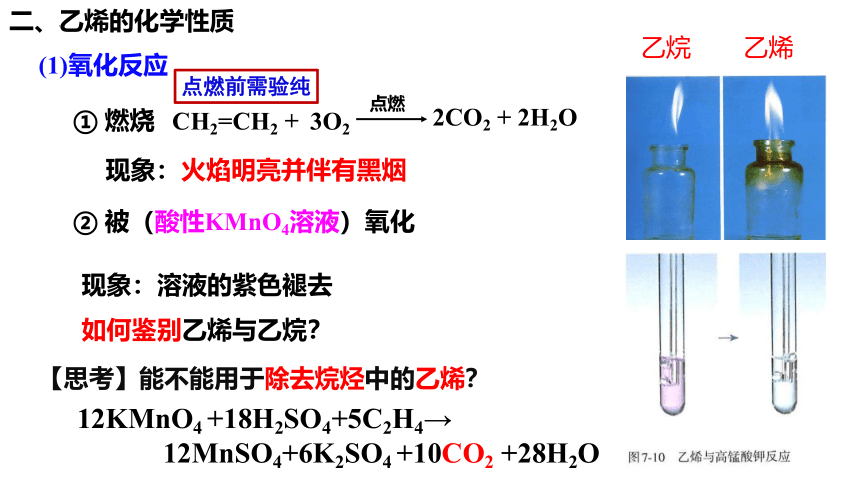
二、乙烯的化学性质
【实验7-2】
(1)点燃纯净的乙烯,观察燃烧时的现象。
(2)将乙烯通入盛有酸性高锰酸钾溶液的试管中,观察现象。
(1)氧化反应
CH2=CH2
+
3O2
点燃
2CO2 + 2H2O
① 燃烧
现象:火焰明亮并伴有黑烟
二、乙烯的化学性质
现象:溶液的紫色褪去
如何鉴别乙烯与乙烷?
【思考】能不能用于除去烷烃中的乙烯?
② 被(酸性KMnO4溶液)氧化
乙烷 乙烯
点燃前需验纯
12KMnO4 +18H2SO4+5C2H4→
12MnSO4+6K2SO4 +10CO2 +28H2O
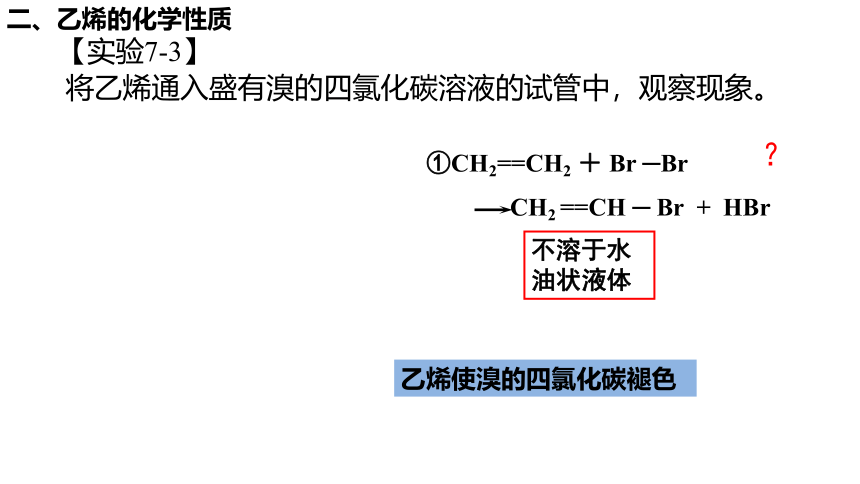
二、乙烯的化学性质
【实验7-3】
将乙烯通入盛有溴的四氯化碳溶液的试管中,观察现象。
乙烯使溴的四氯化碳褪色
①CH2==CH2 + Br ─Br
CH2 ==CH ─ Br + HBr
?
不溶于水油状液体
无沉淀生成
(2)加成反应
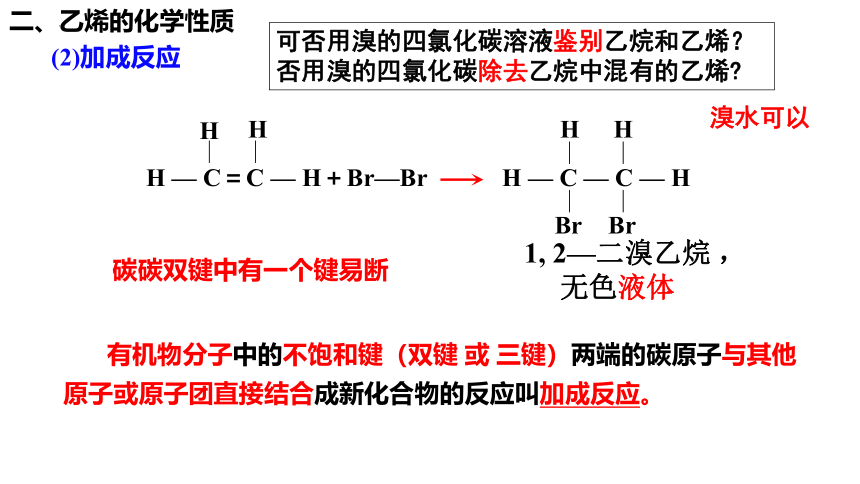
二、乙烯的化学性质
H — C=C — H+Br—Br H — C — C — H
H
H
Br
Br
H
H
碳碳双键中有一个键易断
有机物分子中的不饱和键(双键 或 三键)两端的碳原子与其他原子或原子团直接结合成新化合物的反应叫加成反应。
1, 2—二溴乙烷 ,
无色液体
可否用溴的四氯化碳溶液鉴别乙烷和乙烯?否用溴的四氯化碳除去乙烷中混有的乙烯
溴水可以
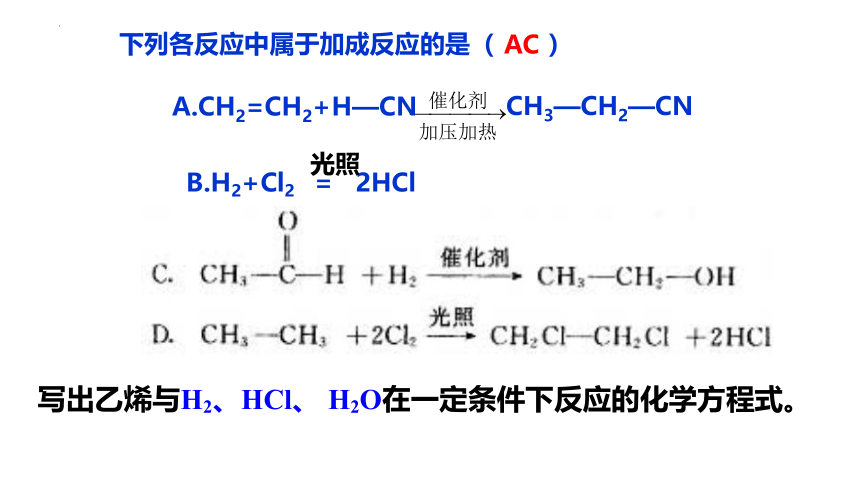
下列各反应中属于加成反应的是( )
CH3—CH2—CN
B.H2+Cl2 = 2HCl
光照
AC
写出乙烯与H2、HCl、 H2O在一定条件下反应的化学方程式。
A.CH2=CH2+H—CN
CH2=CH2 + H—Cl
催化剂
△,P
CH3—CH2Cl(氯乙烷)
(2)、加成反应
二、乙烯的化学性质
CH2=CH2+H-H
催化剂
CH2=CH2+H-OH
催化剂
CH2=CH2+H-Cl
催化剂
CH3-CH3
CH3-CH2OH
CH3-CH2Cl
①
②
③
加压、加热
工业制乙烷
工业制乙醇
△
加压、加热
思考:若制备CH3CH2Cl,请选用最合适的途径
CH2=CH2+CH2=CH2+CH2=CH2+…
催化剂
…-CH2 CH2--CH2 CH2--CH2 CH2-…
像这种由不饱和有机物通过加成的方式进行的聚合反应又叫做加成聚合反应,简称加聚反应。
n CH2=CH2
[ CH2—CH2 ]n
催化剂
(聚乙烯)
链节
聚合度
单体
高分子(M>1000)
混合物,无固定熔沸点
说出下列反应的反应类型
①由乙烯制氯乙烷
②乙烷在空气中燃烧
③乙烯使溴水褪色
④乙烯使酸性高锰酸钾溶液褪色
⑤乙烷在光照下与氯气反应
⑥乙烯生成聚乙烯
加成反应
氧化反应
加成反应
氧化反应
取代反应
加聚反应
1、单烯烃分子结构有什么特点?
2、单烯烃的分子式有无通式?
3、烯烃中碳的质量分数如何?
4、单烯烃的物理性质有什么规律?
名称 结构简式 常温时状态 溶沸点 相对密度
乙烯 CH2=CH2 气
丙烯 CH3CH=CH2 气
1—丁烯 CH3CH2CH=CH2 气
1—戊烯 CH3(CH2)2CH=CH2 液
1—己烯 CH3(CH2)3CH=CH2 液
1—庚烯 CH3(CH2)4CH=CH2 液
逐 渐 增 大
逐 渐 增 大
CnH2n
定值
烯烃的化学性质
⑴氧化反应 :
①不彻底氧化 烯烃
KMnO4/H+
CnH2n+ O2→
CO2和H2O的分子数之比为______ (烷烃呢 )
⑵加成反应
丙烯分别与Br2、H2、HBr、H2O反应的方程式
1:1
褪色
3n/2 nCO2+nH2O
⑶加聚反应
丙烯加聚反应的方程式
②彻底氧化
以C4H8为例写出其同分异构体
CH2==CH—CH2—CH3
CH3—C==CH2
︱
CH3
CH3—CH==CH—CH3
碳架异构
位置异构
种类异构
CH2
CH2
CH2
CH2
345 kJ mol—1
265 kJ mol—1
1、概念:含有碳碳叁键的不饱链烃叫做炔烃。
2、炔烃的通式: CnH2n-2 (n≥2)
3、炔烃的通性:
(1)物理性质: (似烷烃)
随着碳原子数的增多,沸点逐渐升高,密度小于1。
C小于等于4时为气态
(2)化学性质:(似乙炔)
能发生氧化反应,加成反应。
三、炔烃
乙烷、乙烯与乙炔结构的对比
分子式 乙烷 乙烯 乙炔
结构特点
特征反应
燃烧现象
高锰酸钾能否褪色
空间各原子的位子
2C和6H不在同一平面上
2C和4H在同一平面上
2C和2H在同一直线上
C==C
C—C
取代
加成、加聚
加成
不能
能
能
淡兰色火焰
明亮火焰、黑烟
明亮火焰、浓烟
(3)、聚合反应
二、乙烯的化学性质
像这样,由相对分子质量小的化合物分子互相结合成相对分子质量大的聚合物的反应叫做聚合反应。聚合反应在有机高分子材料的生产中有着广泛的应用。乙烯的聚合反应同时也是加成反应,这样的反应又被称为加成聚合反应,简称加聚反应。
1、重要的化工原料
2、植物生长调节剂,催熟剂等
除了被用作化工原料,乙烯还是一种植物生长调节剂,可用于催熟果实。在两个透明的塑料袋中各放一个未成熟的水果,向其中的一个袋子里再放一个成熟的水果,将袋口密封,观察并比较水果的变化。请查阅资料,与同学交流,解释以上现象。
【信息搜索】
乙烷与乙烯的分子结构和化学性质对比
分 子 结 构 分子式 C2H6 C2H4
结构式
碳碳键类别 碳碳单键 碳碳双键
分子内原子 的相对位置 C、H不全在一个平面内 6个原子都在同一平面内
【归纳总结】
化 学 性 质 燃烧 2C2H6+7O2 4CO2+6H2O C2H4+3O2 2CO2+2H2O
特征反应 C2H6+Cl2 C2H5Cl+HCl CH2==CH2+Br2
―→CH2BrCH2Br
与酸性高锰 酸钾溶液 不反应 因发生氧化反应而使其褪色
【归纳总结】
乙烯的性质
稍有气味水难溶,高锰酸钾溴反应。
现象相同理不同,前因氧化后加成。
加氧燃烧黑烟冒,聚合分子碳链增。
【归纳总结】
第七章 有机化合物
第二节 乙烯与有机高分子材料
第1课时 乙烯
【引人】
为了促进香蕉成熟,可在密封袋子中放一些成熟的苹果
乙 烯
一、乙烯的物理性质与结构
颜色 状态 气味 密度 溶解性
_____ 气体 _______ 气味 _____ 空气
无色
稍有气味
略小于
难溶于水,易溶于有机溶剂
分子式 电子式
结构式 结构简式
C2H4
CH2=CH2
CH2CH2
六个原子共平面,键角120°
碳原子的价键没有全部被氢原子“饱和”
如何收集?
分子式 乙烷 乙烯
结构式
键的类别
键角
键长(10-10米)
键能(kJ/mol)
空间 各原子的位置
2C和4H在同一平面上
约109 28ˊ
1.54
348
2C和6H不在同一平面上
120
1.33
615
CH2=CH2
CH3-CH3
C—C
C=C
碳碳双键使乙烯变得更稳定还是更活泼?
可旋转
不可旋转
二、乙烯的化学性质
【实验7-2】
(1)点燃纯净的乙烯,观察燃烧时的现象。
(2)将乙烯通入盛有酸性高锰酸钾溶液的试管中,观察现象。
(1)氧化反应
CH2=CH2
+
3O2
点燃
2CO2 + 2H2O
① 燃烧
现象:火焰明亮并伴有黑烟
二、乙烯的化学性质
现象:溶液的紫色褪去
如何鉴别乙烯与乙烷?
【思考】能不能用于除去烷烃中的乙烯?
② 被(酸性KMnO4溶液)氧化
乙烷 乙烯
点燃前需验纯
12KMnO4 +18H2SO4+5C2H4→
12MnSO4+6K2SO4 +10CO2 +28H2O
二、乙烯的化学性质
【实验7-3】
将乙烯通入盛有溴的四氯化碳溶液的试管中,观察现象。
乙烯使溴的四氯化碳褪色
①CH2==CH2 + Br ─Br
CH2 ==CH ─ Br + HBr
?
不溶于水油状液体
无沉淀生成
(2)加成反应
二、乙烯的化学性质
H — C=C — H+Br—Br H — C — C — H
H
H
Br
Br
H
H
碳碳双键中有一个键易断
有机物分子中的不饱和键(双键 或 三键)两端的碳原子与其他原子或原子团直接结合成新化合物的反应叫加成反应。
1, 2—二溴乙烷 ,
无色液体
可否用溴的四氯化碳溶液鉴别乙烷和乙烯?否用溴的四氯化碳除去乙烷中混有的乙烯
溴水可以
下列各反应中属于加成反应的是( )
CH3—CH2—CN
B.H2+Cl2 = 2HCl
光照
AC
写出乙烯与H2、HCl、 H2O在一定条件下反应的化学方程式。
A.CH2=CH2+H—CN
CH2=CH2 + H—Cl
催化剂
△,P
CH3—CH2Cl(氯乙烷)
(2)、加成反应
二、乙烯的化学性质
CH2=CH2+H-H
催化剂
CH2=CH2+H-OH
催化剂
CH2=CH2+H-Cl
催化剂
CH3-CH3
CH3-CH2OH
CH3-CH2Cl
①
②
③
加压、加热
工业制乙烷
工业制乙醇
△
加压、加热
思考:若制备CH3CH2Cl,请选用最合适的途径
CH2=CH2+CH2=CH2+CH2=CH2+…
催化剂
…-CH2 CH2--CH2 CH2--CH2 CH2-…
像这种由不饱和有机物通过加成的方式进行的聚合反应又叫做加成聚合反应,简称加聚反应。
n CH2=CH2
[ CH2—CH2 ]n
催化剂
(聚乙烯)
链节
聚合度
单体
高分子(M>1000)
混合物,无固定熔沸点
说出下列反应的反应类型
①由乙烯制氯乙烷
②乙烷在空气中燃烧
③乙烯使溴水褪色
④乙烯使酸性高锰酸钾溶液褪色
⑤乙烷在光照下与氯气反应
⑥乙烯生成聚乙烯
加成反应
氧化反应
加成反应
氧化反应
取代反应
加聚反应
1、单烯烃分子结构有什么特点?
2、单烯烃的分子式有无通式?
3、烯烃中碳的质量分数如何?
4、单烯烃的物理性质有什么规律?
名称 结构简式 常温时状态 溶沸点 相对密度
乙烯 CH2=CH2 气
丙烯 CH3CH=CH2 气
1—丁烯 CH3CH2CH=CH2 气
1—戊烯 CH3(CH2)2CH=CH2 液
1—己烯 CH3(CH2)3CH=CH2 液
1—庚烯 CH3(CH2)4CH=CH2 液
逐 渐 增 大
逐 渐 增 大
CnH2n
定值
烯烃的化学性质
⑴氧化反应 :
①不彻底氧化 烯烃
KMnO4/H+
CnH2n+ O2→
CO2和H2O的分子数之比为______ (烷烃呢 )
⑵加成反应
丙烯分别与Br2、H2、HBr、H2O反应的方程式
1:1
褪色
3n/2 nCO2+nH2O
⑶加聚反应
丙烯加聚反应的方程式
②彻底氧化
以C4H8为例写出其同分异构体
CH2==CH—CH2—CH3
CH3—C==CH2
︱
CH3
CH3—CH==CH—CH3
碳架异构
位置异构
种类异构
CH2
CH2
CH2
CH2
345 kJ mol—1
265 kJ mol—1
1、概念:含有碳碳叁键的不饱链烃叫做炔烃。
2、炔烃的通式: CnH2n-2 (n≥2)
3、炔烃的通性:
(1)物理性质: (似烷烃)
随着碳原子数的增多,沸点逐渐升高,密度小于1。
C小于等于4时为气态
(2)化学性质:(似乙炔)
能发生氧化反应,加成反应。
三、炔烃
乙烷、乙烯与乙炔结构的对比
分子式 乙烷 乙烯 乙炔
结构特点
特征反应
燃烧现象
高锰酸钾能否褪色
空间各原子的位子
2C和6H不在同一平面上
2C和4H在同一平面上
2C和2H在同一直线上
C==C
C—C
取代
加成、加聚
加成
不能
能
能
淡兰色火焰
明亮火焰、黑烟
明亮火焰、浓烟
(3)、聚合反应
二、乙烯的化学性质
像这样,由相对分子质量小的化合物分子互相结合成相对分子质量大的聚合物的反应叫做聚合反应。聚合反应在有机高分子材料的生产中有着广泛的应用。乙烯的聚合反应同时也是加成反应,这样的反应又被称为加成聚合反应,简称加聚反应。
1、重要的化工原料
2、植物生长调节剂,催熟剂等
除了被用作化工原料,乙烯还是一种植物生长调节剂,可用于催熟果实。在两个透明的塑料袋中各放一个未成熟的水果,向其中的一个袋子里再放一个成熟的水果,将袋口密封,观察并比较水果的变化。请查阅资料,与同学交流,解释以上现象。
【信息搜索】
乙烷与乙烯的分子结构和化学性质对比
分 子 结 构 分子式 C2H6 C2H4
结构式
碳碳键类别 碳碳单键 碳碳双键
分子内原子 的相对位置 C、H不全在一个平面内 6个原子都在同一平面内
【归纳总结】
化 学 性 质 燃烧 2C2H6+7O2 4CO2+6H2O C2H4+3O2 2CO2+2H2O
特征反应 C2H6+Cl2 C2H5Cl+HCl CH2==CH2+Br2
―→CH2BrCH2Br
与酸性高锰 酸钾溶液 不反应 因发生氧化反应而使其褪色
【归纳总结】
乙烯的性质
稍有气味水难溶,高锰酸钾溴反应。
现象相同理不同,前因氧化后加成。
加氧燃烧黑烟冒,聚合分子碳链增。
【归纳总结】
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
