7.3.1 铵盐的性质与应用 课件(17张ppt) 2022-2023学年高一下学期化学苏教版(2020)必修第二册
文档属性
| 名称 | 7.3.1 铵盐的性质与应用 课件(17张ppt) 2022-2023学年高一下学期化学苏教版(2020)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 79.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-09 12:39:20 | ||
图片预览




文档简介
(共17张PPT)
7.3.1 铵盐的性质与应用
学习目标
1.了解铵盐的化学性质与用途
2.掌握铵盐的检验方法
3.掌握实验室制备氨气的方法
一、铵盐的物理性质
1.概念:铵盐是由 和 组成的化合物。
2.物理性质:铵盐是 固体, 。
铵根离子()
酸根离子
白色或无色
易溶于水
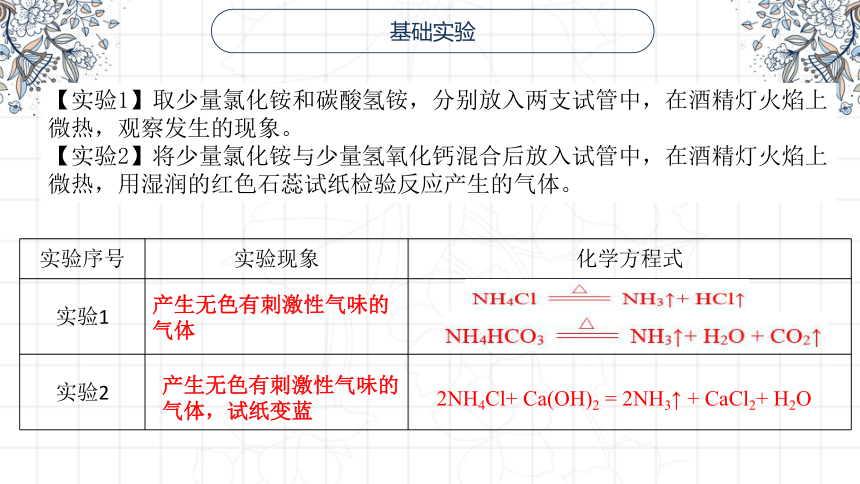
基础实验
【实验1】取少量氯化铵和碳酸氢铵,分别放入两支试管中,在酒精灯火焰上微热,观察发生的现象。
【实验2】将少量氯化铵与少量氢氧化钙混合后放入试管中,在酒精灯火焰上微热,用湿润的红色石蕊试纸检验反应产生的气体。
实验序号 实验现象 化学方程式
实验1
实验2
产生无色有刺激性气味的气体
产生无色有刺激性气味的气体,试纸变蓝
2NH4Cl+ Ca(OH)2 = 2NH3↑ + CaCl2+ H2O
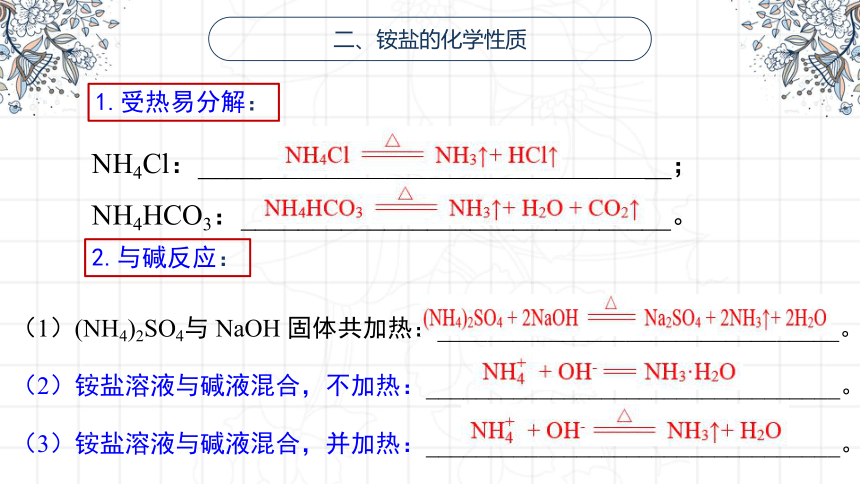
二、铵盐的化学性质
1.受热易分解:
NH4Cl:_________________________________; NH4HCO3:______________________________。
2.与碱反应:
(1)(NH4)2SO4与 NaOH 固体共加热:________________________________。
(2)铵盐溶液与碱液混合,不加热:_________________________________。
(3)铵盐溶液与碱液混合,并加热:_________________________________。
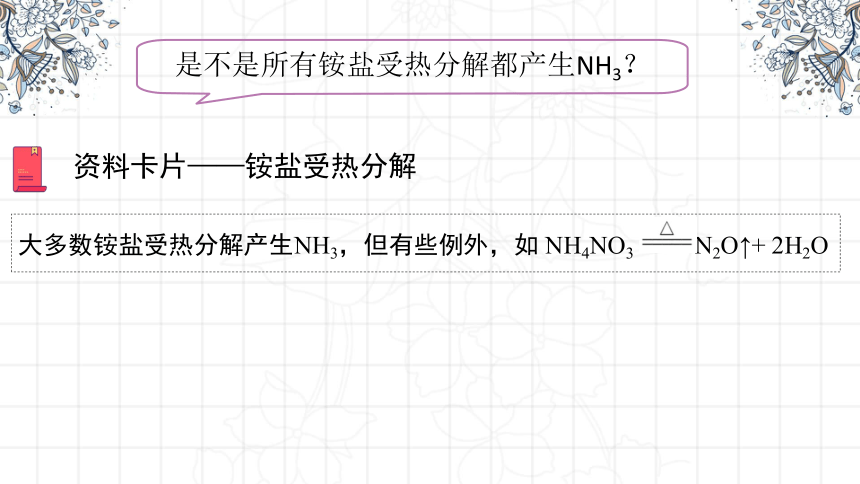
是不是所有铵盐受热分解都产生NH3?
大多数铵盐受热分解产生NH3,但有些例外,如 NH4NO3 N2O↑+ 2H2O
资料卡片——铵盐受热分解
三、铵盐的检验方法
三、铵盐的检验方法
取样于
试管中
加热
加入浓的
NaOH溶液
湿润的红色石蕊试纸,变蓝
蘸有浓盐酸的玻璃棒靠近,产生白烟
四、氨气的实验室制法
四、实验室制取氨气
1.加热 NH4Cl 和 Ca(OH)2
①反应原理:_____________________________________
②收集方法:______排空气法
③验满方法:将湿润的___________________放在试管口
④棉花作用:
_____________________________________________
⑤加热的试管口应_________倾斜,防止_______________________
向下
红色石蕊试纸
减少NH3与空气的对流,吸收多余的NH3,防止污染空气
略向下
水蒸气冷凝回流炸裂试管
四、实验室制取氨气
2.制取NH3的其他常见方法
①加热浓氨水
②将浓氨水滴入NaOH固体或生石灰中
1.能不能直接加热氯化铵固体来制取氨气?
不能,加热氯化铵生成NH3和HCl两种气体,并且在降温后会反应生成氯化铵。
2.为什么用氢氧化钙固体而不是氢氧化钠固体?
铵盐与碱反应的产物中有水,氢氧化钠遇水易潮解,结块。并且强碱容易腐蚀玻璃,所以不用氢氧化钠固体来制取氨气。
课堂小结
课堂练习
1.下列关于铵盐的叙述中正确的是( )
①所有铵盐中氮元素的化合价都是-3价 ②所有铵盐都溶于水
③铵态氮肥不应与草木灰混合使用 ④铵盐都是离子化合物
⑤铵盐都能与碱反应,不能与酸反应
A.①③④ B.②③④
C.①②③④ D.①②③④⑤
B
课堂练习
2.检验试管中盛有的少量白色固体是铵盐的方法是( )
A.加氢氧化钠溶液,加热,用湿润的红色石蕊试纸在试管口检验,看试纸是否变蓝
B.将固体加热,产生的气体通入紫色石蕊试液中,看是否变红
C.加水溶解,用pH试纸测溶液的酸碱性
D.加入氢氧化钠溶液,加热,再滴入酚酞试液
A
作业布置
1.写课本P49的理解应用的第一题
2.预习《常见含氮化肥》和《氮氧化物的无公害处理》
观
看
谢
谢
7.3.1 铵盐的性质与应用
学习目标
1.了解铵盐的化学性质与用途
2.掌握铵盐的检验方法
3.掌握实验室制备氨气的方法
一、铵盐的物理性质
1.概念:铵盐是由 和 组成的化合物。
2.物理性质:铵盐是 固体, 。
铵根离子()
酸根离子
白色或无色
易溶于水
基础实验
【实验1】取少量氯化铵和碳酸氢铵,分别放入两支试管中,在酒精灯火焰上微热,观察发生的现象。
【实验2】将少量氯化铵与少量氢氧化钙混合后放入试管中,在酒精灯火焰上微热,用湿润的红色石蕊试纸检验反应产生的气体。
实验序号 实验现象 化学方程式
实验1
实验2
产生无色有刺激性气味的气体
产生无色有刺激性气味的气体,试纸变蓝
2NH4Cl+ Ca(OH)2 = 2NH3↑ + CaCl2+ H2O
二、铵盐的化学性质
1.受热易分解:
NH4Cl:_________________________________; NH4HCO3:______________________________。
2.与碱反应:
(1)(NH4)2SO4与 NaOH 固体共加热:________________________________。
(2)铵盐溶液与碱液混合,不加热:_________________________________。
(3)铵盐溶液与碱液混合,并加热:_________________________________。
是不是所有铵盐受热分解都产生NH3?
大多数铵盐受热分解产生NH3,但有些例外,如 NH4NO3 N2O↑+ 2H2O
资料卡片——铵盐受热分解
三、铵盐的检验方法
三、铵盐的检验方法
取样于
试管中
加热
加入浓的
NaOH溶液
湿润的红色石蕊试纸,变蓝
蘸有浓盐酸的玻璃棒靠近,产生白烟
四、氨气的实验室制法
四、实验室制取氨气
1.加热 NH4Cl 和 Ca(OH)2
①反应原理:_____________________________________
②收集方法:______排空气法
③验满方法:将湿润的___________________放在试管口
④棉花作用:
_____________________________________________
⑤加热的试管口应_________倾斜,防止_______________________
向下
红色石蕊试纸
减少NH3与空气的对流,吸收多余的NH3,防止污染空气
略向下
水蒸气冷凝回流炸裂试管
四、实验室制取氨气
2.制取NH3的其他常见方法
①加热浓氨水
②将浓氨水滴入NaOH固体或生石灰中
1.能不能直接加热氯化铵固体来制取氨气?
不能,加热氯化铵生成NH3和HCl两种气体,并且在降温后会反应生成氯化铵。
2.为什么用氢氧化钙固体而不是氢氧化钠固体?
铵盐与碱反应的产物中有水,氢氧化钠遇水易潮解,结块。并且强碱容易腐蚀玻璃,所以不用氢氧化钠固体来制取氨气。
课堂小结
课堂练习
1.下列关于铵盐的叙述中正确的是( )
①所有铵盐中氮元素的化合价都是-3价 ②所有铵盐都溶于水
③铵态氮肥不应与草木灰混合使用 ④铵盐都是离子化合物
⑤铵盐都能与碱反应,不能与酸反应
A.①③④ B.②③④
C.①②③④ D.①②③④⑤
B
课堂练习
2.检验试管中盛有的少量白色固体是铵盐的方法是( )
A.加氢氧化钠溶液,加热,用湿润的红色石蕊试纸在试管口检验,看试纸是否变蓝
B.将固体加热,产生的气体通入紫色石蕊试液中,看是否变红
C.加水溶解,用pH试纸测溶液的酸碱性
D.加入氢氧化钠溶液,加热,再滴入酚酞试液
A
作业布置
1.写课本P49的理解应用的第一题
2.预习《常见含氮化肥》和《氮氧化物的无公害处理》
观
看
谢
谢
