1.1.1原子结构 能层与能级 基态与激发态 课件(21张ppt) 2022-2023学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 1.1.1原子结构 能层与能级 基态与激发态 课件(21张ppt) 2022-2023学年高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 12.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-09 12:42:57 | ||
图片预览





文档简介
(共21张PPT)
近代原子论
发现电子
带核原子结构模型
轨道原子结构模型
电子云模型
1803
1904
1911
1913
1926
德谟克利特:朴素原子观
道尔顿:原子学说
汤姆生:“葡萄干面包式” 模型
卢瑟福:带核原子结构模型
玻尔:原子轨道模型
现代量子力学模型
【回顾】原子结构模型的演变
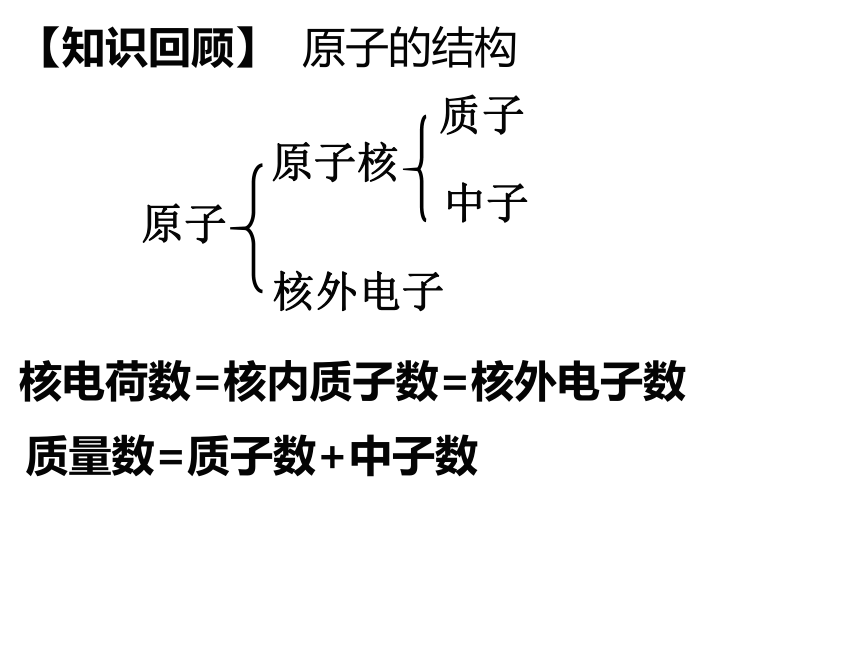
原子
原子核
核外电子
质子
中子
核电荷数=核内质子数=核外电子数
质量数=质子数+中子数
【知识回顾】 原子的结构
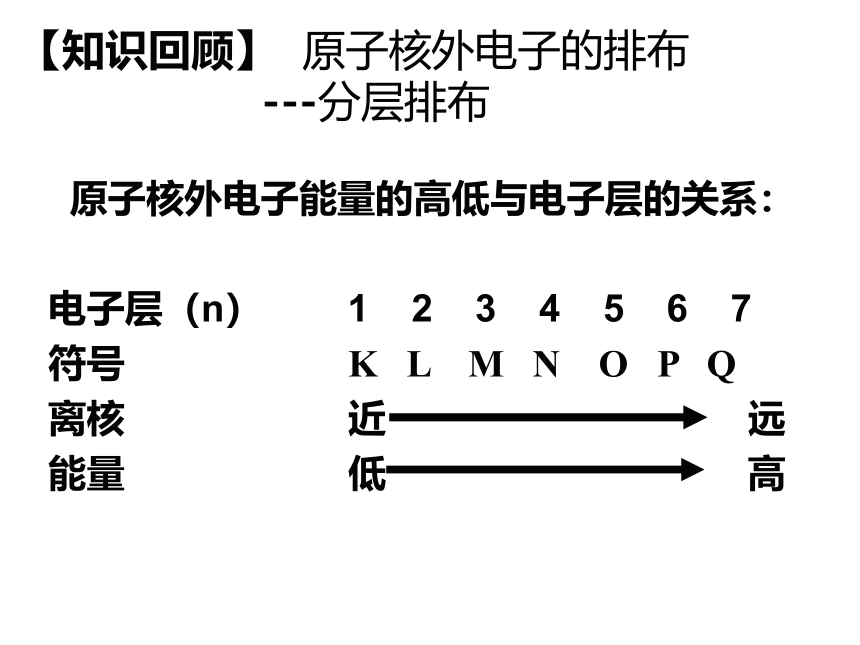
【知识回顾】 原子核外电子的排布
---分层排布
原子核外电子能量的高低与电子层的关系:
电子层(n) 1 2 3 4 5 6 7
符号 K L M N O P Q
离核 近 远
能量 低 高
核外电子总是尽先排布在离核最近、能量最低的电子层里,然后由里到外,依次排布在能量逐步升高的电子层里。
(既先排K层,再排L层、M层等)
【知识回顾】 原子核外电子的排布
---排布顺序(能量最低原理)
(1)各电子层最多容纳的电子数目为2n2
(2)最外层不超过8个电子(K层不超过2)
(3)次外层电子数目不超过18个 (L层不超过8)
倒数第三层电子数目不超过32个
【知识回顾】 原子核外电子的排布
---各层容量(规律)
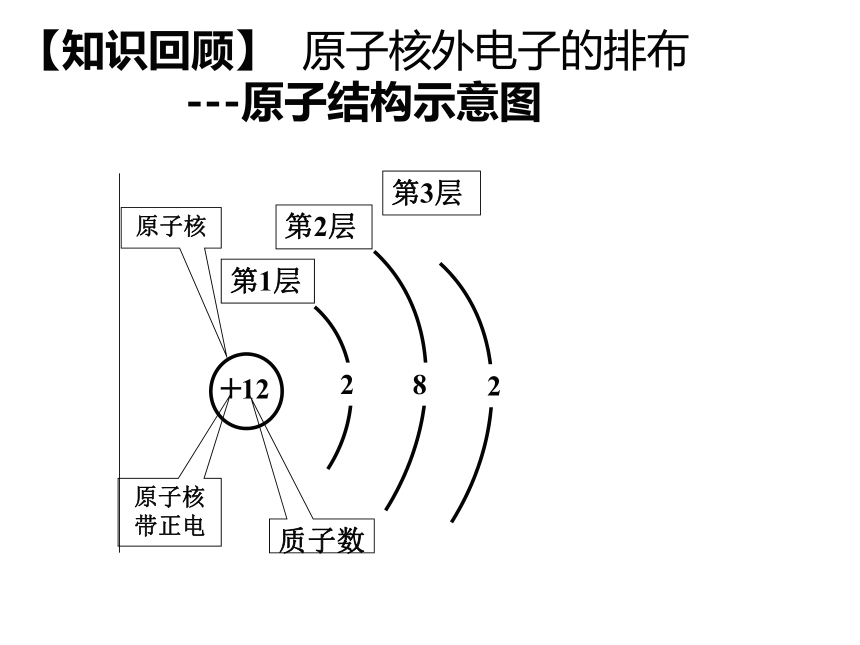
【知识回顾】 原子核外电子的排布
---原子结构示意图
+
12
第1层
第2层
第3层
2
8
2
原子核
原子核带正电
质子数
第一节
原子结构
第一章 原子结构与性质
能层与能级 基态与激发态
能层 1 2 3 4 5 6 7
符号 K L M N O P Q
最多电子数
一、能层与能级
1、能层(电子层):
按电子能量的高低及离核远近划分
2
8
18
32
50
72
98
能量高低:
E(K)2n2
能层 K L M N O 能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p ┅┉
最多电子数 2 2 6 2 6 10 2 6 10 14 2 6
2、能级(电子亚层):
同一能层电子的能量也不相同,分成不同的能级。(s、p、d、f)
同一能层各能级的能量顺序:
E(ns)【思考与讨论】 P7
1、一个能层的能级数与能层序数(n)间存在什么关系?一个能层最多可容纳的电子数与能层序数(n)间存在什么关系?
能层的能级数与能层序数(n)相等;
2、以s、p、d、f为符号的能级分别可容纳多少个电子?3d、4d、5d能级所容纳的最多电子数是否相同?
自然数中奇数序列的2倍;相同。
一个能层最多可容纳的电子数2n2个。
【思考与讨论】 P7
3、第五能层最多可容纳多少个电子?它们分别容纳在几个能级中?各能级最多容纳多少个电子?(注:高于f的能级不用符号表示。)
50;
5个;
2、6、10、14、18。
1.判断正误
( )(1)2d表示L层上的d能级
( )(2)同一原子中,1s、2s、3s电子的能量逐渐减小
( )(3)4s、4p、4d、4f能量的高低顺序为E(4s)<E(4p)<E(4d)<E(4f)
【练习】
×
×
( )2.若n=3,以下能级符号错误的是
A.np B.nf C.nd D.ns
( )3.下列有关认识中正确的是
A.在同一能层不同能级上的电子,其能量肯定不同
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n-1
D.各能层含有的电子数为2n2
B
A
二、基态与激发态 原子光谱
1.基态原子:
处于最低能量状态的原子。
2.激发态原子:
基态原子 能量,它的电子会跃迁到 能级,变为激发态原子。
吸收
较高
3、基态、激发态相互间转化的能量变化:
基态原子 激发态原子
释放能量,主要形式为光(辐射)
吸收能量
4.光谱的成因及分类
5、光谱分析:
在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
【阅读】 P7-8 第一段及图1-4
【练习】
4.判断正误
( )(1)光(辐射)是电子跃迁释放能量的重要形式之一
( )(2)霓虹灯光、激光、萤光都与原子核外电子跃迁吸收能量有关
( )(3)产生激光的前提是原子要处于激发态
( )(4)电子跃迁时只吸收能量
( )(5)同一原子处于激发态时的能量一定高于基态时的能量
( )(6)激发态原子的能量较高,极易失去电子,表现出较强的还原性
×
×
×
1、能层(电子层):
K、L、M、N、O、P、Q
【小结】
2、能级(电子亚层):
s、p、d、f
3.光谱的成因及分类
近代原子论
发现电子
带核原子结构模型
轨道原子结构模型
电子云模型
1803
1904
1911
1913
1926
德谟克利特:朴素原子观
道尔顿:原子学说
汤姆生:“葡萄干面包式” 模型
卢瑟福:带核原子结构模型
玻尔:原子轨道模型
现代量子力学模型
【回顾】原子结构模型的演变
原子
原子核
核外电子
质子
中子
核电荷数=核内质子数=核外电子数
质量数=质子数+中子数
【知识回顾】 原子的结构
【知识回顾】 原子核外电子的排布
---分层排布
原子核外电子能量的高低与电子层的关系:
电子层(n) 1 2 3 4 5 6 7
符号 K L M N O P Q
离核 近 远
能量 低 高
核外电子总是尽先排布在离核最近、能量最低的电子层里,然后由里到外,依次排布在能量逐步升高的电子层里。
(既先排K层,再排L层、M层等)
【知识回顾】 原子核外电子的排布
---排布顺序(能量最低原理)
(1)各电子层最多容纳的电子数目为2n2
(2)最外层不超过8个电子(K层不超过2)
(3)次外层电子数目不超过18个 (L层不超过8)
倒数第三层电子数目不超过32个
【知识回顾】 原子核外电子的排布
---各层容量(规律)
【知识回顾】 原子核外电子的排布
---原子结构示意图
+
12
第1层
第2层
第3层
2
8
2
原子核
原子核带正电
质子数
第一节
原子结构
第一章 原子结构与性质
能层与能级 基态与激发态
能层 1 2 3 4 5 6 7
符号 K L M N O P Q
最多电子数
一、能层与能级
1、能层(电子层):
按电子能量的高低及离核远近划分
2
8
18
32
50
72
98
能量高低:
E(K)
能层 K L M N O 能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p ┅┉
最多电子数 2 2 6 2 6 10 2 6 10 14 2 6
2、能级(电子亚层):
同一能层电子的能量也不相同,分成不同的能级。(s、p、d、f)
同一能层各能级的能量顺序:
E(ns)
1、一个能层的能级数与能层序数(n)间存在什么关系?一个能层最多可容纳的电子数与能层序数(n)间存在什么关系?
能层的能级数与能层序数(n)相等;
2、以s、p、d、f为符号的能级分别可容纳多少个电子?3d、4d、5d能级所容纳的最多电子数是否相同?
自然数中奇数序列的2倍;相同。
一个能层最多可容纳的电子数2n2个。
【思考与讨论】 P7
3、第五能层最多可容纳多少个电子?它们分别容纳在几个能级中?各能级最多容纳多少个电子?(注:高于f的能级不用符号表示。)
50;
5个;
2、6、10、14、18。
1.判断正误
( )(1)2d表示L层上的d能级
( )(2)同一原子中,1s、2s、3s电子的能量逐渐减小
( )(3)4s、4p、4d、4f能量的高低顺序为E(4s)<E(4p)<E(4d)<E(4f)
【练习】
×
×
( )2.若n=3,以下能级符号错误的是
A.np B.nf C.nd D.ns
( )3.下列有关认识中正确的是
A.在同一能层不同能级上的电子,其能量肯定不同
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n-1
D.各能层含有的电子数为2n2
B
A
二、基态与激发态 原子光谱
1.基态原子:
处于最低能量状态的原子。
2.激发态原子:
基态原子 能量,它的电子会跃迁到 能级,变为激发态原子。
吸收
较高
3、基态、激发态相互间转化的能量变化:
基态原子 激发态原子
释放能量,主要形式为光(辐射)
吸收能量
4.光谱的成因及分类
5、光谱分析:
在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
【阅读】 P7-8 第一段及图1-4
【练习】
4.判断正误
( )(1)光(辐射)是电子跃迁释放能量的重要形式之一
( )(2)霓虹灯光、激光、萤光都与原子核外电子跃迁吸收能量有关
( )(3)产生激光的前提是原子要处于激发态
( )(4)电子跃迁时只吸收能量
( )(5)同一原子处于激发态时的能量一定高于基态时的能量
( )(6)激发态原子的能量较高,极易失去电子,表现出较强的还原性
×
×
×
1、能层(电子层):
K、L、M、N、O、P、Q
【小结】
2、能级(电子亚层):
s、p、d、f
3.光谱的成因及分类
