7.2.2 硝酸的性质与用途 课件(18张ppt) 2022-2023学年高一下学期化学苏教版(2020)必修第二册
文档属性
| 名称 | 7.2.2 硝酸的性质与用途 课件(18张ppt) 2022-2023学年高一下学期化学苏教版(2020)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 8.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-09 12:45:38 | ||
图片预览




文档简介
(共18张PPT)
2.2.2 硝酸的性质与用途
学习目标
1.了解工业制备硝酸的方法。
2.掌握硝酸的性质与用途
3.掌握浓硝酸的性质
课前导入
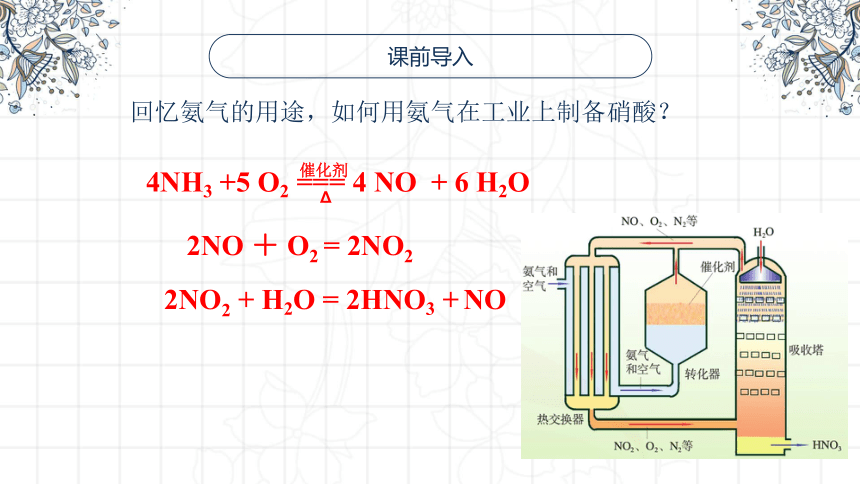
回忆氨气的用途,如何用氨气在工业上制备硝酸?
4NH3 +5 O2 === 4 NO + 6 H2O
催化剂
Δ
2NO + O2 = 2NO2
2NO2 + H2O = 2HNO3 + NO
一、硝酸的物理性质
颜色 气味 状态 溶解度 特性
有刺激性气味
无色
液体
极易溶
易挥发
市售浓硝酸的质量分数约为69%
放置后显黄色
二、硝酸的化学性质
1.不稳定性:
见光或受热分解
思考
如何去除黄色,怎样保存硝酸呢?
向硝酸缓慢通入O2,能消除黄色,原理:
4NO2 + O2 + 2H2O = 4HNO3
硝酸密封贮存棕色细口瓶,并置于低温、避光处。
基础实验
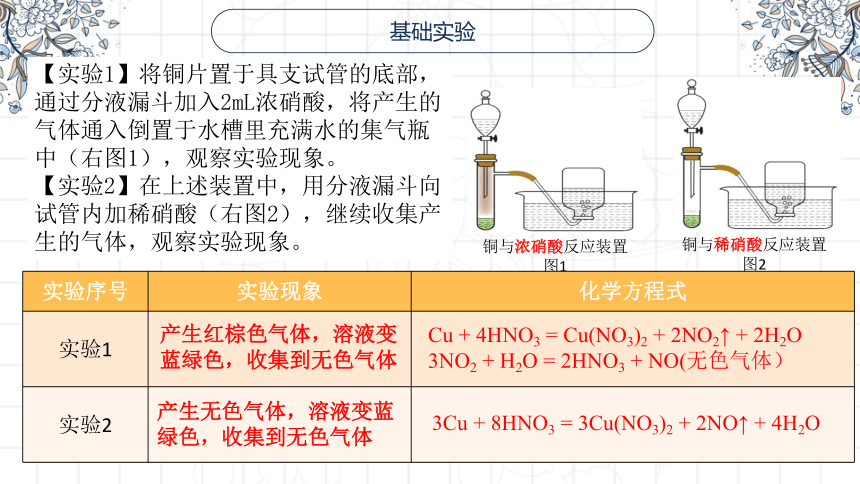
铜与浓硝酸反应装置
图1
铜与稀硝酸反应装置
图2
【实验1】将铜片置于具支试管的底部,通过分液漏斗加入2mL浓硝酸,将产生的气体通入倒置于水槽里充满水的集气瓶中(右图1),观察实验现象。
【实验2】在上述装置中,用分液漏斗向试管内加稀硝酸(右图2),继续收集产生的气体,观察实验现象。
实验序号 实验现象 化学方程式
实验1
实验2
产生红棕色气体,溶液变蓝绿色,收集到无色气体
Cu + 4HNO3 = Cu(NO3)2 + 2NO2↑ + 2H2O
3NO2 + H2O = 2HNO3 + NO(无色气体)
产生无色气体,溶液变蓝绿色,收集到无色气体
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
二、硝酸的化学性质
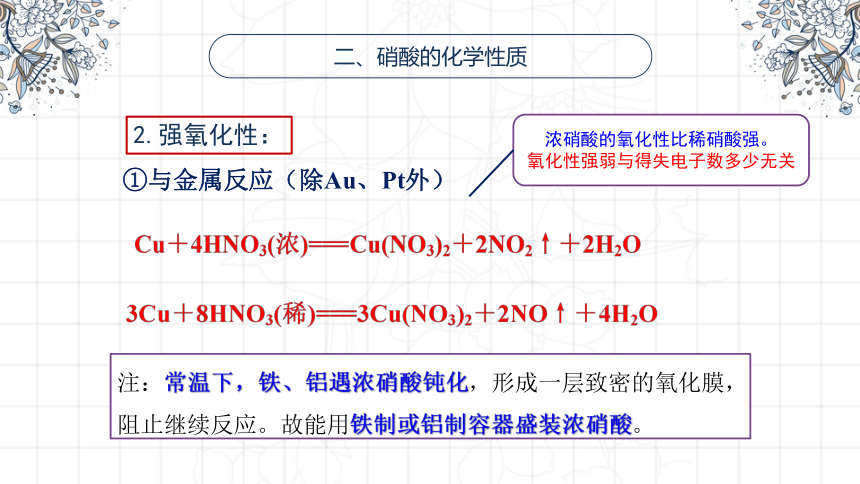
2.强氧化性:
①与金属反应(除Au、Pt外)
注:常温下,铁、铝遇浓硝酸钝化,形成一层致密的氧化膜,阻止继续反应。故能用铁制或铝制容器盛装浓硝酸。
浓硝酸的氧化性比稀硝酸强。
氧化性强弱与得失电子数多少无关
基础实验
实验步骤:
实验现象
实验结论
木炭与浓硝酸反应
产生红棕色气体
C + 4HNO3(浓) = CO2 ↑+ 4NO2↑ + 2H2O
Δ
②与非金属反应
浓硝酸与非金属反应时,还原产物一般为NO2
硝酸的强氧化性
①硝酸的浓度越大,反应温度越高,其氧化性越强。
②硝酸能与绝大多数金属反应,除了金Au和铂Pt。
③活泼金属与硝酸反应不生成H2,硝酸的浓度不同,还原产物不同;
④常温下,浓硝酸能使Fe、Al钝化。
⑤浓硝酸与非金属反应时,还原产物一般为NO2
二、硝酸的化学性质
③与还原性物质反应
硝酸的强氧化性还表现在可以氧化具有还原性的化合物或离子,如HI、HBr、SO2、Fe2+、FeO、Br-、I-、S2-、SO32-等均能被HNO3氧化。
3Fe2+ + 4H+ + NO3- = 3Fe3+ + NO↑ + 2H2O
二、硝酸的化学性质
3.酸性:
(1)与碱反应
NaOH + HNO3 = NaNO3 + H2O
CaO + 2HNO3 = Ca(NO3)2 + H2O
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O
(2)与碱性氧化物反应
Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O
三、硝酸的用途
硝酸是一种重要的化工原料,常用来制造氮肥、燃料、塑料、炸药、硝酸盐等。
氮 肥
黄色炸药
染 料
课堂小结
课堂练习
1.在实验室里,应当储存在棕色试剂瓶中的试剂是( )
A.浓硝酸 B.浓盐酸
C.浓硫酸 D.氯化钠
A
课堂练习
2.下列关于浓硫酸与浓硝酸的叙述不正确的是( )
A.敞口久置,两者浓度均会变小
B.常温下,均会使铝、铁钝化
C.敞口久置,两者质量均会变大
D.均具有强氧化性
C
课堂练习
3.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,
下列叙述正确的是( )
A.反应剧烈程度:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
B
作业布置
1.写课本P43的第5题和第6题
观
看
谢
谢
2.2.2 硝酸的性质与用途
学习目标
1.了解工业制备硝酸的方法。
2.掌握硝酸的性质与用途
3.掌握浓硝酸的性质
课前导入
回忆氨气的用途,如何用氨气在工业上制备硝酸?
4NH3 +5 O2 === 4 NO + 6 H2O
催化剂
Δ
2NO + O2 = 2NO2
2NO2 + H2O = 2HNO3 + NO
一、硝酸的物理性质
颜色 气味 状态 溶解度 特性
有刺激性气味
无色
液体
极易溶
易挥发
市售浓硝酸的质量分数约为69%
放置后显黄色
二、硝酸的化学性质
1.不稳定性:
见光或受热分解
思考
如何去除黄色,怎样保存硝酸呢?
向硝酸缓慢通入O2,能消除黄色,原理:
4NO2 + O2 + 2H2O = 4HNO3
硝酸密封贮存棕色细口瓶,并置于低温、避光处。
基础实验
铜与浓硝酸反应装置
图1
铜与稀硝酸反应装置
图2
【实验1】将铜片置于具支试管的底部,通过分液漏斗加入2mL浓硝酸,将产生的气体通入倒置于水槽里充满水的集气瓶中(右图1),观察实验现象。
【实验2】在上述装置中,用分液漏斗向试管内加稀硝酸(右图2),继续收集产生的气体,观察实验现象。
实验序号 实验现象 化学方程式
实验1
实验2
产生红棕色气体,溶液变蓝绿色,收集到无色气体
Cu + 4HNO3 = Cu(NO3)2 + 2NO2↑ + 2H2O
3NO2 + H2O = 2HNO3 + NO(无色气体)
产生无色气体,溶液变蓝绿色,收集到无色气体
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
二、硝酸的化学性质
2.强氧化性:
①与金属反应(除Au、Pt外)
注:常温下,铁、铝遇浓硝酸钝化,形成一层致密的氧化膜,阻止继续反应。故能用铁制或铝制容器盛装浓硝酸。
浓硝酸的氧化性比稀硝酸强。
氧化性强弱与得失电子数多少无关
基础实验
实验步骤:
实验现象
实验结论
木炭与浓硝酸反应
产生红棕色气体
C + 4HNO3(浓) = CO2 ↑+ 4NO2↑ + 2H2O
Δ
②与非金属反应
浓硝酸与非金属反应时,还原产物一般为NO2
硝酸的强氧化性
①硝酸的浓度越大,反应温度越高,其氧化性越强。
②硝酸能与绝大多数金属反应,除了金Au和铂Pt。
③活泼金属与硝酸反应不生成H2,硝酸的浓度不同,还原产物不同;
④常温下,浓硝酸能使Fe、Al钝化。
⑤浓硝酸与非金属反应时,还原产物一般为NO2
二、硝酸的化学性质
③与还原性物质反应
硝酸的强氧化性还表现在可以氧化具有还原性的化合物或离子,如HI、HBr、SO2、Fe2+、FeO、Br-、I-、S2-、SO32-等均能被HNO3氧化。
3Fe2+ + 4H+ + NO3- = 3Fe3+ + NO↑ + 2H2O
二、硝酸的化学性质
3.酸性:
(1)与碱反应
NaOH + HNO3 = NaNO3 + H2O
CaO + 2HNO3 = Ca(NO3)2 + H2O
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O
(2)与碱性氧化物反应
Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O
三、硝酸的用途
硝酸是一种重要的化工原料,常用来制造氮肥、燃料、塑料、炸药、硝酸盐等。
氮 肥
黄色炸药
染 料
课堂小结
课堂练习
1.在实验室里,应当储存在棕色试剂瓶中的试剂是( )
A.浓硝酸 B.浓盐酸
C.浓硫酸 D.氯化钠
A
课堂练习
2.下列关于浓硫酸与浓硝酸的叙述不正确的是( )
A.敞口久置,两者浓度均会变小
B.常温下,均会使铝、铁钝化
C.敞口久置,两者质量均会变大
D.均具有强氧化性
C
课堂练习
3.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,
下列叙述正确的是( )
A.反应剧烈程度:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
B
作业布置
1.写课本P43的第5题和第6题
观
看
谢
谢
