9.2.1 铁及其化合物转化反应的合理选择 课件(26张ppt) 2022-2023学年高一下学期化学苏教版(2020)必修第二册
文档属性
| 名称 | 9.2.1 铁及其化合物转化反应的合理选择 课件(26张ppt) 2022-2023学年高一下学期化学苏教版(2020)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 23.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-09 12:50:58 | ||
图片预览






文档简介
(共26张PPT)
9.2.1 反应的合理选择
学习目标
1.了解常见的铁的化合物
2.能够设计金属及其化合物的转化思路
3.学会三价铁离子的检验方法
课前导入
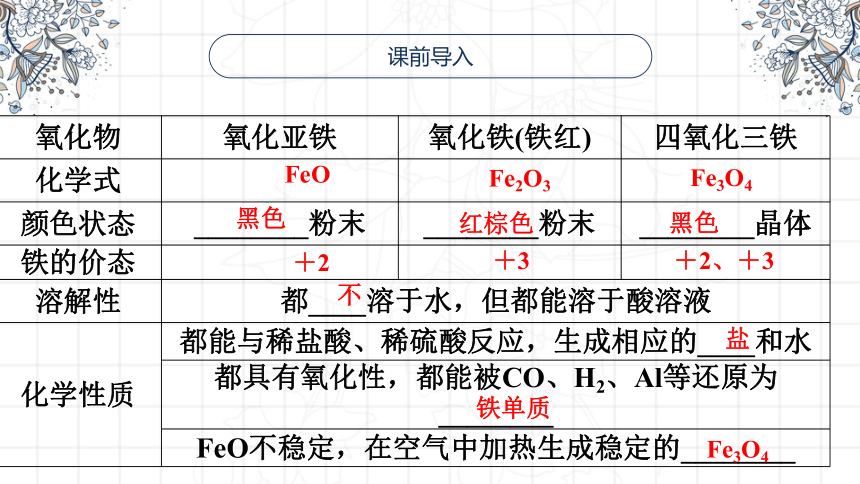
氧化物 氧化亚铁 氧化铁(铁红) 四氧化三铁
化学式
颜色状态 ________粉末 ________粉末 ________晶体
铁的价态
溶解性 都____溶于水,但都能溶于酸溶液 化学性质 都能与稀盐酸、稀硫酸反应,生成相应的____和水 都具有氧化性,都能被CO、H2、Al等还原为________ FeO不稳定,在空气中加热生成稳定的________ FeO
Fe2O3
Fe3O4
黑色
红棕色
黑色
+2
+3
+2、+3
不
盐
铁单质
Fe3O4
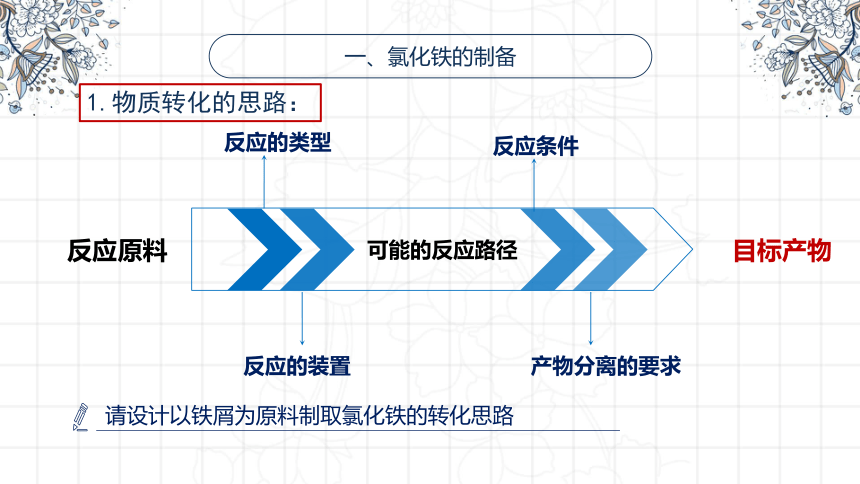
一、氯化铁的制备
1.物质转化的思路:
反应的类型
反应条件
反应的装置
产物分离的要求
反应原料
目标产物
可能的反应路径
请设计以铁屑为原料制取氯化铁的转化思路
一、氯化铁的制备
1.物质转化的思路:
Fe
FeCl3
在氯气中点燃
路径一
从反应炉中排出并经冷凝得到固体FeCl3
2Fe+3Cl2=== 2FeCl3
点燃
Fe
FeCl3
盐酸溶解铁
路径二
FeCl2
Fe+2HCl== FeCl2+H2↑
2FeCl2+Cl2===2FeCl3
氯气氧化后分离提纯
Fe
FeCl3
缓慢氧化
路径三
Fe2O3
盐酸溶解后分离提纯
4Fe+3O2==2Fe2O3
Fe2O3 +6HCl ==2FeCl3+3H2O
一、氯化铁的制备
1.合理选择反应的思路
(1)确定产物:明确目标 是什么。
(2)选择原料和反应路径:依据产物特性选择反应 和可能的反应路径,确定反应类型和 。
(3)选择反应装置:依据发生的化学反应和产物 的要求合理的选择反应的 。
产物
原料
反应条件
分离
装置
一、氯化铁的制备
2.金属及其化合物之间的转化方式:
①相同价态物质之间
通过非氧化还原反应实现相同价态物质之间的转换
②不同价态物质之间
通过氧化还原反应实现相同价态物质之间的转换
一、氯化铁的制备
3.Fe3+的检验方法:
一、氯化铁的制备
3.Fe3+的检验方法:
方法 Fe3+
(1)观摩法
(2)加碱法 (NaOH)
(3)加盐法 (KSCN溶液)
FeCl3溶液为棕黄色
现象:红褐色沉淀
Fe3++3OH-===Fe(OH)3↓
现象:溶液变血红色
Fe3++3SCN-===Fe(SCN)3(红色)
所有二价铁离子(Fe )的自由离子都是绿色的
所有三价铁离子(Fe )的自由离子都是黄色的
一、氯化铁的制备
FeCl3溶液
黄色褪去
无明显变化
血红色溶液
铁粉
①
氯水
③
KSCN溶液
②
①Fe3+→Fe2+
2Fe3++Fe === 3Fe2+
②Fe2+
③Fe2+→Fe3+
(FeCl2溶液)
Fe2+与KSCN溶液无明显变化
2Fe2++Cl2 === 2Fe3++2Cl-
Fe3++3SCN-===Fe(SCN)3
实验现象及原理
一、氯化铁的制备
思考
如果铁粉过量,将溶液为红色的试管震荡,有什么现象?
红色退去,溶液变为浅绿色
2Fe3++Fe === 3Fe2+
一、氯化铁的制备
思考
如何证明一个未知溶液中含有Fe2+,而不含有Fe3+?
待测液 不变色 血红色
KSCN溶液
氧化剂
氧化剂可以是哪些物质?
双氧水:2Fe2++H2O2+2H+===2Fe3++2H2O
新制氯水或氯气:2Fe2++Cl2 === 2Fe3++2Cl-
氧化剂还可以是:KMnO4(H+)、O2、 HNO3等
一、氯化铁的制备
思考
能否用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2?
Fe2+和Cl-均具有还原性,且还原性:Fe2+大于Cl-,酸性KMnO4溶液会优先氧化Fe2+;
但浓度较大的Cl-也能使酸性KMnO4溶液褪色。
二、铁及化合物的转换
在生产和科学实验中,要实现单质铁、+2价的亚铁盐、+3价的铁盐之间的相互转化,可以选择适当的氧化剂或还原剂。
具有还原性
具有氧化性
既有氧化性
又有还原性
② Fe→ Fe3+
Fe+2H+===Fe2++H2↑
Fe+ Cu2+ ===Fe2++ Cu
2Fe+3Cl2 === 2FeCl3
点燃
① Fe→ Fe2+
② Fe2+→ Fe
①Fe2+→ Fe3+
2Fe2++H2O2+2H+ === 2Fe3++2H2O
2Fe2++Cl2 === 2Fe3++2Cl-
FeO+CO === Fe+CO2
高温
氯化铁分别与铜单质、碘化钾反应
②Fe3+→ Fe2+
① Fe3+→ Fe
2Fe3++Fe === 3Fe2+
2Fe3++Cu === 2Fe2++Cu2+
Fe2O3 +3CO === 2Fe+3CO2
高温
Fe2O3 +2Al === 2Fe+Al2O3
高温
2Fe3++2I- === 2Fe2++I2
应用:制造电路板
2Fe3++Cu === 2Fe2++Cu2+
蚀刻液
——氯化铁溶液
课堂小结
课堂练习
1.要证明某溶液中不含有Fe3+而含有Fe2+,进行如下实验时的最佳操作及顺序为( )
①加入少量KSCN溶液 ②加入适量氯水 ③加入足量的高锰酸钾溶液
A.③① B.①②
C.②③ D.①②③
B
课堂练习
2.下列氯化物既可由金属和氯气直接反应制得,也可由金属和盐酸反应制得的是( )
A.ZnCl2 B.FeCl3
C.FeCl2 D.AlCl3
AD
课堂练习
3.下列物质能将Fe2+氧化为Fe3+,且能使单质Fe由0价变为+3价的是( )
A.氢气 B.氯气
C.浓盐酸 D.稀硫酸
B
课堂练习
4.(2021·广东等级考,10)部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是 ( )
A.a可与e反应生成b
B.b既可被氧化,也可被还原
C.可将e加入浓碱液中制得d的胶体
D.可存在b→c→d→e→b的循环转化关系
C
作业布置
1.预习第二课时《导与练》P88~90
观
看
谢
谢
9.2.1 反应的合理选择
学习目标
1.了解常见的铁的化合物
2.能够设计金属及其化合物的转化思路
3.学会三价铁离子的检验方法
课前导入
氧化物 氧化亚铁 氧化铁(铁红) 四氧化三铁
化学式
颜色状态 ________粉末 ________粉末 ________晶体
铁的价态
溶解性 都____溶于水,但都能溶于酸溶液 化学性质 都能与稀盐酸、稀硫酸反应,生成相应的____和水 都具有氧化性,都能被CO、H2、Al等还原为________ FeO不稳定,在空气中加热生成稳定的________ FeO
Fe2O3
Fe3O4
黑色
红棕色
黑色
+2
+3
+2、+3
不
盐
铁单质
Fe3O4
一、氯化铁的制备
1.物质转化的思路:
反应的类型
反应条件
反应的装置
产物分离的要求
反应原料
目标产物
可能的反应路径
请设计以铁屑为原料制取氯化铁的转化思路
一、氯化铁的制备
1.物质转化的思路:
Fe
FeCl3
在氯气中点燃
路径一
从反应炉中排出并经冷凝得到固体FeCl3
2Fe+3Cl2=== 2FeCl3
点燃
Fe
FeCl3
盐酸溶解铁
路径二
FeCl2
Fe+2HCl== FeCl2+H2↑
2FeCl2+Cl2===2FeCl3
氯气氧化后分离提纯
Fe
FeCl3
缓慢氧化
路径三
Fe2O3
盐酸溶解后分离提纯
4Fe+3O2==2Fe2O3
Fe2O3 +6HCl ==2FeCl3+3H2O
一、氯化铁的制备
1.合理选择反应的思路
(1)确定产物:明确目标 是什么。
(2)选择原料和反应路径:依据产物特性选择反应 和可能的反应路径,确定反应类型和 。
(3)选择反应装置:依据发生的化学反应和产物 的要求合理的选择反应的 。
产物
原料
反应条件
分离
装置
一、氯化铁的制备
2.金属及其化合物之间的转化方式:
①相同价态物质之间
通过非氧化还原反应实现相同价态物质之间的转换
②不同价态物质之间
通过氧化还原反应实现相同价态物质之间的转换
一、氯化铁的制备
3.Fe3+的检验方法:
一、氯化铁的制备
3.Fe3+的检验方法:
方法 Fe3+
(1)观摩法
(2)加碱法 (NaOH)
(3)加盐法 (KSCN溶液)
FeCl3溶液为棕黄色
现象:红褐色沉淀
Fe3++3OH-===Fe(OH)3↓
现象:溶液变血红色
Fe3++3SCN-===Fe(SCN)3(红色)
所有二价铁离子(Fe )的自由离子都是绿色的
所有三价铁离子(Fe )的自由离子都是黄色的
一、氯化铁的制备
FeCl3溶液
黄色褪去
无明显变化
血红色溶液
铁粉
①
氯水
③
KSCN溶液
②
①Fe3+→Fe2+
2Fe3++Fe === 3Fe2+
②Fe2+
③Fe2+→Fe3+
(FeCl2溶液)
Fe2+与KSCN溶液无明显变化
2Fe2++Cl2 === 2Fe3++2Cl-
Fe3++3SCN-===Fe(SCN)3
实验现象及原理
一、氯化铁的制备
思考
如果铁粉过量,将溶液为红色的试管震荡,有什么现象?
红色退去,溶液变为浅绿色
2Fe3++Fe === 3Fe2+
一、氯化铁的制备
思考
如何证明一个未知溶液中含有Fe2+,而不含有Fe3+?
待测液 不变色 血红色
KSCN溶液
氧化剂
氧化剂可以是哪些物质?
双氧水:2Fe2++H2O2+2H+===2Fe3++2H2O
新制氯水或氯气:2Fe2++Cl2 === 2Fe3++2Cl-
氧化剂还可以是:KMnO4(H+)、O2、 HNO3等
一、氯化铁的制备
思考
能否用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2?
Fe2+和Cl-均具有还原性,且还原性:Fe2+大于Cl-,酸性KMnO4溶液会优先氧化Fe2+;
但浓度较大的Cl-也能使酸性KMnO4溶液褪色。
二、铁及化合物的转换
在生产和科学实验中,要实现单质铁、+2价的亚铁盐、+3价的铁盐之间的相互转化,可以选择适当的氧化剂或还原剂。
具有还原性
具有氧化性
既有氧化性
又有还原性
② Fe→ Fe3+
Fe+2H+===Fe2++H2↑
Fe+ Cu2+ ===Fe2++ Cu
2Fe+3Cl2 === 2FeCl3
点燃
① Fe→ Fe2+
② Fe2+→ Fe
①Fe2+→ Fe3+
2Fe2++H2O2+2H+ === 2Fe3++2H2O
2Fe2++Cl2 === 2Fe3++2Cl-
FeO+CO === Fe+CO2
高温
氯化铁分别与铜单质、碘化钾反应
②Fe3+→ Fe2+
① Fe3+→ Fe
2Fe3++Fe === 3Fe2+
2Fe3++Cu === 2Fe2++Cu2+
Fe2O3 +3CO === 2Fe+3CO2
高温
Fe2O3 +2Al === 2Fe+Al2O3
高温
2Fe3++2I- === 2Fe2++I2
应用:制造电路板
2Fe3++Cu === 2Fe2++Cu2+
蚀刻液
——氯化铁溶液
课堂小结
课堂练习
1.要证明某溶液中不含有Fe3+而含有Fe2+,进行如下实验时的最佳操作及顺序为( )
①加入少量KSCN溶液 ②加入适量氯水 ③加入足量的高锰酸钾溶液
A.③① B.①②
C.②③ D.①②③
B
课堂练习
2.下列氯化物既可由金属和氯气直接反应制得,也可由金属和盐酸反应制得的是( )
A.ZnCl2 B.FeCl3
C.FeCl2 D.AlCl3
AD
课堂练习
3.下列物质能将Fe2+氧化为Fe3+,且能使单质Fe由0价变为+3价的是( )
A.氢气 B.氯气
C.浓盐酸 D.稀硫酸
B
课堂练习
4.(2021·广东等级考,10)部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是 ( )
A.a可与e反应生成b
B.b既可被氧化,也可被还原
C.可将e加入浓碱液中制得d的胶体
D.可存在b→c→d→e→b的循环转化关系
C
作业布置
1.预习第二课时《导与练》P88~90
观
看
谢
谢
