6.1.4 化学反应的限度和平衡 课件(26张ppt) 2022-2023学年高一下学期化学苏教版(2020)必修第二册
文档属性
| 名称 | 6.1.4 化学反应的限度和平衡 课件(26张ppt) 2022-2023学年高一下学期化学苏教版(2020)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 979.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-09 13:01:59 | ||
图片预览







文档简介
(共26张PPT)
1.1.4 化学反应的限度与平衡
学习目标
1.掌握可逆反应的概念和特征。
2.了解化学反应的限度与平衡的概念。
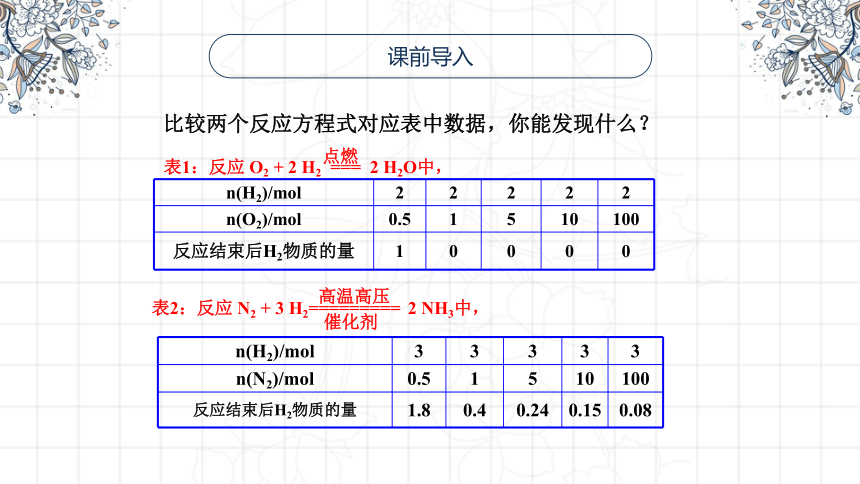
课前导入
比较两个反应方程式对应表中数据,你能发现什么?
表1:反应 O2 + 2 H2 === 2 H2O中,
n(H2)/mol 2 2 2 2 2
n(O2)/mol 0.5 1 5 10 100
反应结束后H2物质的量 1 0 0 0 0
点燃
n(H2)/mol 3 3 3 3 3
n(N2)/mol 0.5 1 5 10 100
反应结束后H2物质的量 1.8 0.4 0.24 0.15 0.08
表2:反应 N2 + 3 H2========= 2 NH3中,
催化剂
高温高压
可逆反应
1.定义:
在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的不完全反应。
3.常见可逆反应:
1.双向性---既能正向反应,又能逆向反应
2.特征:
2.双同性---相同条件下、正逆反应同时进行
3.共存性---不完全反应,反应物、生成物同时存在
N2+3H2 2NH3
催化剂
高温高压
2SO2+O2 2SO3
催化剂
高温
SO2 +H2O H2SO3
NH3 +H2O NH3 ·H2O
学以致用
1.下列关于可逆反应的说法正确的是( )
A.可逆反应就是既能向正反应方向进行,又能向逆反应方向进行的化学反应
B.在催化剂的作用下,二氧化硫与氧气反应生成三氧化硫的同时,三氧化硫又分解生成二氧化硫和氧气,因此该反应是可逆反应
C.对于合成氨的反应,反应物不可能完全转化为生成物
D.氨气和氯化氢常温下化合成氯化铵,氯化铵受热分解成氨气和氯化氢,因此这两个反应互为可逆反应
BC
温故知新
1.回忆一下强电解质与弱电解质的概念,想想醋酸的电离方程式如何书写呢?
二、弱电解质的电离表示方法:
1.弱酸的电离方程式:
可逆反应,多元弱碱不分步
2.弱碱的电离方程式:
可逆反应,多元弱酸分步电离
基础实验
实验 现象 结论或解释
①FeCl3溶液与KI溶液反应
②在反应①的溶液中加入苯,振荡、静置
③取②的下层清液,滴加KSCN溶液
表2—2 FeCl3溶液与KI溶液反应程度的实验
2Fe3+ +2I— 2Fe2++I2
有Fe3+剩余
有I2生成
溶液变棕色
溶液分层,下层变浅,上层为紫红色
溶液变为血红色
②可逆反应具有一定限度
结论:①该反应为可逆反应。
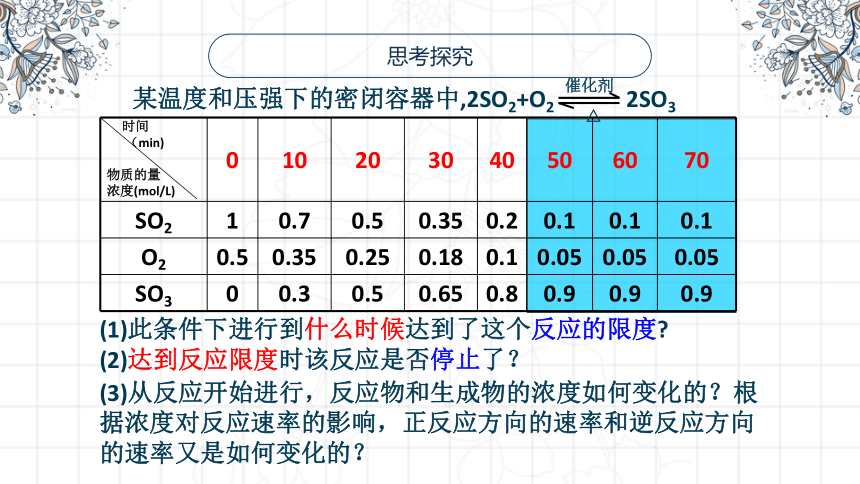
时间 (min) 物质的量 浓度(mol/L) 0 10 20 30 40 50 60 70
SO2 1 0.7 0.5 0.35 0.2 0.1 0.1 0.1
O2 0.5 0.35 0.25 0.18 0.1 0.05 0.05 0.05
SO3 0 0.3 0.5 0.65 0.8 0.9 0.9 0.9
思考探究
某温度和压强下的密闭容器中,2SO2+O2 2SO3
△
催化剂
(1)此条件下进行到什么时候达到了这个反应的限度
(2)达到反应限度时该反应是否停止了?
(3)从反应开始进行,反应物和生成物的浓度如何变化的?根据浓度对反应速率的影响,正反应方向的速率和逆反应方向的速率又是如何变化的?
化学平衡的建立
时间
速率
O
正反应
逆反应
O
时间
浓度
生成物
反应物
平衡时:C反、C生不再变化, 达到了平衡状态,v正=v逆≠0
反应开始时:C反最大, v正最大;
反应进行过程中:C反↓, v正↓;
C生=0 , v逆=0
C生↑ v逆↑
化学平衡状态
1.定义:
在一定条件下的可逆反应中,当正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
2.对化学平衡状态的理解:
前提(适用范围):
内在本质:
外在标志:
可逆反应
v(正)= v(逆) ≠0
反应混合物中各组分的浓度保持不变
化学平衡状态
3.特征:
③动:
②等:
④定:
⑤变:
①逆:
动态平衡(v(正)= v(逆) ≠0)
v(正)= v(逆)
平衡时反应物和生成物浓度保持不变。
条件改变,原平衡被破坏,在新的条件下建立新的平衡。
可逆反应
化学平衡状态
4.判断到达平衡状态的标志:
(1)等速标志:
V正= V逆
①同种物质: vA(正)=vA(逆)
②不同物质: vA(正)与vB(逆)之比等于它们系数之比
D
1.可逆反应达到平衡的重要特征( )
A.反应停止了
B.正、逆反应速率都为零
C.反应物和生成物的浓度相等
D.正、逆反应的速率相等
学以致用
学以致用
2.能说明反应 为平衡状态的为:
N2+3H2 2NH3
①V正(N2)=V逆(N2)
② 2V正(H2)=3V逆(NH3)
③ V(N2):V(H2):V(NH3)= 1:2:3
④单位时间内,每生成1molN2就生成2molNH3。
⑤单位时间内,每消耗1molN2就生成3molH2。
⑥单位时间内,每生成3molH2就消耗2molNH3。
⑦ 单位时间内,每断开1molN≡N键就形成3molH-H键。
⑧ 单位时间内,每形成3molH-H键就形成6molN-H键。
⑨ 单位时间内,每断开1molN≡N键就形成6molN-H键。
√
√
√
√
√
√
文字描述时:同侧词义相反,异侧词义相同。
横等式表示时:必须有正、逆两字,自己计量数在对方前面。
化学平衡状态
(2)浓度不变标志:
反应体系中各物质的浓度保持不变。
各组分n、m、物质的量分数、质量分数、体积分数
(3)其它标志:
反应体系中的温度保持不变时达到平衡状态,总物质的量、总体积、总压强、平均摩尔质量、混合气体的密度、颜色保持不变时,要根据具体情况判断是否为平衡状态。
①气体总压强
当容器体积一定时:
A(g)+B(g) 2C(g)
A(g)+2B(g) 2C(g)
压强不变可以说明达到平衡
压强不变不能说明达到平衡
结论:总压强不再改变,适用于前后气体分子数不相等的反应
②混合气体密度
当容器体积一定时:
A(g)+B(g) 2C(g)
A(g)+B(s) 2C(g)
气体密度不变可以说明达到平衡
气体密度不变不能说明达到平衡
结论:混合气体密度不再改变,适用于反应中有固、液参与或生成的反应。
思考探究
混合气体的颜色不变,说明各成分气体的浓度不发生变化,该反应达到化学平衡状态。
③气体平均相对分子质量( )
A(g)+B(g) 2C(g)
A(g)+2B(g) 2C(g)
不变不能说明达到平衡
不变可以说明达到平衡
课堂小结
3.在已达到平衡的可逆反应2SO2+O2 2SO3中充入由18O组成的氧气一段时间后,18O原子( )
A.只存在于O2中 B.只存在于O2和SO3中
C.只存在于SO2和SO3中 D.SO2,SO3和O2中都存在
催化剂
D
4.在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
2X(g) Y(g) A(s)+2B(g) C(g)+D(g),
当下列物理量不再发生变化时,其中能表明两个反应均达到化学平衡状态的有( )
①混合气体的密度
②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于化学计量数之比
④混合气体的压强
⑤混合气体的平均相对分子质量
⑥混合气体的总物质的量
A.①②③⑤ B.①③⑤⑥ C.②③⑤ D.②③④
C
5.(2011 ·海南高考)对于可逆反应H2(g)+I2(g) 2HI(g),在温度一定下,由H2(g)和I2(g)开始反应,
下列说法正确的是( )
A. H2(g)的消耗速率与HI(g)的生成速率之比为2:1
B. 反应进行的净速率是正、逆反应速率之差
C. 正、逆反应速率的比值是恒定的
D. 达到平衡时,正、逆反应速率都等于0
B
作业布置
1.写《导与练》大本P5~7页
2.写出下列物质在水溶液中的电离方程式在作业本,第二天上交
甲酸(HCOOH)、次氯酸(HClO)、硫酸、碳酸、
氢氧化钡、氢氧化铁、碳酸氢钠、硫酸氢钠
观
看
谢
谢
1.1.4 化学反应的限度与平衡
学习目标
1.掌握可逆反应的概念和特征。
2.了解化学反应的限度与平衡的概念。
课前导入
比较两个反应方程式对应表中数据,你能发现什么?
表1:反应 O2 + 2 H2 === 2 H2O中,
n(H2)/mol 2 2 2 2 2
n(O2)/mol 0.5 1 5 10 100
反应结束后H2物质的量 1 0 0 0 0
点燃
n(H2)/mol 3 3 3 3 3
n(N2)/mol 0.5 1 5 10 100
反应结束后H2物质的量 1.8 0.4 0.24 0.15 0.08
表2:反应 N2 + 3 H2========= 2 NH3中,
催化剂
高温高压
可逆反应
1.定义:
在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的不完全反应。
3.常见可逆反应:
1.双向性---既能正向反应,又能逆向反应
2.特征:
2.双同性---相同条件下、正逆反应同时进行
3.共存性---不完全反应,反应物、生成物同时存在
N2+3H2 2NH3
催化剂
高温高压
2SO2+O2 2SO3
催化剂
高温
SO2 +H2O H2SO3
NH3 +H2O NH3 ·H2O
学以致用
1.下列关于可逆反应的说法正确的是( )
A.可逆反应就是既能向正反应方向进行,又能向逆反应方向进行的化学反应
B.在催化剂的作用下,二氧化硫与氧气反应生成三氧化硫的同时,三氧化硫又分解生成二氧化硫和氧气,因此该反应是可逆反应
C.对于合成氨的反应,反应物不可能完全转化为生成物
D.氨气和氯化氢常温下化合成氯化铵,氯化铵受热分解成氨气和氯化氢,因此这两个反应互为可逆反应
BC
温故知新
1.回忆一下强电解质与弱电解质的概念,想想醋酸的电离方程式如何书写呢?
二、弱电解质的电离表示方法:
1.弱酸的电离方程式:
可逆反应,多元弱碱不分步
2.弱碱的电离方程式:
可逆反应,多元弱酸分步电离
基础实验
实验 现象 结论或解释
①FeCl3溶液与KI溶液反应
②在反应①的溶液中加入苯,振荡、静置
③取②的下层清液,滴加KSCN溶液
表2—2 FeCl3溶液与KI溶液反应程度的实验
2Fe3+ +2I— 2Fe2++I2
有Fe3+剩余
有I2生成
溶液变棕色
溶液分层,下层变浅,上层为紫红色
溶液变为血红色
②可逆反应具有一定限度
结论:①该反应为可逆反应。
时间 (min) 物质的量 浓度(mol/L) 0 10 20 30 40 50 60 70
SO2 1 0.7 0.5 0.35 0.2 0.1 0.1 0.1
O2 0.5 0.35 0.25 0.18 0.1 0.05 0.05 0.05
SO3 0 0.3 0.5 0.65 0.8 0.9 0.9 0.9
思考探究
某温度和压强下的密闭容器中,2SO2+O2 2SO3
△
催化剂
(1)此条件下进行到什么时候达到了这个反应的限度
(2)达到反应限度时该反应是否停止了?
(3)从反应开始进行,反应物和生成物的浓度如何变化的?根据浓度对反应速率的影响,正反应方向的速率和逆反应方向的速率又是如何变化的?
化学平衡的建立
时间
速率
O
正反应
逆反应
O
时间
浓度
生成物
反应物
平衡时:C反、C生不再变化, 达到了平衡状态,v正=v逆≠0
反应开始时:C反最大, v正最大;
反应进行过程中:C反↓, v正↓;
C生=0 , v逆=0
C生↑ v逆↑
化学平衡状态
1.定义:
在一定条件下的可逆反应中,当正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
2.对化学平衡状态的理解:
前提(适用范围):
内在本质:
外在标志:
可逆反应
v(正)= v(逆) ≠0
反应混合物中各组分的浓度保持不变
化学平衡状态
3.特征:
③动:
②等:
④定:
⑤变:
①逆:
动态平衡(v(正)= v(逆) ≠0)
v(正)= v(逆)
平衡时反应物和生成物浓度保持不变。
条件改变,原平衡被破坏,在新的条件下建立新的平衡。
可逆反应
化学平衡状态
4.判断到达平衡状态的标志:
(1)等速标志:
V正= V逆
①同种物质: vA(正)=vA(逆)
②不同物质: vA(正)与vB(逆)之比等于它们系数之比
D
1.可逆反应达到平衡的重要特征( )
A.反应停止了
B.正、逆反应速率都为零
C.反应物和生成物的浓度相等
D.正、逆反应的速率相等
学以致用
学以致用
2.能说明反应 为平衡状态的为:
N2+3H2 2NH3
①V正(N2)=V逆(N2)
② 2V正(H2)=3V逆(NH3)
③ V(N2):V(H2):V(NH3)= 1:2:3
④单位时间内,每生成1molN2就生成2molNH3。
⑤单位时间内,每消耗1molN2就生成3molH2。
⑥单位时间内,每生成3molH2就消耗2molNH3。
⑦ 单位时间内,每断开1molN≡N键就形成3molH-H键。
⑧ 单位时间内,每形成3molH-H键就形成6molN-H键。
⑨ 单位时间内,每断开1molN≡N键就形成6molN-H键。
√
√
√
√
√
√
文字描述时:同侧词义相反,异侧词义相同。
横等式表示时:必须有正、逆两字,自己计量数在对方前面。
化学平衡状态
(2)浓度不变标志:
反应体系中各物质的浓度保持不变。
各组分n、m、物质的量分数、质量分数、体积分数
(3)其它标志:
反应体系中的温度保持不变时达到平衡状态,总物质的量、总体积、总压强、平均摩尔质量、混合气体的密度、颜色保持不变时,要根据具体情况判断是否为平衡状态。
①气体总压强
当容器体积一定时:
A(g)+B(g) 2C(g)
A(g)+2B(g) 2C(g)
压强不变可以说明达到平衡
压强不变不能说明达到平衡
结论:总压强不再改变,适用于前后气体分子数不相等的反应
②混合气体密度
当容器体积一定时:
A(g)+B(g) 2C(g)
A(g)+B(s) 2C(g)
气体密度不变可以说明达到平衡
气体密度不变不能说明达到平衡
结论:混合气体密度不再改变,适用于反应中有固、液参与或生成的反应。
思考探究
混合气体的颜色不变,说明各成分气体的浓度不发生变化,该反应达到化学平衡状态。
③气体平均相对分子质量( )
A(g)+B(g) 2C(g)
A(g)+2B(g) 2C(g)
不变不能说明达到平衡
不变可以说明达到平衡
课堂小结
3.在已达到平衡的可逆反应2SO2+O2 2SO3中充入由18O组成的氧气一段时间后,18O原子( )
A.只存在于O2中 B.只存在于O2和SO3中
C.只存在于SO2和SO3中 D.SO2,SO3和O2中都存在
催化剂
D
4.在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
2X(g) Y(g) A(s)+2B(g) C(g)+D(g),
当下列物理量不再发生变化时,其中能表明两个反应均达到化学平衡状态的有( )
①混合气体的密度
②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于化学计量数之比
④混合气体的压强
⑤混合气体的平均相对分子质量
⑥混合气体的总物质的量
A.①②③⑤ B.①③⑤⑥ C.②③⑤ D.②③④
C
5.(2011 ·海南高考)对于可逆反应H2(g)+I2(g) 2HI(g),在温度一定下,由H2(g)和I2(g)开始反应,
下列说法正确的是( )
A. H2(g)的消耗速率与HI(g)的生成速率之比为2:1
B. 反应进行的净速率是正、逆反应速率之差
C. 正、逆反应速率的比值是恒定的
D. 达到平衡时,正、逆反应速率都等于0
B
作业布置
1.写《导与练》大本P5~7页
2.写出下列物质在水溶液中的电离方程式在作业本,第二天上交
甲酸(HCOOH)、次氯酸(HClO)、硫酸、碳酸、
氢氧化钡、氢氧化铁、碳酸氢钠、硫酸氢钠
观
看
谢
谢
