6.2.1吸热反应与放热反应 课件(19张ppt) 2022-2023学年高一下学期化学苏教版(2020)必修第二册
文档属性
| 名称 | 6.2.1吸热反应与放热反应 课件(19张ppt) 2022-2023学年高一下学期化学苏教版(2020)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-09 13:03:17 | ||
图片预览





文档简介
(共19张PPT)
1.2.1 化学反应中的热量变化
学习目标
1.了解吸热反应与放热反应的概念及反应类型。
2.学会写热化学反应方程式。
课前导入
自热火锅的发热原理是什么?
生石灰加水发生化学反应,放出热量
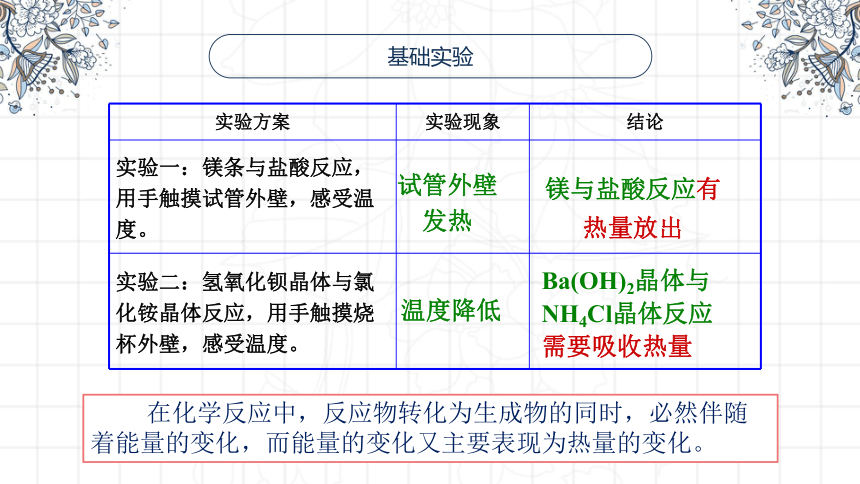
基础实验
实验方案 实验现象 结论
实验一:镁条与盐酸反应,用手触摸试管外壁,感受温度。
实验二:氢氧化钡晶体与氯化铵晶体反应,用手触摸烧杯外壁,感受温度。
试管外壁发热
Ba(OH)2晶体与NH4Cl晶体反应需要吸收热量
镁与盐酸反应有热量放出
温度降低
在化学反应中,反应物转化为生成物的同时,必然伴随着能量的变化,而能量的变化又主要表现为热量的变化。
一、吸热反应与放热反应
1.定义:
放热反应:有热量放出的化学反应。
吸热反应:有吸收热量的化学反应。
2.常见的吸热反应与放热反应:
放热反应 吸热反应
①大部分化合反应(生石灰和水)
②所有燃烧反应
③酸碱中和反应
④活泼金属与水或酸的反应
⑤物质的自燃和缓慢氧化
⑥铝热反应
①大部分分解反应(煅烧CaCO3)
②C+CO2
③H2+CuO
④C+H2O
⑤ 铵盐与碱的反应
温故知新
1.反应有吸热反应与放热反应,那可逆反应是否也有热量变化?
一个可逆反应,若其正向进行时放热,则其逆向进行时必然吸热。反之亦然。
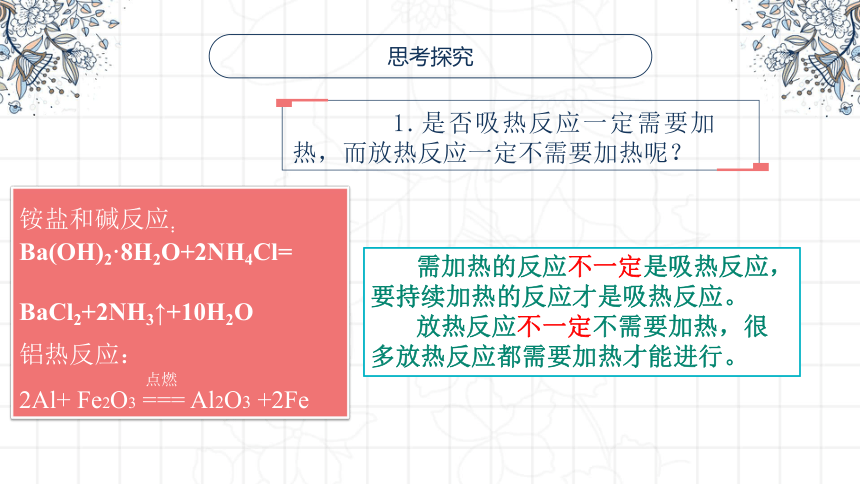
思考探究
1.是否吸热反应一定需要加热,而放热反应一定不需要加热呢?
需加热的反应不一定是吸热反应,要持续加热的反应才是吸热反应。
放热反应不一定不需要加热,很多放热反应都需要加热才能进行。
铵盐和碱反应:
Ba(OH)2·8H2O+2NH4Cl=
BaCl2+2NH3↑+10H2O
铝热反应:
2Al+ Fe2O3 === Al2O3 +2Fe
点燃
如何判断一个反应是吸热还是放热?
如何用准确的数值确定反应为放热或吸热呢?
二、热化学方程式
1.定义:
表示反应所放出或吸收的热量多少的化学方程式,叫做热化学方程式。
(1) 定义:在化学反应中放出或吸收的热量
(2) 符号:△H
(3) 单位:kJ·mol-1
(4) △H>0----吸热反应;△H<0----放热反应
2.反应热(△H):
H2(g)+Cl2(g) = 2HCl(g) △H=-184.6 kJ·mol-1
热化学方程式的注意事项
(1) 要注明反应物和生成物的状态。
(g: 气体、l: 液体、s:固体、aq:溶液)
(2)△H表示反应热。
(“-”表示放热,“+”表示吸热。 单位一般采用kJ·mol-1。)
同种物质在不同的状态下的热效应是不同的
2H2(g) + O2(g) = 2H2O(g) △H = -483.6 kJ·mol-1
2H2(g) + O2(g) = 2H2O(l) △H = -571.6 kJ·mol-1
(3)化学计量数可以是整数,也可以是小数或分数,且只能表示物质的量,不能表示分子个数。
H2(g)+ O2(g) = H2O(l) △H = -285.8 kJ/mol-1
热化学方程式的注意事项
(5)注明反应的温度和压强。
(不注明的通常指101kPa和25℃)
(4) 化学计量数与 △H 之间存在正比关系。
反应热要与化学计量数一致。
H2(g)+ O2(g) = H2O(l) △H=-285.8 kJ·mol-1
2H2(g)+O2(g) = 2H2O(l)
△H=-571.6 kJ·mol-1
三、化学反应中能量变化的原因
1.从宏观角度分析
反应物的总能量高
生成物的总能量低
释放能量
放热反应
生成物的总能量高
反应物的总能量低
吸热反应
吸收能量
学以致用
2HF(g)=H2(g)+F2(g)
△H=270 kJ·mol-1
1.根据能量示意图判断反应吸放热,并且书写热反应方程式
三、化学反应中能量变化的原因
2.从微观角度分析
断开化学键,需要吸收能量,
形成化学键,需要放出能量 。
释放能量
863.6 kJ
H
H
Cl
Cl
吸收能量
436.4 kJ
Cl
H
Cl
H
键断裂
键断裂
Cl
Cl
+
H
H
+
+
+
键
形
成
键
形
成
吸收总能量
679.1 kJ
放出总能量863.6 kJ
结论:1mol H2与1mol Cl2反应生成2mol HCl时, 放出184.5kJ的热量
学以致用
N2(g)+3H2(g) =2NH3(g)
△H=-92 kJ·mol-1
2.根据能量示意图判断反应吸放热,并且书写热反应方程式
课堂小结
1.化学键的断裂和生成是化学反应中能量变化的根本原因。
2.断裂旧化学键吸收能量,形成新化学键释放能量。
3.反应热:
从宏观(能量)角度:
△H=生成物总能量—反应物总能量
从微观(化学键)角度:
△H=反应物断裂键能之和—生成物形成键能之和
作业布置
1.写课时作业P107~109合格考题组,以及10、11、12题
观
看
谢
谢
1.2.1 化学反应中的热量变化
学习目标
1.了解吸热反应与放热反应的概念及反应类型。
2.学会写热化学反应方程式。
课前导入
自热火锅的发热原理是什么?
生石灰加水发生化学反应,放出热量
基础实验
实验方案 实验现象 结论
实验一:镁条与盐酸反应,用手触摸试管外壁,感受温度。
实验二:氢氧化钡晶体与氯化铵晶体反应,用手触摸烧杯外壁,感受温度。
试管外壁发热
Ba(OH)2晶体与NH4Cl晶体反应需要吸收热量
镁与盐酸反应有热量放出
温度降低
在化学反应中,反应物转化为生成物的同时,必然伴随着能量的变化,而能量的变化又主要表现为热量的变化。
一、吸热反应与放热反应
1.定义:
放热反应:有热量放出的化学反应。
吸热反应:有吸收热量的化学反应。
2.常见的吸热反应与放热反应:
放热反应 吸热反应
①大部分化合反应(生石灰和水)
②所有燃烧反应
③酸碱中和反应
④活泼金属与水或酸的反应
⑤物质的自燃和缓慢氧化
⑥铝热反应
①大部分分解反应(煅烧CaCO3)
②C+CO2
③H2+CuO
④C+H2O
⑤ 铵盐与碱的反应
温故知新
1.反应有吸热反应与放热反应,那可逆反应是否也有热量变化?
一个可逆反应,若其正向进行时放热,则其逆向进行时必然吸热。反之亦然。
思考探究
1.是否吸热反应一定需要加热,而放热反应一定不需要加热呢?
需加热的反应不一定是吸热反应,要持续加热的反应才是吸热反应。
放热反应不一定不需要加热,很多放热反应都需要加热才能进行。
铵盐和碱反应:
Ba(OH)2·8H2O+2NH4Cl=
BaCl2+2NH3↑+10H2O
铝热反应:
2Al+ Fe2O3 === Al2O3 +2Fe
点燃
如何判断一个反应是吸热还是放热?
如何用准确的数值确定反应为放热或吸热呢?
二、热化学方程式
1.定义:
表示反应所放出或吸收的热量多少的化学方程式,叫做热化学方程式。
(1) 定义:在化学反应中放出或吸收的热量
(2) 符号:△H
(3) 单位:kJ·mol-1
(4) △H>0----吸热反应;△H<0----放热反应
2.反应热(△H):
H2(g)+Cl2(g) = 2HCl(g) △H=-184.6 kJ·mol-1
热化学方程式的注意事项
(1) 要注明反应物和生成物的状态。
(g: 气体、l: 液体、s:固体、aq:溶液)
(2)△H表示反应热。
(“-”表示放热,“+”表示吸热。 单位一般采用kJ·mol-1。)
同种物质在不同的状态下的热效应是不同的
2H2(g) + O2(g) = 2H2O(g) △H = -483.6 kJ·mol-1
2H2(g) + O2(g) = 2H2O(l) △H = -571.6 kJ·mol-1
(3)化学计量数可以是整数,也可以是小数或分数,且只能表示物质的量,不能表示分子个数。
H2(g)+ O2(g) = H2O(l) △H = -285.8 kJ/mol-1
热化学方程式的注意事项
(5)注明反应的温度和压强。
(不注明的通常指101kPa和25℃)
(4) 化学计量数与 △H 之间存在正比关系。
反应热要与化学计量数一致。
H2(g)+ O2(g) = H2O(l) △H=-285.8 kJ·mol-1
2H2(g)+O2(g) = 2H2O(l)
△H=-571.6 kJ·mol-1
三、化学反应中能量变化的原因
1.从宏观角度分析
反应物的总能量高
生成物的总能量低
释放能量
放热反应
生成物的总能量高
反应物的总能量低
吸热反应
吸收能量
学以致用
2HF(g)=H2(g)+F2(g)
△H=270 kJ·mol-1
1.根据能量示意图判断反应吸放热,并且书写热反应方程式
三、化学反应中能量变化的原因
2.从微观角度分析
断开化学键,需要吸收能量,
形成化学键,需要放出能量 。
释放能量
863.6 kJ
H
H
Cl
Cl
吸收能量
436.4 kJ
Cl
H
Cl
H
键断裂
键断裂
Cl
Cl
+
H
H
+
+
+
键
形
成
键
形
成
吸收总能量
679.1 kJ
放出总能量863.6 kJ
结论:1mol H2与1mol Cl2反应生成2mol HCl时, 放出184.5kJ的热量
学以致用
N2(g)+3H2(g) =2NH3(g)
△H=-92 kJ·mol-1
2.根据能量示意图判断反应吸放热,并且书写热反应方程式
课堂小结
1.化学键的断裂和生成是化学反应中能量变化的根本原因。
2.断裂旧化学键吸收能量,形成新化学键释放能量。
3.反应热:
从宏观(能量)角度:
△H=生成物总能量—反应物总能量
从微观(化学键)角度:
△H=反应物断裂键能之和—生成物形成键能之和
作业布置
1.写课时作业P107~109合格考题组,以及10、11、12题
观
看
谢
谢
