6.3.1化学能转换为电能 课件(30张) 2022-2023学年高一下学期化学苏教版(2020)必修第二册
文档属性
| 名称 | 6.3.1化学能转换为电能 课件(30张) 2022-2023学年高一下学期化学苏教版(2020)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-10 11:12:16 | ||
图片预览



文档简介
1.3.1化学能转化为电能
学习目标
1.了解原电池的概念与构成条件
2.学会判断正负极
3.学会判断电子流动方向
3.学会书写电极方程式
课前导入
思考1:电流形成的条件是什么?
思考2:氧化还原反应的本质是什么?
两者之间有何联系?
电子的定向移动形成电流
电子发生转移(得失或偏移)
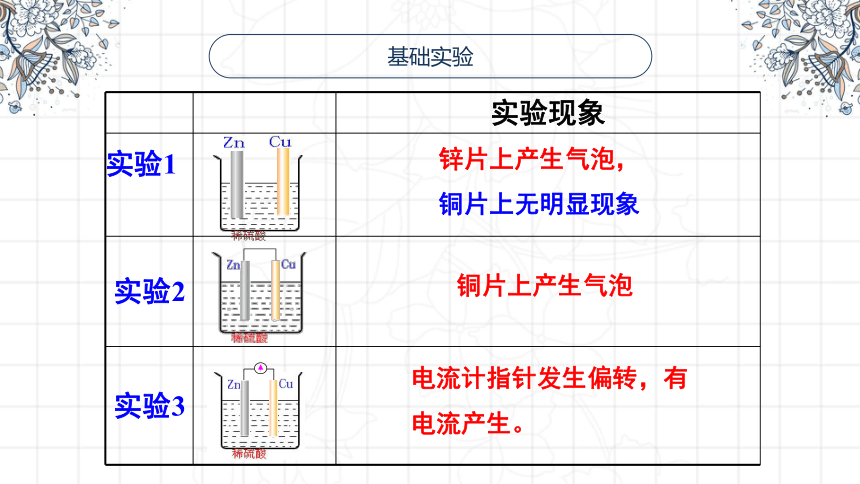
基础实验
实验现象
实验1
实验2
实验3
锌片上产生气泡,
铜片上无明显现象
铜片上产生气泡
电流计指针发生偏转,有电流产生。
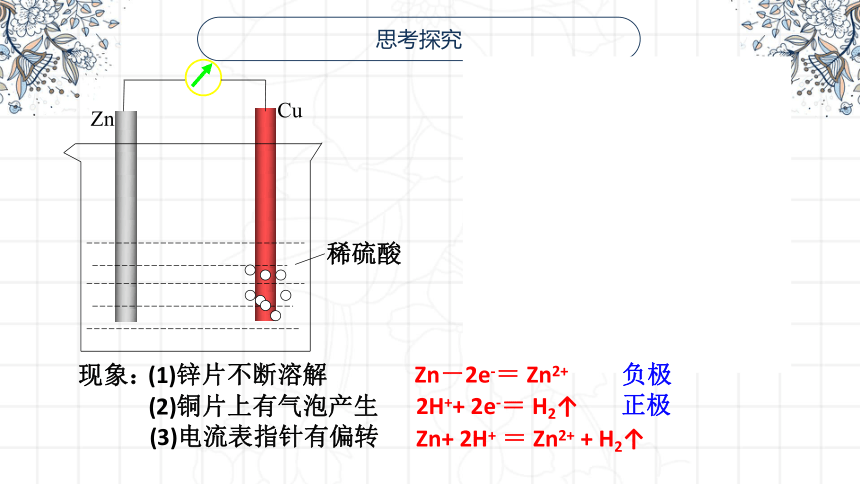
思考探究
Zn
Cu
稀硫酸
现象:
(3)电流表指针有偏转
(2)铜片上有气泡产生
(1)锌片不断溶解
Zn
Cu
e-
e-
H+
H+
SO42-
Zn2+
H2
Zn-2e-= Zn2+
2H++ 2e-= H2↑
Zn+ 2H+ = Zn2+ + H2↑
负极
正极
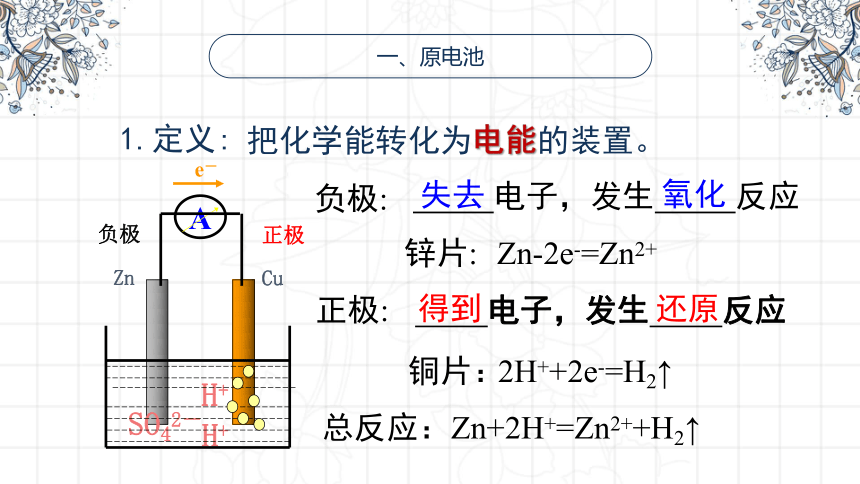
一、原电池
1.定义:
把化学能转化为电能的装置。
A
Zn
Cu
SO42-
H+
H+
正极
负极
e-
锌片:
负极:
正极:
电子,发生 反应
电子,发生 反应
失去
氧化
得到
还原
总反应:Zn+2H+=Zn2++H2↑
Zn-2e-=Zn2+
铜片:
2H++2e-=H2↑
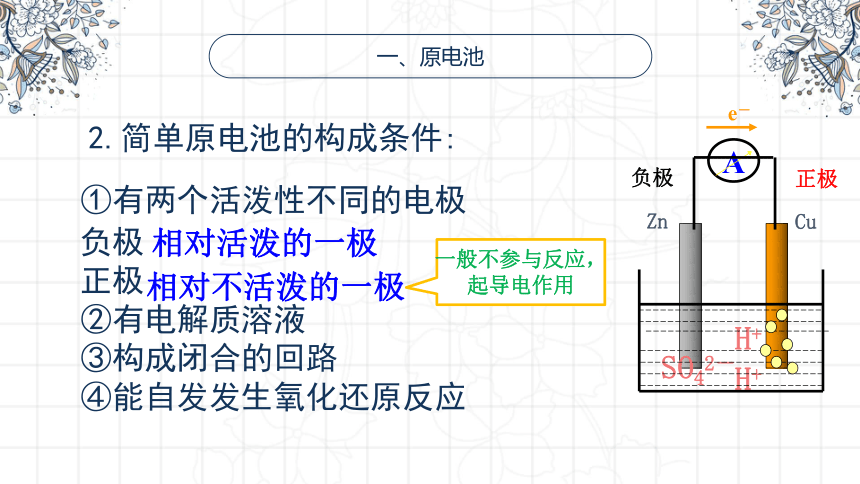
一、原电池
①有两个活泼性不同的电极
负极
正极
②有电解质溶液
③构成闭合的回路
④能自发发生氧化还原反应
2.简单原电池的构成条件:
A
Zn
Cu
SO42-
H+
H+
正极
负极
e-
相对活泼的一极
相对不活泼的一极
一般不参与反应,起导电作用
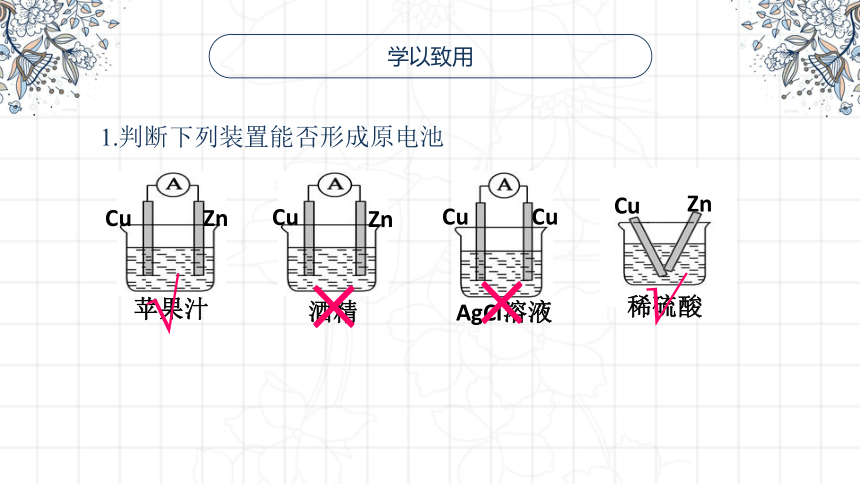
学以致用
1.判断下列装置能否形成原电池
Zn
Cu
苹果汁
Zn
Cu
酒精
Cu
Cu
AgCl溶液
×
×
√
Zn
Cu
稀硫酸
√
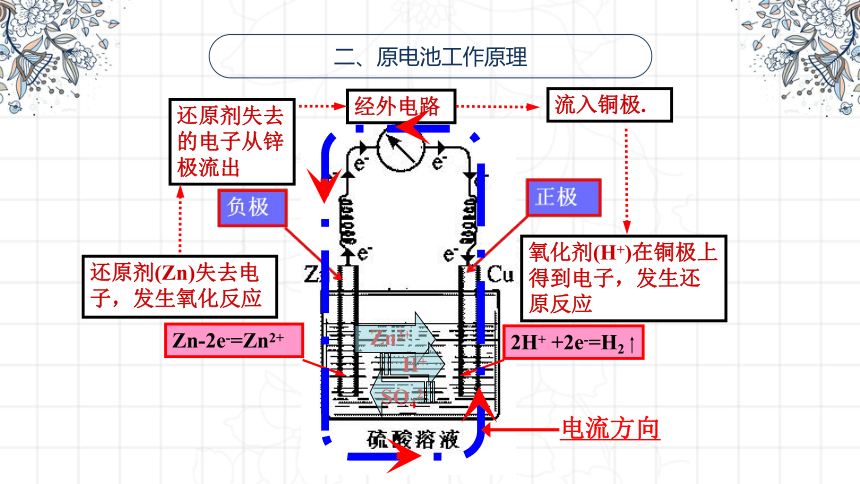
二、原电池工作原理
9
Zn-2e-=Zn2+
2H+ +2e-=H2
还原剂(Zn)失去电子,发生氧化反应
氧化剂(H+)在铜极上得到电子,发生还原反应
还原剂失去的电子从锌极流出
流入铜极.
经外电路
Zn2+
H+
SO42-
电流方向
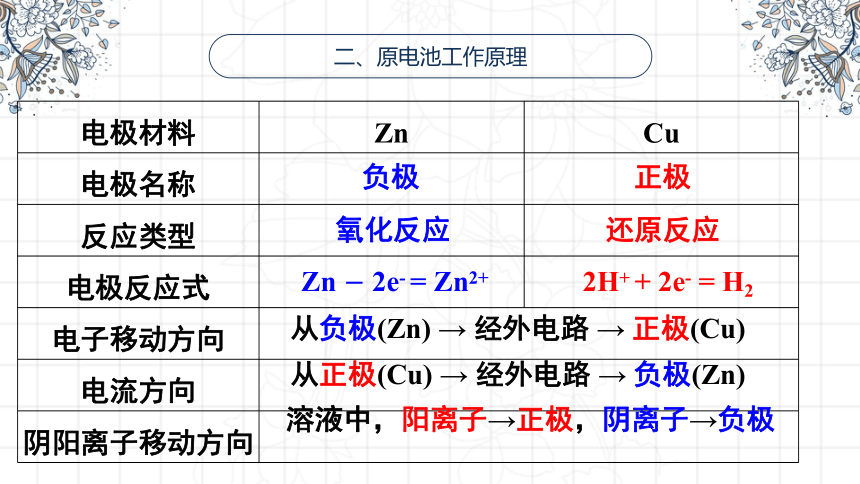
二、原电池工作原理
{5940675A-B579-460E-94D1-54222C63F5DA}电极材料
Zn
Cu
电极名称
反应类型
电极反应式
电子移动方向
电流方向
阴阳离子移动方向
负极
正极
氧化反应
还原反应
Zn - 2e- = Zn2+
2H+ + 2e- = H2
从负极(Zn) → 经外电路 → 正极(Cu)
从正极(Cu) → 经外电路 → 负极(Zn)
溶液中,阳离子→正极,阴离子→负极
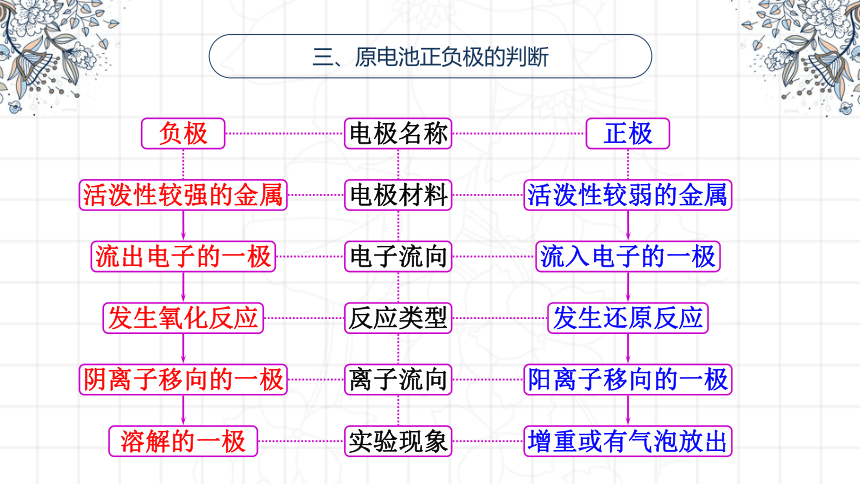
三、原电池正负极的判断
负极
电极名称
正极
活泼性较强的金属
电极材料
活泼性较弱的金属
流出电子的一极
电子流向
发生氧化反应
反应类型
流入电子的一极
发生还原反应
阴离子移向的一极
离子流向
阳离子移向的一极
溶解的一极
实验现象
增重或有气泡放出
学以致用
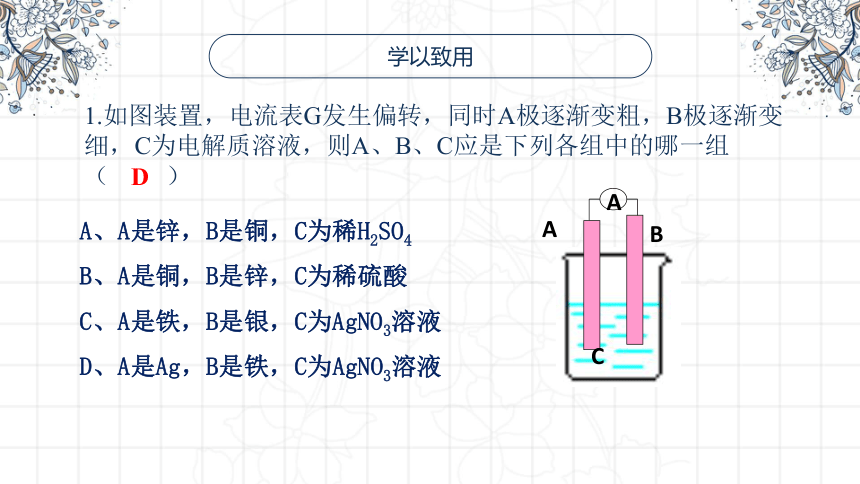
1.如图装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的哪一组( )
A、A是锌,B是铜,C为稀H2SO4
B、A是铜,B是锌,C为稀硫酸
C、A是铁,B是银,C为AgNO3溶液
D、A是Ag,B是铁,C为AgNO3溶液
A
C
A
B
D
学以致用
2.由A、B两种金属和稀硫酸组成的原电池,A是正极,则下列推断正确的是( )
A.A的金属性强于B
B.A电极上发生的电极反应是还原反应
C.电子不断由A电极经外电路流向B电极
D.A在金属性活动顺序表中一定排在氢前面
B
四、电极反应方程式的书写
(1)确定正负极和在正负极上反应的物质
(4) 注意酸性介质或碱性介质
负极:
正极:
Fe极失电子
Ag极得电子
Fe-2e - = Fe2+
(2)确定得失电子的数目与生成微粒
(3)完全电离的物质以离子形式表示
(5)写总方程式时注意电子得失守恒
总反应:
即: 负极与电解质溶液反应
Fe+2H+ = Fe 2+ +H2↑
2H++2e - = H2↑
H2SO4 (aq)
Ag
Fe
I
e-
电极反应方程式的书写
负极:
正极:
Fe-2e - = Fe2+
对于比较复杂的反应,可以根据总方程式来写电极反应:
总反应:
Fe+2H+ = Fe 2+ +H2↑
2H++2e - = H2↑
H2SO4 (aq)
Ag
Fe
I
e-
-
根据化合价升降判断正负极
学以致用
2.请写出右边原电池的电极方程式。
总反应方程式:
Mg - 2e- = Mg2+
Mg + 2H+=Mg2++ H2↑
Mg Al
①HCl溶液
A
负极:
正极:
2H+ +2e- =H2↑
Zn Cu
②CuSO4 (aq)
A
负极:
正极:
Zn-2e - = Zn2+
总反应方程式:
Zn + Cu2+ = Zn2 ++ Cu
Cu2+ +2e - = Cu
学以致用
总反应方程式:
Cu C
③FeCl3溶液
A
负极:
正极:
Cu - 2e- = Cu2+
Fe3+ + e- = Fe2+
2 2 2
Cu + 2Fe3+ = Cu2+ + 2Fe2+
Mg Al
④NaOH溶液
A
总反应:
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑
根据化合价升降判断正负极
负极:
Al - 3e- = Al3+
Al +4OH- -3e- =AlO2- + 2H2O
×????
?
总方程式-负极
正极:
6H2O +6e- =6OH—+ 3H2↑
Al为负极
作业布置
1.写出下列原电池的电极反应和总反应(属于离子反应的,用离子方程式表示)。
(1)负极:________;正极:_________;总反应式:_________。
(2)负极:________;正极:_________;总反应式:_________。
(3)负极:________;正极:_________;总反应式:_________。
{69CF1AB2-1976-4502-BF36-3FF5EA218861}序号
电极1
电极2
电解质溶液
(1)
铁
铜
稀硫酸
(2)
铜
银
AgNO3溶液
(3)
镁
铝
NaOH溶液
学以致用
负极(Fe): Fe - 2e- = Fe2+
正极(C): 2H+ + 2e- = H2↑
总反应式: Fe+ 2H+ = Fe2+ + H2↑
五、原电池原理的应用
(1)比较金属活泼性
(2)加快氧化还原反应速度
负极:活泼性较强
正极:活泼性较弱
实验室用Zn与稀硫酸反应制H2时
a.用粗Zn代替纯Zn
b.向稀硫酸中滴加CuSO4溶液
原理:原电池中,氧化反应和还原反应分别在两极进行,使溶液中离子运动时相互的干扰减小,使反应速率增大。
实验室制氢气,用纯锌还是粗锌(含碳)好?
学以致用
4.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。
若a、b相连时,a为负极;
c、d相连时,电流由d到c;
a、c相连时,c极上产生大量气泡;
b、d相连时,b上有大量气泡产生,
则四种金属的活动性顺序由强到弱的为( )
A.a > b > c > d B.a > c > d > b
C.c > a > b > d D.b > d > c > a
B
五、原电池原理的应用
(3)解释生活中的现象
(1)潮湿的空气里钢铁容易生锈
原理:
负极反应: ;
正极反应: ;
总反应:2Fe+ O2 + 2H2O =2Fe(OH) 2
4Fe(OH) 2+O2 + 2H2O =4Fe(OH) 3
2Fe-4e-=2Fe2+
O2+2H2O+4e-=4OH-
钢铁的电化学腐蚀
Fe和少量的C与表面的水膜形成无数的微小原电池
Fe(负极):2Fe-4e--=2Fe2+
C(正极):O2+4e-+2H2O=4OH-
溶液中: Fe2++2OH- =Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
铁锈(Fe2O3·xH2O)
C
Fe
电解质溶液 O2
Fe2+
OH-
1.(吸氧腐蚀)
——水膜呈碱性、弱酸性或中性
2.(析氢腐蚀)
——水膜酸性较强
Fe(负极):Fe-2e-=Fe2+
C(正极):2H++2e-=H2↑
1.电化学腐蚀概念
不纯的金属跟电解质溶液接触,发生原电池反应,比较活泼的金属失去电子而被氧化的腐蚀。
五、原电池原理的应用
(3)解释生活中的现象
(2)暖贴
主要成分:铁粉、碳、食盐、水、吸水布(吸水棉)
使用方法:撕开后进入空气(提供氧气,供吸氧腐蚀用)
原理:
负极反应: 正极反应: ;
总反应:2Fe+ O2 + 2H2O =2Fe(OH) 2
4Fe(OH) 2+O2 + 2H2O =4Fe(OH) 3
在此反应过程中放热,因此成为“暖宝宝”“热敷袋”
2Fe-4e-=2Fe2+ O2+2H2O+4e-=4OH-
五、原电池原理的应用
(4 ).设计原电池
(1)依据:
已知一个氧化还原反应,首先分析找出氧化剂、还原剂,
一般还原剂为负极材料(或在负极上被氧化),
氧化剂(即电解质溶液中的阳离子)在正极上被还原。
(2)选择合适的材料
①电极材料:电极材料必须导电。负极材料一般选择较活泼的金属材料,或者在该氧化还原反应中,本身失去电子的材料。
②电解质溶液:电解质溶液一般能与负极反应。
五、原电池原理的应用
(4 )设计原电池
(5)保护金属设备
(被保护金属作正极)
思考:通常在轮船的尾部和在船壳的水线以下部分,装有一定数量的锌块,请解释原 因。
原因:轮船的船身一般是用铁做的,装上锌块后,铁跟锌形成原电池,此时锌作为负极发生氧化反应溶掉,而铁作为正极被保护起来不受腐蚀。
学以致用
2、A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)A中反应的离子方程式为______________________。
(2)B中锡极为________极,电极反应式为_______________________,锡极附近溶液的酸性________(填“增强”“减弱”或“不变”)。B中Fe极为________极,电极反应式为_____________________________________。
(3)C中被腐蚀的金属是________,总反应的化学方程式为_____ _____________。
(4)A、B、C中铁被腐蚀由快到慢的顺序是________。
Fe+2H+==Fe2++H2↑
正
2H++2e-===H2↑
减弱
负
Fe-2e-===Fe2+
Zn
Zn+H2SO4===ZnSO4+H2↑
B>A>C
学以致用
观
看
谢
谢
学习目标
1.了解原电池的概念与构成条件
2.学会判断正负极
3.学会判断电子流动方向
3.学会书写电极方程式
课前导入
思考1:电流形成的条件是什么?
思考2:氧化还原反应的本质是什么?
两者之间有何联系?
电子的定向移动形成电流
电子发生转移(得失或偏移)
基础实验
实验现象
实验1
实验2
实验3
锌片上产生气泡,
铜片上无明显现象
铜片上产生气泡
电流计指针发生偏转,有电流产生。
思考探究
Zn
Cu
稀硫酸
现象:
(3)电流表指针有偏转
(2)铜片上有气泡产生
(1)锌片不断溶解
Zn
Cu
e-
e-
H+
H+
SO42-
Zn2+
H2
Zn-2e-= Zn2+
2H++ 2e-= H2↑
Zn+ 2H+ = Zn2+ + H2↑
负极
正极
一、原电池
1.定义:
把化学能转化为电能的装置。
A
Zn
Cu
SO42-
H+
H+
正极
负极
e-
锌片:
负极:
正极:
电子,发生 反应
电子,发生 反应
失去
氧化
得到
还原
总反应:Zn+2H+=Zn2++H2↑
Zn-2e-=Zn2+
铜片:
2H++2e-=H2↑
一、原电池
①有两个活泼性不同的电极
负极
正极
②有电解质溶液
③构成闭合的回路
④能自发发生氧化还原反应
2.简单原电池的构成条件:
A
Zn
Cu
SO42-
H+
H+
正极
负极
e-
相对活泼的一极
相对不活泼的一极
一般不参与反应,起导电作用
学以致用
1.判断下列装置能否形成原电池
Zn
Cu
苹果汁
Zn
Cu
酒精
Cu
Cu
AgCl溶液
×
×
√
Zn
Cu
稀硫酸
√
二、原电池工作原理
9
Zn-2e-=Zn2+
2H+ +2e-=H2
还原剂(Zn)失去电子,发生氧化反应
氧化剂(H+)在铜极上得到电子,发生还原反应
还原剂失去的电子从锌极流出
流入铜极.
经外电路
Zn2+
H+
SO42-
电流方向
二、原电池工作原理
{5940675A-B579-460E-94D1-54222C63F5DA}电极材料
Zn
Cu
电极名称
反应类型
电极反应式
电子移动方向
电流方向
阴阳离子移动方向
负极
正极
氧化反应
还原反应
Zn - 2e- = Zn2+
2H+ + 2e- = H2
从负极(Zn) → 经外电路 → 正极(Cu)
从正极(Cu) → 经外电路 → 负极(Zn)
溶液中,阳离子→正极,阴离子→负极
三、原电池正负极的判断
负极
电极名称
正极
活泼性较强的金属
电极材料
活泼性较弱的金属
流出电子的一极
电子流向
发生氧化反应
反应类型
流入电子的一极
发生还原反应
阴离子移向的一极
离子流向
阳离子移向的一极
溶解的一极
实验现象
增重或有气泡放出
学以致用
1.如图装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的哪一组( )
A、A是锌,B是铜,C为稀H2SO4
B、A是铜,B是锌,C为稀硫酸
C、A是铁,B是银,C为AgNO3溶液
D、A是Ag,B是铁,C为AgNO3溶液
A
C
A
B
D
学以致用
2.由A、B两种金属和稀硫酸组成的原电池,A是正极,则下列推断正确的是( )
A.A的金属性强于B
B.A电极上发生的电极反应是还原反应
C.电子不断由A电极经外电路流向B电极
D.A在金属性活动顺序表中一定排在氢前面
B
四、电极反应方程式的书写
(1)确定正负极和在正负极上反应的物质
(4) 注意酸性介质或碱性介质
负极:
正极:
Fe极失电子
Ag极得电子
Fe-2e - = Fe2+
(2)确定得失电子的数目与生成微粒
(3)完全电离的物质以离子形式表示
(5)写总方程式时注意电子得失守恒
总反应:
即: 负极与电解质溶液反应
Fe+2H+ = Fe 2+ +H2↑
2H++2e - = H2↑
H2SO4 (aq)
Ag
Fe
I
e-
电极反应方程式的书写
负极:
正极:
Fe-2e - = Fe2+
对于比较复杂的反应,可以根据总方程式来写电极反应:
总反应:
Fe+2H+ = Fe 2+ +H2↑
2H++2e - = H2↑
H2SO4 (aq)
Ag
Fe
I
e-
-
根据化合价升降判断正负极
学以致用
2.请写出右边原电池的电极方程式。
总反应方程式:
Mg - 2e- = Mg2+
Mg + 2H+=Mg2++ H2↑
Mg Al
①HCl溶液
A
负极:
正极:
2H+ +2e- =H2↑
Zn Cu
②CuSO4 (aq)
A
负极:
正极:
Zn-2e - = Zn2+
总反应方程式:
Zn + Cu2+ = Zn2 ++ Cu
Cu2+ +2e - = Cu
学以致用
总反应方程式:
Cu C
③FeCl3溶液
A
负极:
正极:
Cu - 2e- = Cu2+
Fe3+ + e- = Fe2+
2 2 2
Cu + 2Fe3+ = Cu2+ + 2Fe2+
Mg Al
④NaOH溶液
A
总反应:
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑
根据化合价升降判断正负极
负极:
Al - 3e- = Al3+
Al +4OH- -3e- =AlO2- + 2H2O
×????
?
总方程式-负极
正极:
6H2O +6e- =6OH—+ 3H2↑
Al为负极
作业布置
1.写出下列原电池的电极反应和总反应(属于离子反应的,用离子方程式表示)。
(1)负极:________;正极:_________;总反应式:_________。
(2)负极:________;正极:_________;总反应式:_________。
(3)负极:________;正极:_________;总反应式:_________。
{69CF1AB2-1976-4502-BF36-3FF5EA218861}序号
电极1
电极2
电解质溶液
(1)
铁
铜
稀硫酸
(2)
铜
银
AgNO3溶液
(3)
镁
铝
NaOH溶液
学以致用
负极(Fe): Fe - 2e- = Fe2+
正极(C): 2H+ + 2e- = H2↑
总反应式: Fe+ 2H+ = Fe2+ + H2↑
五、原电池原理的应用
(1)比较金属活泼性
(2)加快氧化还原反应速度
负极:活泼性较强
正极:活泼性较弱
实验室用Zn与稀硫酸反应制H2时
a.用粗Zn代替纯Zn
b.向稀硫酸中滴加CuSO4溶液
原理:原电池中,氧化反应和还原反应分别在两极进行,使溶液中离子运动时相互的干扰减小,使反应速率增大。
实验室制氢气,用纯锌还是粗锌(含碳)好?
学以致用
4.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。
若a、b相连时,a为负极;
c、d相连时,电流由d到c;
a、c相连时,c极上产生大量气泡;
b、d相连时,b上有大量气泡产生,
则四种金属的活动性顺序由强到弱的为( )
A.a > b > c > d B.a > c > d > b
C.c > a > b > d D.b > d > c > a
B
五、原电池原理的应用
(3)解释生活中的现象
(1)潮湿的空气里钢铁容易生锈
原理:
负极反应: ;
正极反应: ;
总反应:2Fe+ O2 + 2H2O =2Fe(OH) 2
4Fe(OH) 2+O2 + 2H2O =4Fe(OH) 3
2Fe-4e-=2Fe2+
O2+2H2O+4e-=4OH-
钢铁的电化学腐蚀
Fe和少量的C与表面的水膜形成无数的微小原电池
Fe(负极):2Fe-4e--=2Fe2+
C(正极):O2+4e-+2H2O=4OH-
溶液中: Fe2++2OH- =Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
铁锈(Fe2O3·xH2O)
C
Fe
电解质溶液 O2
Fe2+
OH-
1.(吸氧腐蚀)
——水膜呈碱性、弱酸性或中性
2.(析氢腐蚀)
——水膜酸性较强
Fe(负极):Fe-2e-=Fe2+
C(正极):2H++2e-=H2↑
1.电化学腐蚀概念
不纯的金属跟电解质溶液接触,发生原电池反应,比较活泼的金属失去电子而被氧化的腐蚀。
五、原电池原理的应用
(3)解释生活中的现象
(2)暖贴
主要成分:铁粉、碳、食盐、水、吸水布(吸水棉)
使用方法:撕开后进入空气(提供氧气,供吸氧腐蚀用)
原理:
负极反应: 正极反应: ;
总反应:2Fe+ O2 + 2H2O =2Fe(OH) 2
4Fe(OH) 2+O2 + 2H2O =4Fe(OH) 3
在此反应过程中放热,因此成为“暖宝宝”“热敷袋”
2Fe-4e-=2Fe2+ O2+2H2O+4e-=4OH-
五、原电池原理的应用
(4 ).设计原电池
(1)依据:
已知一个氧化还原反应,首先分析找出氧化剂、还原剂,
一般还原剂为负极材料(或在负极上被氧化),
氧化剂(即电解质溶液中的阳离子)在正极上被还原。
(2)选择合适的材料
①电极材料:电极材料必须导电。负极材料一般选择较活泼的金属材料,或者在该氧化还原反应中,本身失去电子的材料。
②电解质溶液:电解质溶液一般能与负极反应。
五、原电池原理的应用
(4 )设计原电池
(5)保护金属设备
(被保护金属作正极)
思考:通常在轮船的尾部和在船壳的水线以下部分,装有一定数量的锌块,请解释原 因。
原因:轮船的船身一般是用铁做的,装上锌块后,铁跟锌形成原电池,此时锌作为负极发生氧化反应溶掉,而铁作为正极被保护起来不受腐蚀。
学以致用
2、A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)A中反应的离子方程式为______________________。
(2)B中锡极为________极,电极反应式为_______________________,锡极附近溶液的酸性________(填“增强”“减弱”或“不变”)。B中Fe极为________极,电极反应式为_____________________________________。
(3)C中被腐蚀的金属是________,总反应的化学方程式为_____ _____________。
(4)A、B、C中铁被腐蚀由快到慢的顺序是________。
Fe+2H+==Fe2++H2↑
正
2H++2e-===H2↑
减弱
负
Fe-2e-===Fe2+
Zn
Zn+H2SO4===ZnSO4+H2↑
B>A>C
学以致用
观
看
谢
谢
