7.2.1氨气的性质与用途 课件(23张ppt) 2022-2023学年高一下学期化学苏教版(2020)必修第二册
文档属性
| 名称 | 7.2.1氨气的性质与用途 课件(23张ppt) 2022-2023学年高一下学期化学苏教版(2020)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-09 13:07:26 | ||
图片预览





文档简介
(共23张PPT)
2.2.1 氨气的性质与用途
学习目标
1.认识氨气的物理特性和用途。
2.认识氨气的化学性质。
课前导入
以合成氨为代表
的化学合成技术
氨气
(一)物理性质
气态
无色
有刺激性气味
-33.5℃(易液化
得到液氨)
比空气小
极易溶于水(1:700)
状态:
颜色:
气味:
沸点:
密度:
溶解性:
氨液化时放出大量的热,液氨汽化时要吸收周围的热量,使周围空气迅速变冷,常用作制冷剂。
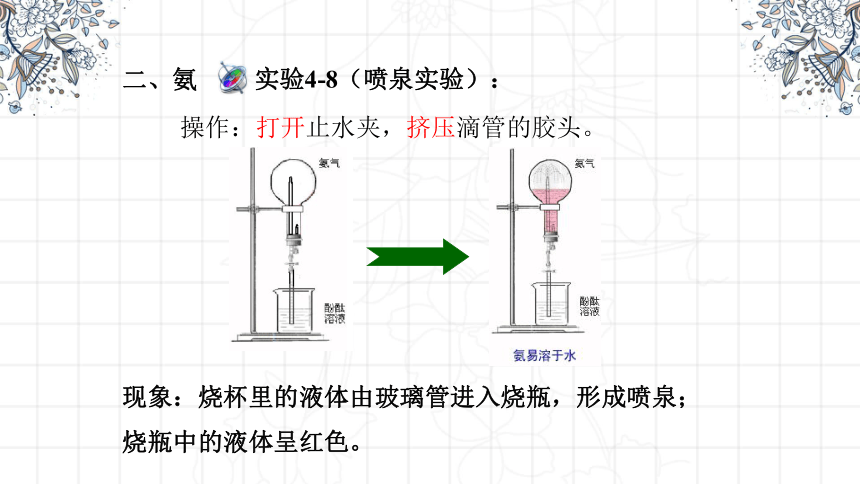
二、氨
实验4-8(喷泉实验):
现象:烧杯里的液体由玻璃管进入烧瓶,形成喷泉;烧瓶中的液体呈红色。
操作:打开止水夹,挤压滴管的胶头。
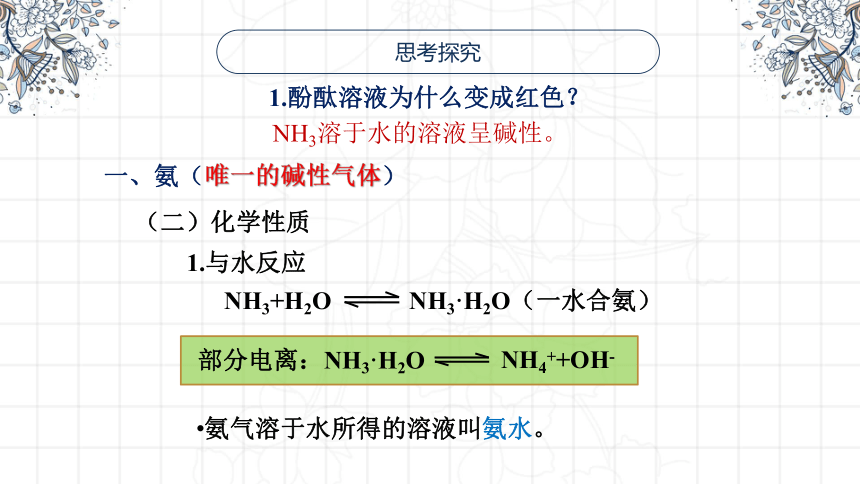
思考探究
1.酚酞溶液为什么变成红色?
NH3溶于水的溶液呈碱性。
(二)化学性质
1.与水反应
部分电离:NH3·H2O
NH4++OH-
NH3+H2O
NH3·H2O(一水合氨)
氨气溶于水所得的溶液叫氨水。
一、氨(唯一的碱性气体)
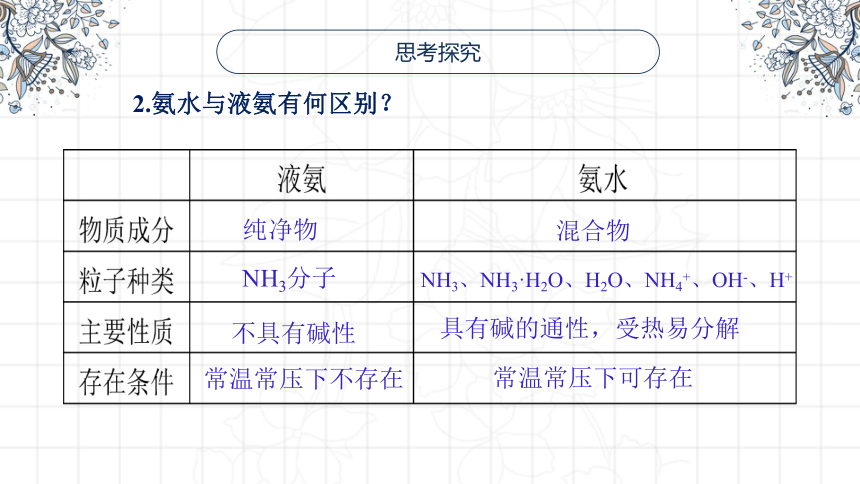
2.氨水与液氨有何区别?
纯净物
混合物
NH3分子
NH3、NH3·H2O、H2O、NH4+、OH-、H+
不具有碱性
具有碱的通性,受热易分解
常温常压下不存在
常温常压下可存在
思考探究
思考探究
3.氨气与水为什么能够形成喷泉实验呢?
4.CO2与NaOH溶液是否也能够形成喷泉实验呢?
烧瓶内的氨气极易溶于水并且与水反应,造成烧瓶内压强减小,在大气压作用下将水(溶液)压入烧瓶产生喷泉现象。
能,因为CO2能与NaOH反应,使烧瓶内外形成压强差,从而产生喷泉现象。
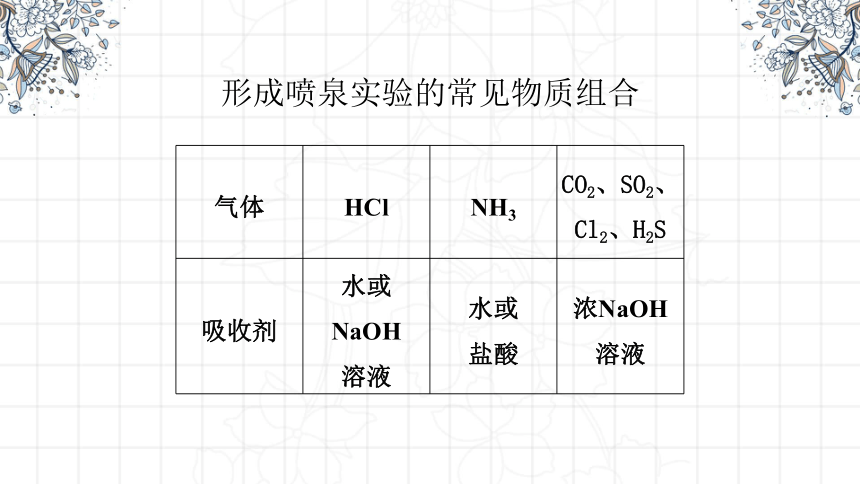
形成喷泉实验的常见物质组合
气体 HCl NH3 CO2、SO2、
Cl2、H2S
吸收剂 水或NaOH 溶液 水或 盐酸 浓NaOH
溶液
温故知新
(二)化学性质
1.与水反应
一水合氨不稳定:NH3·H2O = NH3↑+ H2O
试剂特点:
保存方法:
NH3+H2O
NH3·H2O(一水合氨)
氨水
易挥发,不稳定,易分解。
使用棕色试剂瓶,避光密封。
思考探究
反应物质 反应现象 变化原因
酚酞溶液
FeCl3溶液
湿润的 红色石蕊试纸
浓盐酸
溶液由无色变为红色
产生红褐色沉淀
有白烟生成
变蓝
3NH3·H2O+Fe3+
=Fe(OH)3↓+3NH4+
NH3·H2O NH4++OH-
NH3 + HCl = NH4Cl (白烟)
NH3·H2O NH4++OH-
根据氨气的性质,试着写出下列实验的现象以及原因。
学以致用
(二)化学性质
2.与酸反应
NH3 + HCl = NH4Cl (白烟)
现象:产生大量白烟
【实验】用玻璃棒蘸浓氨水,与蘸有浓盐酸的玻璃棒靠近,有何现象?为什么?
应用:可检验NH3或HCl
反应方程式:
2.与酸反应
NH3 + HCl = NH4Cl (白烟)
反应方程式:
NH3+HNO3 = NH4NO3 (白烟)
2NH3+ H2SO4 = (NH4)2SO4
所以 NH3不能用浓硫酸干燥。
资料卡片
(NH4)2SO4
NH4NO3
NH4HCO3
NH4Cl
铵盐大多是无色晶体,运输、储存比较方便,并且都能溶于水,易于被农作物吸收。固态氮肥已经代替了氨水,成为目前使用最广泛的化肥。
思考探究
5.在氨气中氮元素的化合价是多少?应该具有什么化学性质?
NH3是氮的最低价(-3价)化合物,表现出还原性。
在通常情况下,氨与氧气不易反应,但在加热和催化剂(如铂丝或Cr2O3)存在下,氨与氧气反应生成一氧化氮和水,并放出热。
3.氨的催化氧化
4NH3 + 5O2 ==== 4NO + 6H2O
催化剂
△
氨的催化氧化(工业制硝酸的第一步)
学以致用
三、氨气的检验
(1)遇湿润的红色石蕊试纸变蓝色
(2)用蘸有浓盐酸的玻璃棒靠近白烟产生
资料卡片
氨的用途
工业制造硝酸、铵盐和纯碱的原料;用作制冷剂。
课堂小结
课堂练习
1.下列关于氨的叙述中,错误的是( )
A.氨易液化,因此可用来作制冷剂
B.氨易溶于水,因此可用来作喷泉实验
C.氨极易溶于水,因此氨水比较稳定,不容易分解
D.氨溶于水显弱碱性,因此可使酚酞试剂变为红色
C
课堂练习
2.氨水显弱碱性的主要原因是( )
A.通常状况下,氨的溶解度不大
B.氨水中的NH3·H2O少量电离
C.溶于水的氨分子只有少量发生电离
D.氨本身的碱性弱
B
课堂练习
2.如图所示:烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则a、b不可能是( )
A.a为NH3,b为NaCl溶液
B.a为CO2,b为浓NaOH溶液
C.a为Cl2,b为饱和NaCl溶液
D.a为Cl2,b为浓NaOH溶液
C
a气体
b液体
作业布置
1.预习2.2.2《硝酸》写《导与练》知识点二
观
看
谢
谢
2.2.1 氨气的性质与用途
学习目标
1.认识氨气的物理特性和用途。
2.认识氨气的化学性质。
课前导入
以合成氨为代表
的化学合成技术
氨气
(一)物理性质
气态
无色
有刺激性气味
-33.5℃(易液化
得到液氨)
比空气小
极易溶于水(1:700)
状态:
颜色:
气味:
沸点:
密度:
溶解性:
氨液化时放出大量的热,液氨汽化时要吸收周围的热量,使周围空气迅速变冷,常用作制冷剂。
二、氨
实验4-8(喷泉实验):
现象:烧杯里的液体由玻璃管进入烧瓶,形成喷泉;烧瓶中的液体呈红色。
操作:打开止水夹,挤压滴管的胶头。
思考探究
1.酚酞溶液为什么变成红色?
NH3溶于水的溶液呈碱性。
(二)化学性质
1.与水反应
部分电离:NH3·H2O
NH4++OH-
NH3+H2O
NH3·H2O(一水合氨)
氨气溶于水所得的溶液叫氨水。
一、氨(唯一的碱性气体)
2.氨水与液氨有何区别?
纯净物
混合物
NH3分子
NH3、NH3·H2O、H2O、NH4+、OH-、H+
不具有碱性
具有碱的通性,受热易分解
常温常压下不存在
常温常压下可存在
思考探究
思考探究
3.氨气与水为什么能够形成喷泉实验呢?
4.CO2与NaOH溶液是否也能够形成喷泉实验呢?
烧瓶内的氨气极易溶于水并且与水反应,造成烧瓶内压强减小,在大气压作用下将水(溶液)压入烧瓶产生喷泉现象。
能,因为CO2能与NaOH反应,使烧瓶内外形成压强差,从而产生喷泉现象。
形成喷泉实验的常见物质组合
气体 HCl NH3 CO2、SO2、
Cl2、H2S
吸收剂 水或NaOH 溶液 水或 盐酸 浓NaOH
溶液
温故知新
(二)化学性质
1.与水反应
一水合氨不稳定:NH3·H2O = NH3↑+ H2O
试剂特点:
保存方法:
NH3+H2O
NH3·H2O(一水合氨)
氨水
易挥发,不稳定,易分解。
使用棕色试剂瓶,避光密封。
思考探究
反应物质 反应现象 变化原因
酚酞溶液
FeCl3溶液
湿润的 红色石蕊试纸
浓盐酸
溶液由无色变为红色
产生红褐色沉淀
有白烟生成
变蓝
3NH3·H2O+Fe3+
=Fe(OH)3↓+3NH4+
NH3·H2O NH4++OH-
NH3 + HCl = NH4Cl (白烟)
NH3·H2O NH4++OH-
根据氨气的性质,试着写出下列实验的现象以及原因。
学以致用
(二)化学性质
2.与酸反应
NH3 + HCl = NH4Cl (白烟)
现象:产生大量白烟
【实验】用玻璃棒蘸浓氨水,与蘸有浓盐酸的玻璃棒靠近,有何现象?为什么?
应用:可检验NH3或HCl
反应方程式:
2.与酸反应
NH3 + HCl = NH4Cl (白烟)
反应方程式:
NH3+HNO3 = NH4NO3 (白烟)
2NH3+ H2SO4 = (NH4)2SO4
所以 NH3不能用浓硫酸干燥。
资料卡片
(NH4)2SO4
NH4NO3
NH4HCO3
NH4Cl
铵盐大多是无色晶体,运输、储存比较方便,并且都能溶于水,易于被农作物吸收。固态氮肥已经代替了氨水,成为目前使用最广泛的化肥。
思考探究
5.在氨气中氮元素的化合价是多少?应该具有什么化学性质?
NH3是氮的最低价(-3价)化合物,表现出还原性。
在通常情况下,氨与氧气不易反应,但在加热和催化剂(如铂丝或Cr2O3)存在下,氨与氧气反应生成一氧化氮和水,并放出热。
3.氨的催化氧化
4NH3 + 5O2 ==== 4NO + 6H2O
催化剂
△
氨的催化氧化(工业制硝酸的第一步)
学以致用
三、氨气的检验
(1)遇湿润的红色石蕊试纸变蓝色
(2)用蘸有浓盐酸的玻璃棒靠近白烟产生
资料卡片
氨的用途
工业制造硝酸、铵盐和纯碱的原料;用作制冷剂。
课堂小结
课堂练习
1.下列关于氨的叙述中,错误的是( )
A.氨易液化,因此可用来作制冷剂
B.氨易溶于水,因此可用来作喷泉实验
C.氨极易溶于水,因此氨水比较稳定,不容易分解
D.氨溶于水显弱碱性,因此可使酚酞试剂变为红色
C
课堂练习
2.氨水显弱碱性的主要原因是( )
A.通常状况下,氨的溶解度不大
B.氨水中的NH3·H2O少量电离
C.溶于水的氨分子只有少量发生电离
D.氨本身的碱性弱
B
课堂练习
2.如图所示:烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则a、b不可能是( )
A.a为NH3,b为NaCl溶液
B.a为CO2,b为浓NaOH溶液
C.a为Cl2,b为饱和NaCl溶液
D.a为Cl2,b为浓NaOH溶液
C
a气体
b液体
作业布置
1.预习2.2.2《硝酸》写《导与练》知识点二
观
看
谢
谢
