8.2.2乙酸 课件(26张) 2022-2023学年高一下学期化学苏教版(2020)必修第二册
文档属性
| 名称 | 8.2.2乙酸 课件(26张) 2022-2023学年高一下学期化学苏教版(2020)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-10 11:28:14 | ||
图片预览








文档简介
课前导入
厨师烧鱼时常加食醋并加点料酒,这样鱼的味道就变得无腥、香醇,特别鲜美。
8.2.2 乙酸
学习目标
1.认识乙酸的结构
2.掌握乙酸的酸性和酯化反应
3.认识酯化反应的原理
一、乙酸的物理性质
{D27102A9-8310-4765-A935-A1911B00CA55}颜色
气味
状态
溶解度
有强烈刺激性气味
无色
液体
易溶于水和乙醇
熔点为16.6℃,沸点为117.9℃;
纯净的乙酸在16.6℃以下呈冰状固体,故又称为冰醋酸;
二、乙酸的化学性质
1.乙酸的结构:
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}分子式
结构式
结构简式
官能团
C2H4O2
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}球棍模型
比例模型
羧基
C—C—O—H
H
H
H
O
CH3COOH
—COOH
C
O
H
O
2.乙酸的酸性:
(1)弱酸性
CH3COOH CH3COO-+H+
②与活泼金属反应(以Na为例)
2CH3COOH + 2Na → 2CH3COONa+H2↑
①使指示剂变色
③ 与碱反应(以NaOH为例)
CH3COOH+NaOH→CH3COONa+H2O
④ 与碱性氧化物反应(以CaO为例)
2CH3COOH+CaO→ (CH3COO)2Ca+H2O
⑤与部分盐反应(以Na2CO3为例)
Na2CO3+2CH3COOH→ 2CH3COONa +CO2↑+H2O
H
H
C—C—O-H
H-
O
(2)酸的通性
思考探究
请看漫画,你能悟出其中的化学原理吗?
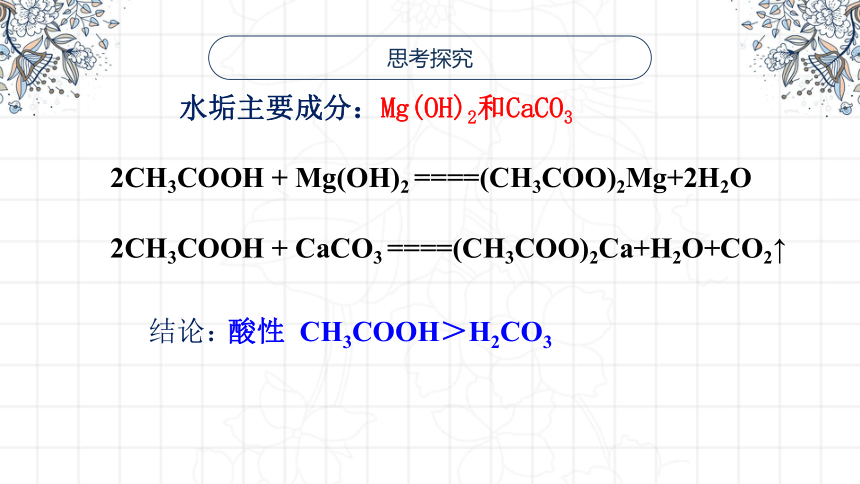
水垢主要成分:Mg(OH)2和CaCO3
思考探究
水垢主要成分:Mg(OH)2和CaCO3
2CH3COOH + Mg(OH)2 ====(CH3COO)2Mg+2H2O
2CH3COOH + CaCO3 ====(CH3COO)2Ca+H2O+CO2↑
结论:
酸性 CH3COOH>H2CO3
二、乙酸的化学性质
厨师烧鱼时常加醋并加点酒,这样鱼的味道就变得无腥、香醇,特别鲜美。
这用化学知识能解释哦!
基础实验
【实验2】向一支试管中加入3mL乙醇,然后边振荡试管,边慢慢加入2mL98%的浓硫酸和2mL冰醋酸,按图所示连接好装置。用酒精灯小心加热试管3~5min,产生的蒸气经导管通到饱和碳酸钠溶液的液面上方。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}实验序号
实验现象
实验2
饱和Na2CO3溶液上层有透明的不溶于水的油状液体产生,并可以闻到香味
二、乙酸的化学性质
3.酯化反应:
酸和醇作用生成酯和水的反应叫做酯化反应。
CH3COOH + HOC2H5 CH3COOC2H5 + H2O
乙酸乙酯
浓硫酸
△
实验制备乙酸乙酯的注意事项
1.装药品的顺序如何?
先加乙醇,再加浓硫酸,最后加乙酸。?
2.浓硫酸的作用是什么?
3.饱和碳酸钠溶液有什么作用?
①反应消耗掉乙酸。
②溶解挥发出的乙醇。
③降低乙酸乙酯的溶解度。
①催化剂
②吸水剂
CH3COOH + HOC2H5 CH3COOC2H5 + H2O
浓硫酸
△
饱和碳酸钠溶液
酯化反应的原理
思考
酯化反应生成的水,里面的原子来源于哪里呢?
CH3COOH + HOC2H5 CH3COOC2H5 + H2O
浓硫酸
△
酯化反应的原理
CH3—C—OH + H—O—C2H5 CH3—C—O—C2H5 + H2O
浓硫酸
=
=
O
O
可能一
可能二
CH3—C—O—H + H—O—C2H5 CH3—C—O—C2H5 + H2O
浓硫酸
=
=
O
O
酯化反应原理
18
O
CH3—C—OH +H—O—C2H5
18
O
CH3—C—O—C2H5+H2O
浓H2SO4
同位素示踪法:
酸脱羟基醇脱氢
酯化反应原理
CH3—C—OH + H—O—C2H5 CH3—C—O—C2H5 + H2O
浓硫酸
=
=
O
O
酯化反应原理
练一练
1.甲酸(HCOOH)与乙醇(CH3CH2OH)发生酯化反应的化学方程式
HCOOH+CH3CH2OH?????浓硫酸HCOOCH2CH3+H2O
?
2.硝酸(HO-NO2)与乙醇(CH3CH2OH)发生酯化反应的化学方程式
CH3CH2OH + HO-NO2?????浓硫酸CH3CH2ONO2+H2O
?
二、乙酸的化学性质
O
CH3—C—O—H
酸性
酯化反应
乙酸发生化学变化时的断键位置:
课堂小结
课堂练习
1.下列事实不能体现乙酸酸性的是( )
A.乙酸滴入碳酸钠溶液中会出现气泡
B.乙酸中滴加几滴石蕊试液呈红色
C.乙酸和水能以任意比例互溶
D.长时间使用的热水瓶胆可以用乙酸来洗去水垢
C
课堂练习
2.如图所示是某有机物分子的球棍模型,该有机物中含有C、H、O三种元素,下列关于该有机物的说法中不正确的是( )
A.是食醋的主要成分
B.其官能团是羧基
C.能使酸性KMnO4溶液褪色
D.能与碱发生中和反应
C
课堂练习
3.将1 mol乙醇(其中的羟基氧用18O标记)在浓硫酸存在并加热下与足量乙酸充分反应。下列叙述不正确的是( )
A.生成的水分子中一定含有18O
B.生成的乙酸乙酯中含有18O
C.可能生成45 g乙酸乙酯
D.不可能生成相对分子质量为88的乙酸乙酯
A
课堂练习
4.丙烯酸(CH2=CHCOOH)可能发生的反应有( )
①加成反应②酯化反应③中和反应④氧化反应
A.①② B.①③ C.①②③ D.全部
D
课堂练习
5.乙酸乙酯广泛用于药物、染料、香料等工业,某学习小组设计了如图所示的两套装置,用乙醇、乙酸和浓硫酸作原料分别制备乙酸乙酯(沸点77.2℃)。下列有关说法不正确的是( )
A.浓硫酸能加快酯化反应速率
B.温度越高反应速率越快,装置a更佳
C.装置b比装置a原料损失的少
D.用饱和碳酸钠溶液收集乙酸乙酯有利于酯的纯化
B
作业布置
1.写《课时作业》P133~135页合格考题组
观
看
谢
谢
厨师烧鱼时常加食醋并加点料酒,这样鱼的味道就变得无腥、香醇,特别鲜美。
8.2.2 乙酸
学习目标
1.认识乙酸的结构
2.掌握乙酸的酸性和酯化反应
3.认识酯化反应的原理
一、乙酸的物理性质
{D27102A9-8310-4765-A935-A1911B00CA55}颜色
气味
状态
溶解度
有强烈刺激性气味
无色
液体
易溶于水和乙醇
熔点为16.6℃,沸点为117.9℃;
纯净的乙酸在16.6℃以下呈冰状固体,故又称为冰醋酸;
二、乙酸的化学性质
1.乙酸的结构:
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}分子式
结构式
结构简式
官能团
C2H4O2
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}球棍模型
比例模型
羧基
C—C—O—H
H
H
H
O
CH3COOH
—COOH
C
O
H
O
2.乙酸的酸性:
(1)弱酸性
CH3COOH CH3COO-+H+
②与活泼金属反应(以Na为例)
2CH3COOH + 2Na → 2CH3COONa+H2↑
①使指示剂变色
③ 与碱反应(以NaOH为例)
CH3COOH+NaOH→CH3COONa+H2O
④ 与碱性氧化物反应(以CaO为例)
2CH3COOH+CaO→ (CH3COO)2Ca+H2O
⑤与部分盐反应(以Na2CO3为例)
Na2CO3+2CH3COOH→ 2CH3COONa +CO2↑+H2O
H
H
C—C—O-H
H-
O
(2)酸的通性
思考探究
请看漫画,你能悟出其中的化学原理吗?
水垢主要成分:Mg(OH)2和CaCO3
思考探究
水垢主要成分:Mg(OH)2和CaCO3
2CH3COOH + Mg(OH)2 ====(CH3COO)2Mg+2H2O
2CH3COOH + CaCO3 ====(CH3COO)2Ca+H2O+CO2↑
结论:
酸性 CH3COOH>H2CO3
二、乙酸的化学性质
厨师烧鱼时常加醋并加点酒,这样鱼的味道就变得无腥、香醇,特别鲜美。
这用化学知识能解释哦!
基础实验
【实验2】向一支试管中加入3mL乙醇,然后边振荡试管,边慢慢加入2mL98%的浓硫酸和2mL冰醋酸,按图所示连接好装置。用酒精灯小心加热试管3~5min,产生的蒸气经导管通到饱和碳酸钠溶液的液面上方。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}实验序号
实验现象
实验2
饱和Na2CO3溶液上层有透明的不溶于水的油状液体产生,并可以闻到香味
二、乙酸的化学性质
3.酯化反应:
酸和醇作用生成酯和水的反应叫做酯化反应。
CH3COOH + HOC2H5 CH3COOC2H5 + H2O
乙酸乙酯
浓硫酸
△
实验制备乙酸乙酯的注意事项
1.装药品的顺序如何?
先加乙醇,再加浓硫酸,最后加乙酸。?
2.浓硫酸的作用是什么?
3.饱和碳酸钠溶液有什么作用?
①反应消耗掉乙酸。
②溶解挥发出的乙醇。
③降低乙酸乙酯的溶解度。
①催化剂
②吸水剂
CH3COOH + HOC2H5 CH3COOC2H5 + H2O
浓硫酸
△
饱和碳酸钠溶液
酯化反应的原理
思考
酯化反应生成的水,里面的原子来源于哪里呢?
CH3COOH + HOC2H5 CH3COOC2H5 + H2O
浓硫酸
△
酯化反应的原理
CH3—C—OH + H—O—C2H5 CH3—C—O—C2H5 + H2O
浓硫酸
=
=
O
O
可能一
可能二
CH3—C—O—H + H—O—C2H5 CH3—C—O—C2H5 + H2O
浓硫酸
=
=
O
O
酯化反应原理
18
O
CH3—C—OH +H—O—C2H5
18
O
CH3—C—O—C2H5+H2O
浓H2SO4
同位素示踪法:
酸脱羟基醇脱氢
酯化反应原理
CH3—C—OH + H—O—C2H5 CH3—C—O—C2H5 + H2O
浓硫酸
=
=
O
O
酯化反应原理
练一练
1.甲酸(HCOOH)与乙醇(CH3CH2OH)发生酯化反应的化学方程式
HCOOH+CH3CH2OH?????浓硫酸HCOOCH2CH3+H2O
?
2.硝酸(HO-NO2)与乙醇(CH3CH2OH)发生酯化反应的化学方程式
CH3CH2OH + HO-NO2?????浓硫酸CH3CH2ONO2+H2O
?
二、乙酸的化学性质
O
CH3—C—O—H
酸性
酯化反应
乙酸发生化学变化时的断键位置:
课堂小结
课堂练习
1.下列事实不能体现乙酸酸性的是( )
A.乙酸滴入碳酸钠溶液中会出现气泡
B.乙酸中滴加几滴石蕊试液呈红色
C.乙酸和水能以任意比例互溶
D.长时间使用的热水瓶胆可以用乙酸来洗去水垢
C
课堂练习
2.如图所示是某有机物分子的球棍模型,该有机物中含有C、H、O三种元素,下列关于该有机物的说法中不正确的是( )
A.是食醋的主要成分
B.其官能团是羧基
C.能使酸性KMnO4溶液褪色
D.能与碱发生中和反应
C
课堂练习
3.将1 mol乙醇(其中的羟基氧用18O标记)在浓硫酸存在并加热下与足量乙酸充分反应。下列叙述不正确的是( )
A.生成的水分子中一定含有18O
B.生成的乙酸乙酯中含有18O
C.可能生成45 g乙酸乙酯
D.不可能生成相对分子质量为88的乙酸乙酯
A
课堂练习
4.丙烯酸(CH2=CHCOOH)可能发生的反应有( )
①加成反应②酯化反应③中和反应④氧化反应
A.①② B.①③ C.①②③ D.全部
D
课堂练习
5.乙酸乙酯广泛用于药物、染料、香料等工业,某学习小组设计了如图所示的两套装置,用乙醇、乙酸和浓硫酸作原料分别制备乙酸乙酯(沸点77.2℃)。下列有关说法不正确的是( )
A.浓硫酸能加快酯化反应速率
B.温度越高反应速率越快,装置a更佳
C.装置b比装置a原料损失的少
D.用饱和碳酸钠溶液收集乙酸乙酯有利于酯的纯化
B
作业布置
1.写《课时作业》P133~135页合格考题组
观
看
谢
谢
