9.1.1 金属的冶炼方法 课件 2022-2023学年高一下学期化学苏教版(2020)必修第二册
文档属性
| 名称 | 9.1.1 金属的冶炼方法 课件 2022-2023学年高一下学期化学苏教版(2020)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 108.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-10 16:35:43 | ||
图片预览







文档简介
9.1.1 金属的冶炼方法
学习目标
1.能依据金属活泼性不同,采用不同的冶炼方法
2.感受物质制备中的技术思想
一、金属的物理性质
1.金属材料性能:
有良好的 ,坚固耐用,具有导电、导热性能。
可塑性
2.金属存在方式:
游离态
化合态
如:Au、Pt等
如:Na、K、Fe等绝大多数金属
赤铁矿
黄铜矿
一些金属元素以离子或矿石的形式分布于海洋中,
如钠Na、镁Mg、锰Mn等
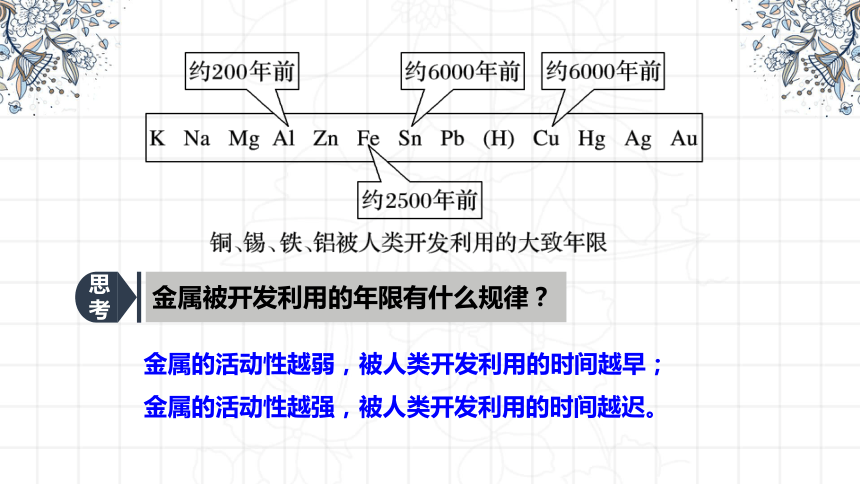
思考
金属被开发利用的年限有什么规律?
金属的活动性越弱,被人类开发利用的时间越早;
金属的活动性越强,被人类开发利用的时间越迟。
二、金属的冶炼
1.概念:
利用化学反应使金属元素从化合态变为游离态的过程。
2.实质:
利用 ,使金属矿物中的金属阳离子得到电子生成金属单质。
氧化还原反应
以赤铁矿为例:
Fe2O3 Fe
失去氧元素(还原)
思考
活动性不同的金属的冶炼方法相同吗?
二、金属的冶炼
3.冶炼方法:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
电解法
热还原法
热分解法
金属单质还原性减弱,金属阳离子氧化性增强
二、金属的冶炼
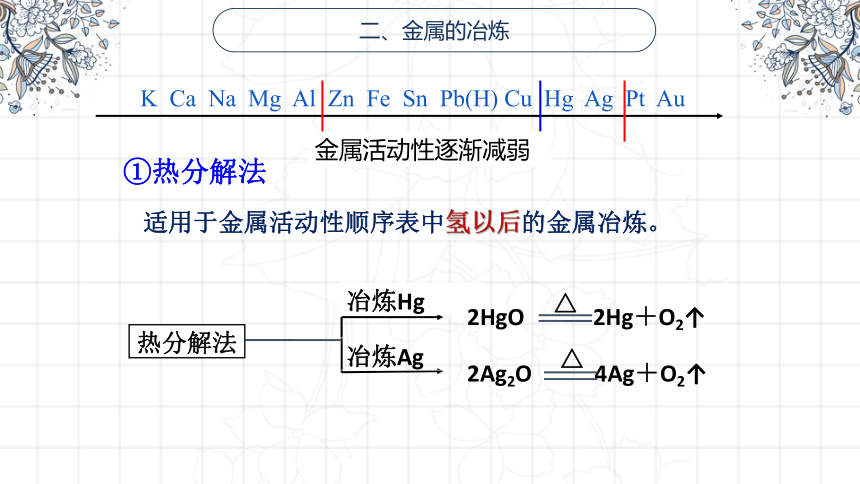
①热分解法
热分解法
冶炼Ag
冶炼Hg
2HgO 2Hg+O2↑
△
2Ag2O 4Ag+O2↑
△
适用于金属活动性顺序表中氢以后的金属冶炼。
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
金属活动性逐渐减弱
二、金属的冶炼
②高温还原法
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
金属活动性逐渐减弱
热还原法
高炉炼铁
铝热法
Fe2O3+3CO 2Fe+3CO2
高温
Fe2O3+2Al 2Fe+Al2O3
高温
炼铁
炼铜
注:常见的还原剂有: C 、CO、H2、Al等。
CuO+H2 === Cu + H2O
高温
其它方法
湿法炼铜:Fe+CuSO4=FeSO4+Cu
火法炼铜:
Cu2S+O2?2Cu+SO2
?
二、金属的冶炼
③电解法
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
金属活动性逐渐减弱
冶炼钠
冶炼镁
冶炼铝
电解法
MgCl2 (熔融) Mg+Cl2↑
通电
2NaCl(熔融) 2Na+Cl2↑
通电
2Al2O3(熔融) 4Al+3O2↑
通电
冰晶石
三、高炉炼铁
石灰石
铁矿石
焦炭
工业炼铁的主要设备
作用:造渣
C+O2===CO2 放热
点燃
3CO+Fe2O3===2Fe+3CO2
高温
(生铁)
高炉
出铁口比出渣口低:由于生铁的密度比炉渣大。
C+CO2===2CO
高温
作用:①提供热量
②产生CO
目的:
维持炉内高温
(炉渣的主要成分)
CaCO3 === CaO+CO2↑
高温
SiO2+CaO === CaSiO3
高温
三、高炉炼铁
四、铝热反应
1.概念:
铝和某些金属氧化物在高温下发生剧烈反应并放出大量热的化学反应。
2.实质:
Al作还原剂,另一种金属氧化物作氧化剂,用铝将氧化物中的金属置换出来。
基础实验
实验现象
反应原理
镁条剧烈燃烧,发出耀眼的白光,纸漏斗下部被烧穿,有红热状态的熔融物落入沙中,液珠冷却后变为黑色固体。
Fe2O3+2Al 2Fe+Al2O3
高温
铝热剂:铝与金属氧化物的混合物。
镁条为引燃剂
氯酸钾为助燃剂
铝热剂
四、铝热反应
3.铝热反应的应用:
①焊接钢轨。
②冶炼高熔点难冶炼的相对不活泼的金属如Mn,Cr,V等。
五、铝的冶炼
铝土矿
NaOH溶液
CO2
Al(OH)3
Al2O3
Al
NaAlO2溶液
①溶解
④过滤
⑤灼烧
⑥电解
②过滤
③酸化
思考
相关化学反应方程式分别是什么?
五、铝的冶炼
铝土矿
NaOH溶液
CO2
Al(OH)3
Al2O3
Al
NaAlO2溶液
①溶解
④过滤
⑤灼烧
⑥电解
②过滤
③酸化
Al2O3 +2NaOH === 2NaAlO2 + H2O
NaAlO2 + CO2 + 2H2O === Al(OH)3↓+ NaHCO3
电解时加入冰晶石(Na3AlF6),降低氧化铝的熔融温度(从2054℃降低至900℃)。
2Al(OH)3 === Al2O3+3H2O
高温
2Al2O3 === 4Al + 3O2↑
电解
①
③
⑤
⑥
课堂小结
金属的冶炼方法与金属活动性的关系
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
电解法
高温还原法
热分解法
物理提炼法
铁的冶炼
铝热反应
铝的冶炼
课堂练习
1.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平,如图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于( )
A.金属的化合价高低
B.金属的活动性强弱
C.金属的导电性强弱
D.金属在地壳中的含量多少
B
课堂练习
2.下列说法正确的是( )
A.有些活泼金属如铝,可作高温还原法的还原剂
B.用电解NaCl溶液的方法来冶炼金属钠
C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝
D.回收旧金属可以重新制成金属或它们的化合物
AD
课堂练习
3.下列说法中,正确的是( )
A.金属的冶炼是把金属单质从其矿物中分离出来
B.金属冶炼过程中,被冶炼的金属只能被氧化
C.金属冶炼过程中,被冶炼的金属只能被还原
D.金属冶炼过程中,被冶炼的金属既可被氧化,也可被还原
C
课堂练习
4.下列金属的冶炼方法中正确的是( )
A.电解氯化钠溶液冶炼金属钠
B.电解熔融的氯化铝冶炼金属铝
C.将铁粉与氧化镁混合加热冶炼镁
D.用一氧化碳还原氧化铁冶炼铁
D
作业布置
1.预习专题九第二单元
2.书写《导与练》83~86页
观
看
谢
谢
学习目标
1.能依据金属活泼性不同,采用不同的冶炼方法
2.感受物质制备中的技术思想
一、金属的物理性质
1.金属材料性能:
有良好的 ,坚固耐用,具有导电、导热性能。
可塑性
2.金属存在方式:
游离态
化合态
如:Au、Pt等
如:Na、K、Fe等绝大多数金属
赤铁矿
黄铜矿
一些金属元素以离子或矿石的形式分布于海洋中,
如钠Na、镁Mg、锰Mn等
思考
金属被开发利用的年限有什么规律?
金属的活动性越弱,被人类开发利用的时间越早;
金属的活动性越强,被人类开发利用的时间越迟。
二、金属的冶炼
1.概念:
利用化学反应使金属元素从化合态变为游离态的过程。
2.实质:
利用 ,使金属矿物中的金属阳离子得到电子生成金属单质。
氧化还原反应
以赤铁矿为例:
Fe2O3 Fe
失去氧元素(还原)
思考
活动性不同的金属的冶炼方法相同吗?
二、金属的冶炼
3.冶炼方法:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
电解法
热还原法
热分解法
金属单质还原性减弱,金属阳离子氧化性增强
二、金属的冶炼
①热分解法
热分解法
冶炼Ag
冶炼Hg
2HgO 2Hg+O2↑
△
2Ag2O 4Ag+O2↑
△
适用于金属活动性顺序表中氢以后的金属冶炼。
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
金属活动性逐渐减弱
二、金属的冶炼
②高温还原法
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
金属活动性逐渐减弱
热还原法
高炉炼铁
铝热法
Fe2O3+3CO 2Fe+3CO2
高温
Fe2O3+2Al 2Fe+Al2O3
高温
炼铁
炼铜
注:常见的还原剂有: C 、CO、H2、Al等。
CuO+H2 === Cu + H2O
高温
其它方法
湿法炼铜:Fe+CuSO4=FeSO4+Cu
火法炼铜:
Cu2S+O2?2Cu+SO2
?
二、金属的冶炼
③电解法
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
金属活动性逐渐减弱
冶炼钠
冶炼镁
冶炼铝
电解法
MgCl2 (熔融) Mg+Cl2↑
通电
2NaCl(熔融) 2Na+Cl2↑
通电
2Al2O3(熔融) 4Al+3O2↑
通电
冰晶石
三、高炉炼铁
石灰石
铁矿石
焦炭
工业炼铁的主要设备
作用:造渣
C+O2===CO2 放热
点燃
3CO+Fe2O3===2Fe+3CO2
高温
(生铁)
高炉
出铁口比出渣口低:由于生铁的密度比炉渣大。
C+CO2===2CO
高温
作用:①提供热量
②产生CO
目的:
维持炉内高温
(炉渣的主要成分)
CaCO3 === CaO+CO2↑
高温
SiO2+CaO === CaSiO3
高温
三、高炉炼铁
四、铝热反应
1.概念:
铝和某些金属氧化物在高温下发生剧烈反应并放出大量热的化学反应。
2.实质:
Al作还原剂,另一种金属氧化物作氧化剂,用铝将氧化物中的金属置换出来。
基础实验
实验现象
反应原理
镁条剧烈燃烧,发出耀眼的白光,纸漏斗下部被烧穿,有红热状态的熔融物落入沙中,液珠冷却后变为黑色固体。
Fe2O3+2Al 2Fe+Al2O3
高温
铝热剂:铝与金属氧化物的混合物。
镁条为引燃剂
氯酸钾为助燃剂
铝热剂
四、铝热反应
3.铝热反应的应用:
①焊接钢轨。
②冶炼高熔点难冶炼的相对不活泼的金属如Mn,Cr,V等。
五、铝的冶炼
铝土矿
NaOH溶液
CO2
Al(OH)3
Al2O3
Al
NaAlO2溶液
①溶解
④过滤
⑤灼烧
⑥电解
②过滤
③酸化
思考
相关化学反应方程式分别是什么?
五、铝的冶炼
铝土矿
NaOH溶液
CO2
Al(OH)3
Al2O3
Al
NaAlO2溶液
①溶解
④过滤
⑤灼烧
⑥电解
②过滤
③酸化
Al2O3 +2NaOH === 2NaAlO2 + H2O
NaAlO2 + CO2 + 2H2O === Al(OH)3↓+ NaHCO3
电解时加入冰晶石(Na3AlF6),降低氧化铝的熔融温度(从2054℃降低至900℃)。
2Al(OH)3 === Al2O3+3H2O
高温
2Al2O3 === 4Al + 3O2↑
电解
①
③
⑤
⑥
课堂小结
金属的冶炼方法与金属活动性的关系
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
电解法
高温还原法
热分解法
物理提炼法
铁的冶炼
铝热反应
铝的冶炼
课堂练习
1.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平,如图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于( )
A.金属的化合价高低
B.金属的活动性强弱
C.金属的导电性强弱
D.金属在地壳中的含量多少
B
课堂练习
2.下列说法正确的是( )
A.有些活泼金属如铝,可作高温还原法的还原剂
B.用电解NaCl溶液的方法来冶炼金属钠
C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝
D.回收旧金属可以重新制成金属或它们的化合物
AD
课堂练习
3.下列说法中,正确的是( )
A.金属的冶炼是把金属单质从其矿物中分离出来
B.金属冶炼过程中,被冶炼的金属只能被氧化
C.金属冶炼过程中,被冶炼的金属只能被还原
D.金属冶炼过程中,被冶炼的金属既可被氧化,也可被还原
C
课堂练习
4.下列金属的冶炼方法中正确的是( )
A.电解氯化钠溶液冶炼金属钠
B.电解熔融的氯化铝冶炼金属铝
C.将铁粉与氧化镁混合加热冶炼镁
D.用一氧化碳还原氧化铁冶炼铁
D
作业布置
1.预习专题九第二单元
2.书写《导与练》83~86页
观
看
谢
谢
