2022-2023学年下学期高二化学人教版(2019)选择性必修23.3.2 过渡晶体与混合型晶体课件(31张PPT)
文档属性
| 名称 | 2022-2023学年下学期高二化学人教版(2019)选择性必修23.3.2 过渡晶体与混合型晶体课件(31张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-09 18:03:45 | ||
图片预览






文档简介
(共31张PPT)
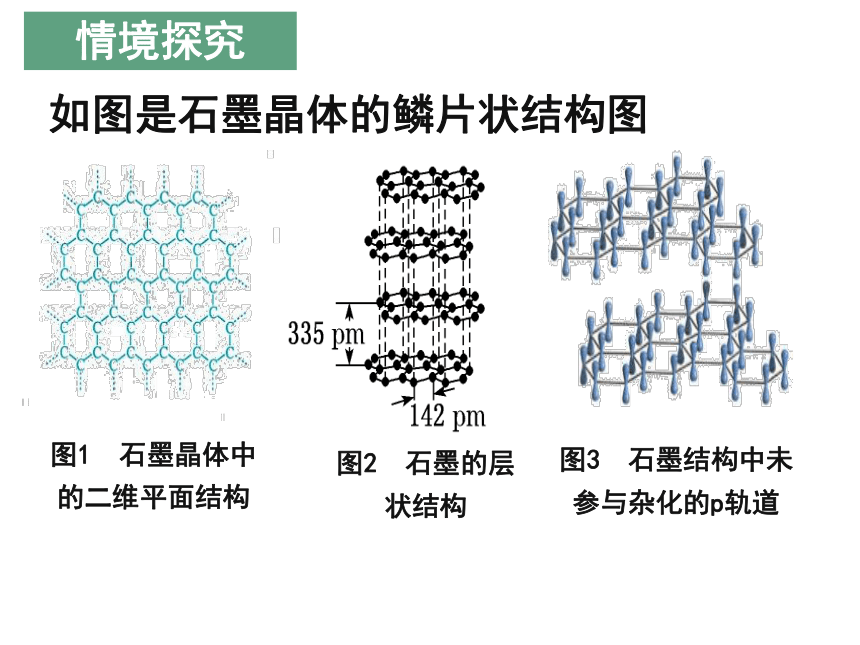
金刚石的结构,石墨呢?
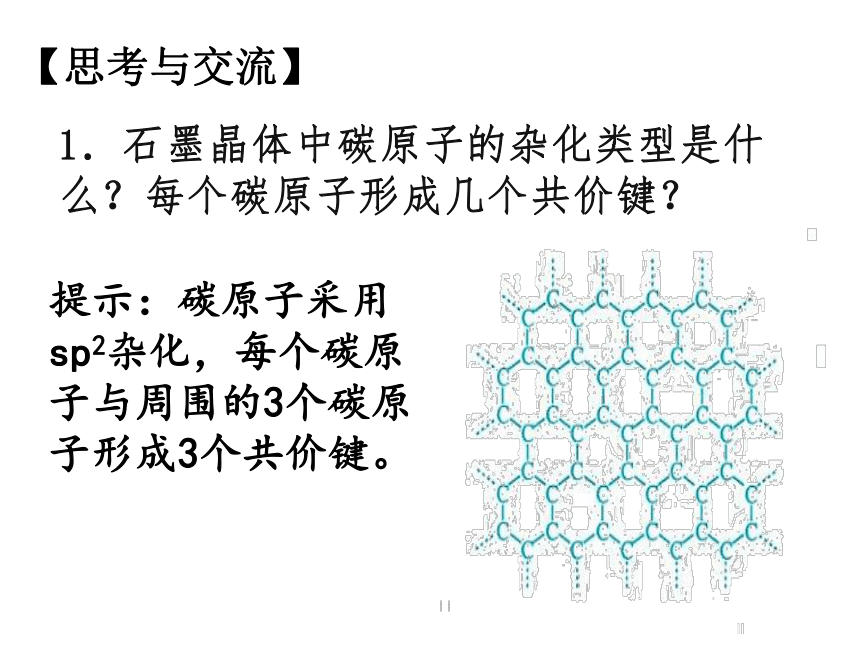
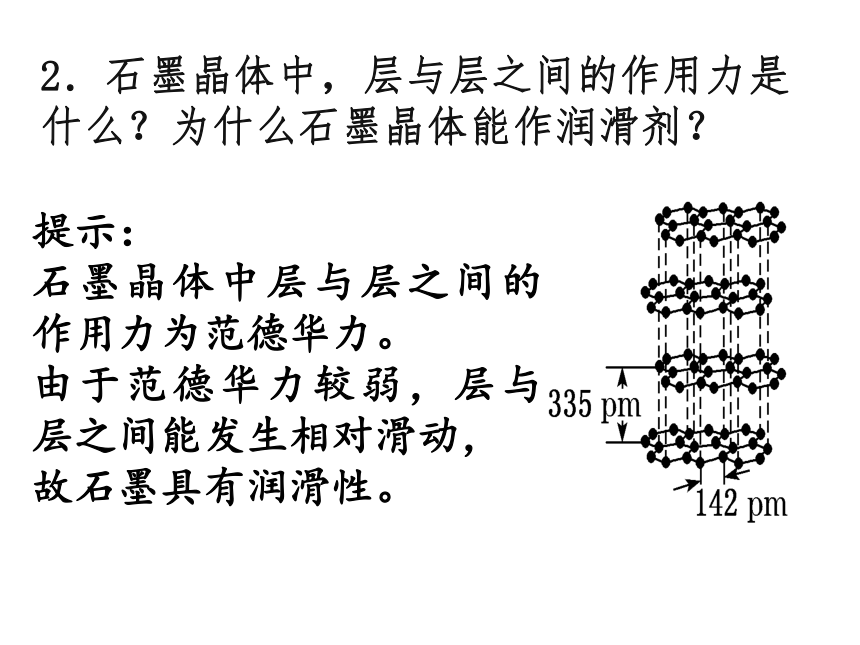
如图是石墨晶体的鳞片状结构图
情境探究
图1 石墨晶体中的二维平面结构
图2 石墨的层状结构
图3 石墨结构中未参与杂化的p轨道
1.石墨晶体中碳原子的杂化类型是什么?每个碳原子形成几个共价键?
提示:碳原子采用sp2杂化,每个碳原子与周围的3个碳原子形成3个共价键。
【思考与交流】
2.石墨晶体中,层与层之间的作用力是什么?为什么石墨晶体能作润滑剂?
提示:
石墨晶体中层与层之间的作用力为范德华力。
由于范德华力较弱,层与层之间能发生相对滑动,
故石墨具有润滑性。
提示:石墨晶体中的碳原子采用sp2杂化,每个碳原子都有一个电子处于未参与杂化的2p轨道上,它的原子轨道垂直于碳原子平面(如图所示),这些电子在整个碳原子平面上运动,相当于金属晶体中的自由电子,故石墨晶体能导电。
3.为什么石墨晶体能导电?为什么说石墨是混合型晶体?
提示:
石墨晶体中层内碳原子间以共价键形成平面结构,类似共价晶体;
石墨晶体中所有的p轨道相互平行且相互重叠,使p轨道上的电子可以在整个碳原子平面中运动,因此石墨有类似金属晶体的导电性;
石墨晶体中层与层之间以范德华力相结合,类似分子晶体,因此石墨属于混合型晶体。
第三章 晶体结构与性质
第二节
金属晶体和离子晶体
第2课时 过渡晶体与混合型晶体
晶体类型的比较
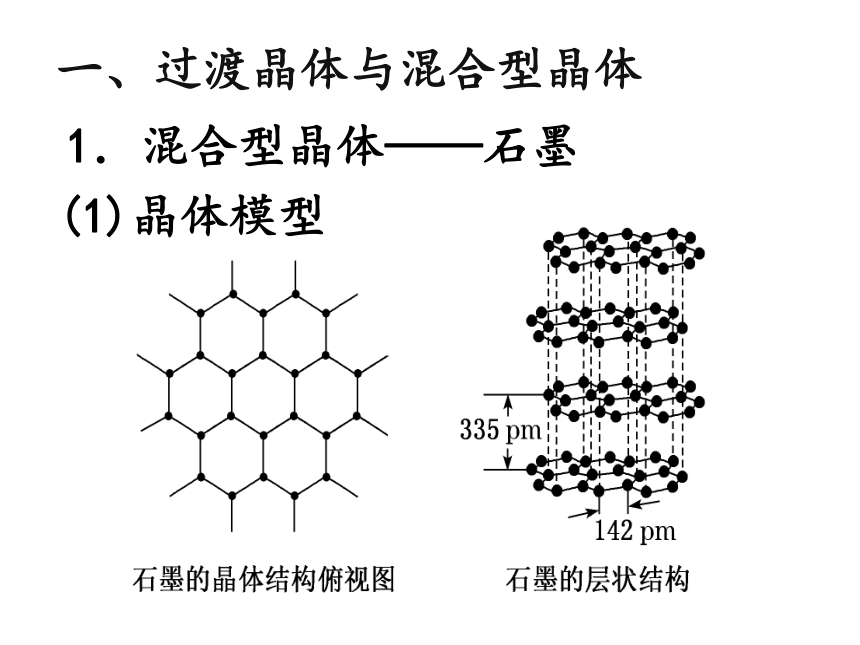
1.混合型晶体——石墨
一、过渡晶体与混合型晶体
(1)晶体模型
(2)结构特点——层状结构
①层内:碳原子采取sp2杂化,以共价键(σ键)结合,形成平面六元并环结构。
层间:范德华力。
石墨的二维结构内,每个碳原子的配位数为3,有一个未参与杂化的2p电子,它的原子轨道垂直于碳原子平面。
(3)晶体类型:
石墨晶体中,既有共价键,又有金属键和范德华力,属于混合型晶体。
(4)性质:熔点很高、质软、易导电等。
石墨晶体中C原子数与C—C数之比为______,即12 g石墨晶体中含______个C—C共价键。
【思考】
2:3
1.5NA
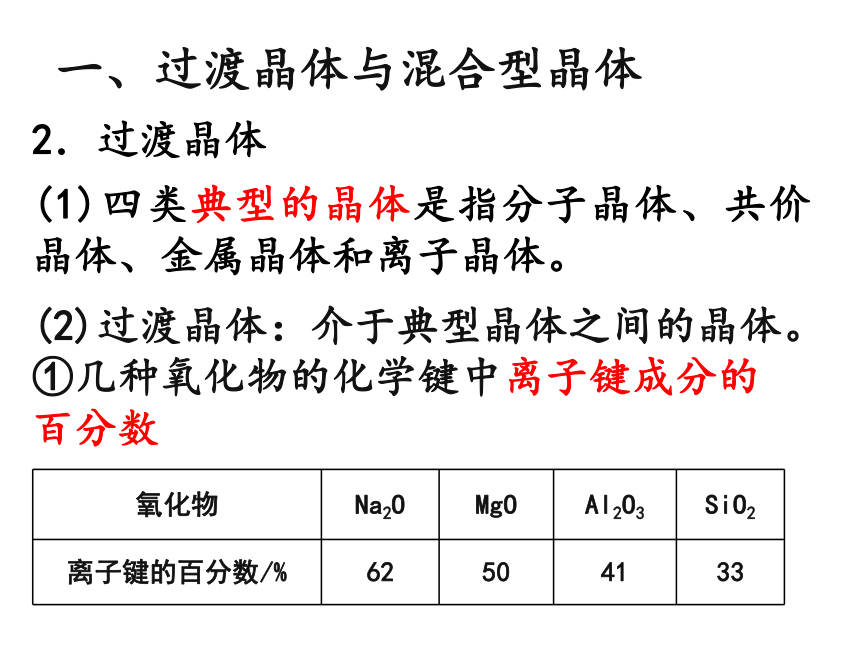
2.过渡晶体
(1)四类典型的晶体是指分子晶体、共价晶体、金属晶体和离子晶体。
氧化物 Na2O MgO Al2O3 SiO2
离子键的百分数/% 62 50 41 33
一、过渡晶体与混合型晶体
(2)过渡晶体:介于典型晶体之间的晶体。
①几种氧化物的化学键中离子键成分的百分数
从上表可知,表中4种氧化物晶体中的化学键既不是纯粹的离子键,也不是纯粹的共价键,这些晶体既不是纯粹的离子晶体也不是纯粹的共价晶体,只是离子晶体与共价晶体之间的过渡晶体。
②偏向离子晶体的过渡晶体在许多性质上与纯粹的离子晶体接近,因而通常当作离子晶体来处理,如Na2O等。同样,偏向共价晶体的过渡晶体则当作共价晶体来处理,如Al2O3、SiO2等。
氧化物 Na2O MgO Al2O3 SiO2
离子键的百分数/% 62 50 41 33
阅读人教P89
【分析下表】
偏向离子晶体的,当离子晶体处理;
偏向共价晶体的,当共价晶体处理。
分子晶体中,离子键成分的百分数更小,且共价键不再贯穿整个晶体。
④四类晶体都有过渡晶体
1、四种典型晶体类型:分子晶体、共价晶体、金属晶体和离子晶体;
事实上,纯粹的典型晶体是不多的,大多数晶体是它们之间的过渡晶体,四类典型晶体都有过渡型。
【小结】
2、石墨是典型的混合型晶体。兼有金属晶体(导电性)、分子晶体(润滑性)和共价晶体(高熔、沸点)的性质,其熔点比金刚石的还高。
(1)不同类型晶体熔、沸点的比较:
3.晶体熔、沸点高低的比较方法
①共价晶体>离子晶体>分子晶体。
②金属晶体的熔、沸点差别很大。如钨、铂等熔、沸点很高;汞、铯等熔、沸点很低。
(2)同种类型晶体熔、沸点的比较:
②离子晶体
一般地说,阴、阳离子的电荷数越多,离子半径越小,则离子键就越强,晶格能越大,其离子晶体的熔、沸点就越高。
如熔点:MgO>NaCl>CsCl。
①共价晶体
原子半径越小→键长越短→键能越大→熔、沸点越高。
如熔点:金刚石>硅晶体。
③分子晶体
a.分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常得高。如沸点:H2O>H2Te>H2Se>H2S。
b.组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。
如熔、沸点:SnH4>GeH4>SiH4>CH4。
c.组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高。如熔、沸点:CO>N2,CH3OH>CH3CH3。
④金属晶体
金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高。
如熔、沸点:Na<Mg<Al。
(1)离子晶体中一定存在离子键,可能存在共价键,一定不存在分子间作用力。
注意:
(2)只有分子晶体中存在单个分子。
(3)某些离子晶体的熔点高于某些共价晶体的熔点。如MgO(2 852 ℃)>SiO2(1 710 ℃)。
(4)某些分子晶体的熔点高于某些金属晶体的熔点。如碱金属熔点较低。
(5)个别金属的熔点高于某些共价晶体的熔点。如钨(3 410 ℃)>SiO2(1 710 ℃)。
(6)合金的熔点一般低于成分金属的熔点。
练1.石墨晶体是层状结构(如图)。下列有关石墨晶体的说法正确的一组是( )
①石墨中存在两种作用力 ②石墨是混合型晶体
③石墨中的C为sp2杂化
④石墨熔点、沸点都比金刚石低
⑤石墨中碳原子数和C—C数之比为1∶2
⑥石墨和金刚石的硬度相同
⑦石墨层内导电性和层间导电性不同
⑧每个六元环完全占有的碳原子数是2
A.全对 B.除⑤外
C.除①④⑤⑥外 D.除⑥⑦⑧外
C
在石墨烯晶体中,每个C原子连接____个六元环,每个六元环占有___个C原子。
2.碳有多种同素异形体,其中石墨烯的晶体结构如图所示:
3
2
1.四类典型晶体的比较
类型 项目 分子晶体 共价晶体 金属晶体 离子晶体
构成晶体的粒子
粒子间的作用
确定作用力强弱的一般判断方法
二、四种典型晶体类型的比
分子
原子
金属阳离子
和自由电子
阴、阳离子
范德华力
或氢键
共价键
金属键
离子键
组成结构相似时,
比较相对分子质量
键能、键长
(原子半径)
离子半径、
金属阳离子的电荷数
离子半径、
离子的电荷数
类型 项目 分子晶体 共价晶体 金属晶体 离子晶体
熔、沸点
硬度
导电性
溶解性
机械加工性
延展性
较低
较小
不良导体(部分
溶于水发生电
离后导电)
相似相溶
不良
差
很高
很大
不良导体
(个别为半导体)
一般不溶
不良
差
差别较大(汞常温下为液态,钨熔点为3 410 ℃)
差别较大
良导体
一般不溶于水,
少数与水反应
优良
优良
较高
略硬而脆
不良导体(
熔化后或溶
于水导电)
多数易溶
不良
差
(1)不同类型晶体熔、沸点的比较:
2.晶体熔、沸点高低的比较方法
①共价晶体>离子晶体>分子晶体。
②金属晶体的熔、沸点差别很大。如钨、铂等熔、沸点很高;汞、铯等熔、沸点很低。
(2)同种类型晶体熔、沸点的比较:
②离子晶体
一般地说,阴、阳离子的电荷数越多,离子半径越小,则离子键就越强,晶格能越大,其离子晶体的熔、沸点就越高。
如熔点:MgO>NaCl>CsCl。
①共价晶体
原子半径越小→键长越短→键能越大→熔、沸点越高。
如熔点:金刚石>硅晶体。
③分子晶体
a.分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常得高。如沸点:H2O>H2Te>H2Se>H2S。
b.组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。
如熔、沸点:SnH4>GeH4>SiH4>CH4。
c.组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高。如熔、沸点:CO>N2,CH3OH>CH3CH3。
④金属晶体
金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高。
如熔、沸点:Na<Mg<Al。
(1)离子晶体中一定存在离子键,可能存在共价键,一定不存在分子间作用力。
注意:
(2)只有分子晶体中存在单个分子。
(3)某些离子晶体的熔点高于某些共价晶体的熔点。如MgO(2 852 ℃)>SiO2(1 710 ℃)。
(4)某些分子晶体的熔点高于某些金属晶体的熔点。如碱金属熔点较低。
(5)个别金属的熔点高于某些共价晶体的熔点。如钨(3 410 ℃)>SiO2(1 710 ℃)。
(6)合金的熔点一般低于成分金属的熔点。
练3、下表给出几种化合物的熔点和沸点:
物质 NaCl MgCl2 AlCl3 CCl4
熔点/℃ 801 714 190 -22.9
沸点/℃ 1 465 1 412 178 76.8
关于表中4种化合物有下列说法,其中正确的是( )
①AlCl3在加热时可升华
②CCl4属于分子晶体
③1 500 ℃时NaCl可形成气体分子
④AlCl3是典型的离子晶体
A.①②④ B.③④ C.①②③ D.①②③④
C
金刚石的结构,石墨呢?
如图是石墨晶体的鳞片状结构图
情境探究
图1 石墨晶体中的二维平面结构
图2 石墨的层状结构
图3 石墨结构中未参与杂化的p轨道
1.石墨晶体中碳原子的杂化类型是什么?每个碳原子形成几个共价键?
提示:碳原子采用sp2杂化,每个碳原子与周围的3个碳原子形成3个共价键。
【思考与交流】
2.石墨晶体中,层与层之间的作用力是什么?为什么石墨晶体能作润滑剂?
提示:
石墨晶体中层与层之间的作用力为范德华力。
由于范德华力较弱,层与层之间能发生相对滑动,
故石墨具有润滑性。
提示:石墨晶体中的碳原子采用sp2杂化,每个碳原子都有一个电子处于未参与杂化的2p轨道上,它的原子轨道垂直于碳原子平面(如图所示),这些电子在整个碳原子平面上运动,相当于金属晶体中的自由电子,故石墨晶体能导电。
3.为什么石墨晶体能导电?为什么说石墨是混合型晶体?
提示:
石墨晶体中层内碳原子间以共价键形成平面结构,类似共价晶体;
石墨晶体中所有的p轨道相互平行且相互重叠,使p轨道上的电子可以在整个碳原子平面中运动,因此石墨有类似金属晶体的导电性;
石墨晶体中层与层之间以范德华力相结合,类似分子晶体,因此石墨属于混合型晶体。
第三章 晶体结构与性质
第二节
金属晶体和离子晶体
第2课时 过渡晶体与混合型晶体
晶体类型的比较
1.混合型晶体——石墨
一、过渡晶体与混合型晶体
(1)晶体模型
(2)结构特点——层状结构
①层内:碳原子采取sp2杂化,以共价键(σ键)结合,形成平面六元并环结构。
层间:范德华力。
石墨的二维结构内,每个碳原子的配位数为3,有一个未参与杂化的2p电子,它的原子轨道垂直于碳原子平面。
(3)晶体类型:
石墨晶体中,既有共价键,又有金属键和范德华力,属于混合型晶体。
(4)性质:熔点很高、质软、易导电等。
石墨晶体中C原子数与C—C数之比为______,即12 g石墨晶体中含______个C—C共价键。
【思考】
2:3
1.5NA
2.过渡晶体
(1)四类典型的晶体是指分子晶体、共价晶体、金属晶体和离子晶体。
氧化物 Na2O MgO Al2O3 SiO2
离子键的百分数/% 62 50 41 33
一、过渡晶体与混合型晶体
(2)过渡晶体:介于典型晶体之间的晶体。
①几种氧化物的化学键中离子键成分的百分数
从上表可知,表中4种氧化物晶体中的化学键既不是纯粹的离子键,也不是纯粹的共价键,这些晶体既不是纯粹的离子晶体也不是纯粹的共价晶体,只是离子晶体与共价晶体之间的过渡晶体。
②偏向离子晶体的过渡晶体在许多性质上与纯粹的离子晶体接近,因而通常当作离子晶体来处理,如Na2O等。同样,偏向共价晶体的过渡晶体则当作共价晶体来处理,如Al2O3、SiO2等。
氧化物 Na2O MgO Al2O3 SiO2
离子键的百分数/% 62 50 41 33
阅读人教P89
【分析下表】
偏向离子晶体的,当离子晶体处理;
偏向共价晶体的,当共价晶体处理。
分子晶体中,离子键成分的百分数更小,且共价键不再贯穿整个晶体。
④四类晶体都有过渡晶体
1、四种典型晶体类型:分子晶体、共价晶体、金属晶体和离子晶体;
事实上,纯粹的典型晶体是不多的,大多数晶体是它们之间的过渡晶体,四类典型晶体都有过渡型。
【小结】
2、石墨是典型的混合型晶体。兼有金属晶体(导电性)、分子晶体(润滑性)和共价晶体(高熔、沸点)的性质,其熔点比金刚石的还高。
(1)不同类型晶体熔、沸点的比较:
3.晶体熔、沸点高低的比较方法
①共价晶体>离子晶体>分子晶体。
②金属晶体的熔、沸点差别很大。如钨、铂等熔、沸点很高;汞、铯等熔、沸点很低。
(2)同种类型晶体熔、沸点的比较:
②离子晶体
一般地说,阴、阳离子的电荷数越多,离子半径越小,则离子键就越强,晶格能越大,其离子晶体的熔、沸点就越高。
如熔点:MgO>NaCl>CsCl。
①共价晶体
原子半径越小→键长越短→键能越大→熔、沸点越高。
如熔点:金刚石>硅晶体。
③分子晶体
a.分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常得高。如沸点:H2O>H2Te>H2Se>H2S。
b.组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。
如熔、沸点:SnH4>GeH4>SiH4>CH4。
c.组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高。如熔、沸点:CO>N2,CH3OH>CH3CH3。
④金属晶体
金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高。
如熔、沸点:Na<Mg<Al。
(1)离子晶体中一定存在离子键,可能存在共价键,一定不存在分子间作用力。
注意:
(2)只有分子晶体中存在单个分子。
(3)某些离子晶体的熔点高于某些共价晶体的熔点。如MgO(2 852 ℃)>SiO2(1 710 ℃)。
(4)某些分子晶体的熔点高于某些金属晶体的熔点。如碱金属熔点较低。
(5)个别金属的熔点高于某些共价晶体的熔点。如钨(3 410 ℃)>SiO2(1 710 ℃)。
(6)合金的熔点一般低于成分金属的熔点。
练1.石墨晶体是层状结构(如图)。下列有关石墨晶体的说法正确的一组是( )
①石墨中存在两种作用力 ②石墨是混合型晶体
③石墨中的C为sp2杂化
④石墨熔点、沸点都比金刚石低
⑤石墨中碳原子数和C—C数之比为1∶2
⑥石墨和金刚石的硬度相同
⑦石墨层内导电性和层间导电性不同
⑧每个六元环完全占有的碳原子数是2
A.全对 B.除⑤外
C.除①④⑤⑥外 D.除⑥⑦⑧外
C
在石墨烯晶体中,每个C原子连接____个六元环,每个六元环占有___个C原子。
2.碳有多种同素异形体,其中石墨烯的晶体结构如图所示:
3
2
1.四类典型晶体的比较
类型 项目 分子晶体 共价晶体 金属晶体 离子晶体
构成晶体的粒子
粒子间的作用
确定作用力强弱的一般判断方法
二、四种典型晶体类型的比
分子
原子
金属阳离子
和自由电子
阴、阳离子
范德华力
或氢键
共价键
金属键
离子键
组成结构相似时,
比较相对分子质量
键能、键长
(原子半径)
离子半径、
金属阳离子的电荷数
离子半径、
离子的电荷数
类型 项目 分子晶体 共价晶体 金属晶体 离子晶体
熔、沸点
硬度
导电性
溶解性
机械加工性
延展性
较低
较小
不良导体(部分
溶于水发生电
离后导电)
相似相溶
不良
差
很高
很大
不良导体
(个别为半导体)
一般不溶
不良
差
差别较大(汞常温下为液态,钨熔点为3 410 ℃)
差别较大
良导体
一般不溶于水,
少数与水反应
优良
优良
较高
略硬而脆
不良导体(
熔化后或溶
于水导电)
多数易溶
不良
差
(1)不同类型晶体熔、沸点的比较:
2.晶体熔、沸点高低的比较方法
①共价晶体>离子晶体>分子晶体。
②金属晶体的熔、沸点差别很大。如钨、铂等熔、沸点很高;汞、铯等熔、沸点很低。
(2)同种类型晶体熔、沸点的比较:
②离子晶体
一般地说,阴、阳离子的电荷数越多,离子半径越小,则离子键就越强,晶格能越大,其离子晶体的熔、沸点就越高。
如熔点:MgO>NaCl>CsCl。
①共价晶体
原子半径越小→键长越短→键能越大→熔、沸点越高。
如熔点:金刚石>硅晶体。
③分子晶体
a.分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常得高。如沸点:H2O>H2Te>H2Se>H2S。
b.组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。
如熔、沸点:SnH4>GeH4>SiH4>CH4。
c.组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高。如熔、沸点:CO>N2,CH3OH>CH3CH3。
④金属晶体
金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高。
如熔、沸点:Na<Mg<Al。
(1)离子晶体中一定存在离子键,可能存在共价键,一定不存在分子间作用力。
注意:
(2)只有分子晶体中存在单个分子。
(3)某些离子晶体的熔点高于某些共价晶体的熔点。如MgO(2 852 ℃)>SiO2(1 710 ℃)。
(4)某些分子晶体的熔点高于某些金属晶体的熔点。如碱金属熔点较低。
(5)个别金属的熔点高于某些共价晶体的熔点。如钨(3 410 ℃)>SiO2(1 710 ℃)。
(6)合金的熔点一般低于成分金属的熔点。
练3、下表给出几种化合物的熔点和沸点:
物质 NaCl MgCl2 AlCl3 CCl4
熔点/℃ 801 714 190 -22.9
沸点/℃ 1 465 1 412 178 76.8
关于表中4种化合物有下列说法,其中正确的是( )
①AlCl3在加热时可升华
②CCl4属于分子晶体
③1 500 ℃时NaCl可形成气体分子
④AlCl3是典型的离子晶体
A.①②④ B.③④ C.①②③ D.①②③④
C
