2022-2023学年高二化学人教版(2019)选择性必修21.1 原子结构与性质 课件(32张PPT)
文档属性
| 名称 | 2022-2023学年高二化学人教版(2019)选择性必修21.1 原子结构与性质 课件(32张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-09 18:18:56 | ||
图片预览







文档简介
(共32张PPT)
第一节
原子结构
新人教版选择性必修二
第一章 原子结构与性质
原子结构
第1课时
请以钠原子为例,谈谈你对原子结构的认识。
钠的原子结构示意图
问题1 研究核外电子排布的实验依据是什么?
研究原子结构的方法——原子光谱
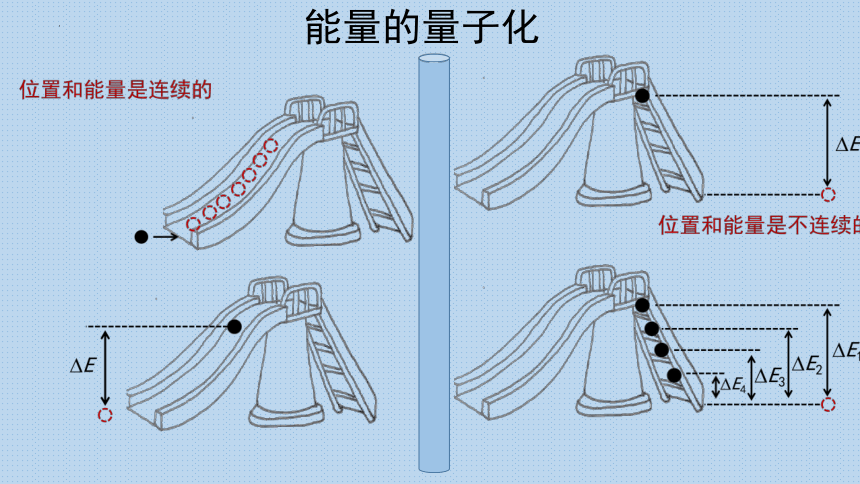
能量的量子化
激发态
K
L
M
N
能量
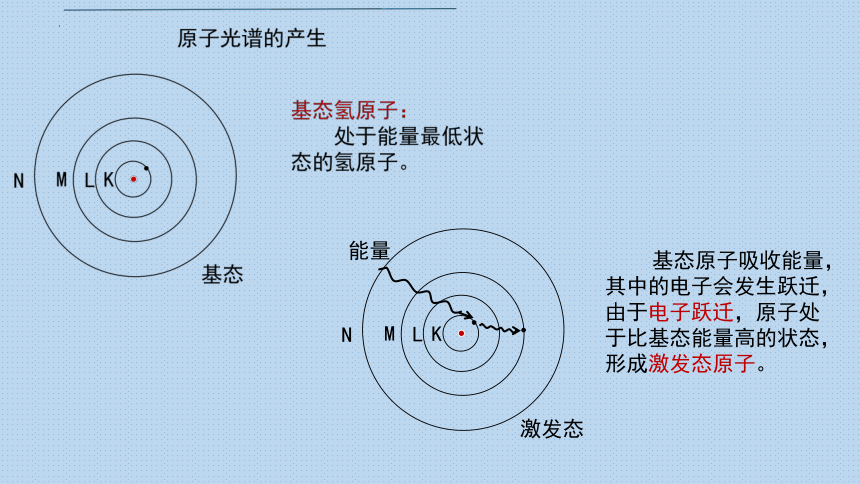
基态原子吸收能量,其中的电子会发生跃迁,由于电子跃迁,原子处于比基态能量高的状态,形成激发态原子。
研究原子结构的方法——原子光谱
原子光谱的产生
不同原子的电子发生跃迁时可以吸收不同的光,用光谱仪可以摄取各种原子吸收光谱。
锂、氦、汞的吸收光谱
光
K
L
M
N
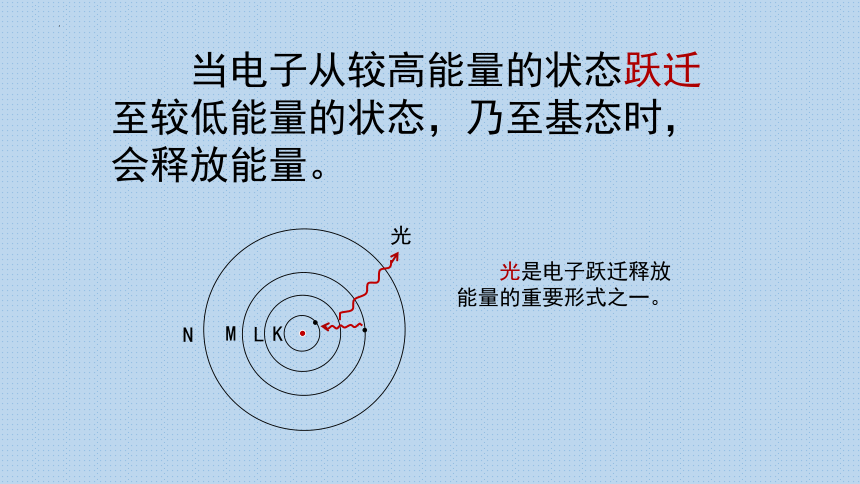
光是电子跃迁释放能量的重要形式之一。
当电子从较高能量的状态跃迁至较低能量的状态,乃至基态时,会释放能量。
各种原子的吸收光谱或发射光谱,总称为原子光谱。
锂、氦、汞的吸收光谱
锂、氦、汞的发射光谱
原子光谱的产生
不同原子的电子发生跃迁时可以发射不同的光,用光谱仪可以摄取各种原子的发射光谱。
锂、氦、汞的发射光谱
原子光谱的应用
He 氦
焰色试验 焰火
发现新元素
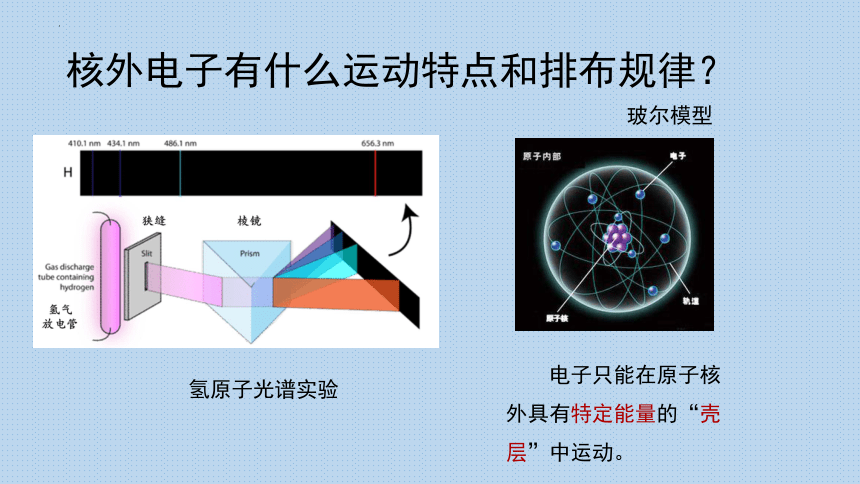
核外电子有什么运动特点和排布规律?
电子只能在原子核外具有特定能量的“壳层”中运动。
玻尔模型
氢原子光谱实验
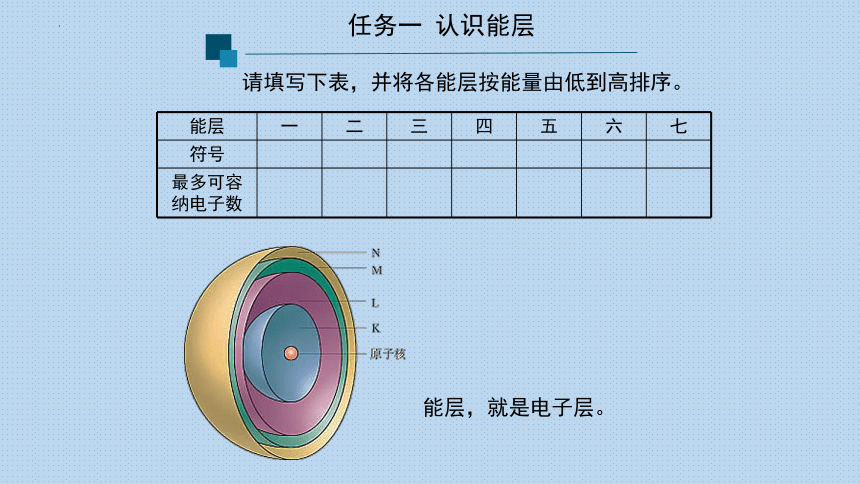
任务一 认识能层
请填写下表,并将各能层按能量由低到高排序。
能层 一 二 三 四 五 六 七
符号
最多可容纳电子数
能层,就是电子层。
任务一 认识能层
能层 一 二 三 四 五 六 七
符号 K L M N O P Q
最多可容纳电子数 2 8 18 32 50 72 98
将能量按从低到高排序为:
E(K)< E(L)< E(M)< E(N)< E(O)< E(P)< E(Q)
即离原子核越近,能量越低。
一般来讲,核外电子总是尽量先排布在能量较低的能层,然后依次排布在能量逐渐升高的能层。
原子核外各能层最多容纳2n2个电子。
最外层最多容纳8个电子(K层为最外层最多只能容纳2个电子。)
原子核外电子在能层中排布的表示方法
原子结构示意图
实验
核外电子的
运动状态
核外电子的
排布规律
表示方法
钠原子光谱
分析钠原子光谱时发现:
即便是相同的两个能层之间发生电子跃迁,也会出现多条谱线。
对于这个现象,你会提出何种假设?
原子结构理论的发展 II
能级
多电子原子中,同一能层的电子,能量也可能不同。 还可以把一个能层分为不同能级。
科学家据此进一步完善玻尔模型。
将所谓的“壳层”由“能层” 落实为“能层”中的“能级”。
原子结构理论的发展 II 能级
1.任一能层的能级总是从s开始。
2.任一能层的能级数等于能层序数。
3.能级符号按照s、p、d、f、g……排序。
4.能级符号前面用数字表示能层序数。
例如,K层中只有1s能级,L层中有2s和2p能级
能级的能量特点如下:
单电子原子中:E(ns) = E(np) = E(nd) = E(nf)
多电子原子中:E(ns) < E(np) < E(nd) < E(nf)
请填写下表,归纳各能级最多可容纳的电子数有何规律。
能层 K L M N 最多电子数 2 8 18 32 能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
最多电子数 2 2 6 2 6 10 2 6 10 14
s、p、d、f能级可容纳的最多电子数分别为2、6、10、14,依次为奇数数列1、3、5、7的二倍。
任务二 认识能级
第五能层最多可以容纳多少电子?分别容纳在哪些能级中?各能级最多容纳多少个电子?
第五能层最多可以容纳的电子数: 2×52 = 50
分别容纳在5s、5p、5d、5f、5g五个能级中。
思考——各能级最多容纳的电子数
各能级最多容纳的电子数为:
5s能级 2×1=2
5p能级 2×3=6
5d能级 2×5=10
5f能级 2×7=14
5g能级 2×9=18
总计50个电子,与前面能层的计算结果相同。
总结
(1)原子光谱实验为原子模型的建构提供证据。
(2)核外电子运动能量具有量子化的特点。
(3)核外电子在不同能级的跃迁会产生原子光谱。
核外电子在能级中依据什么规律排布?
核外电子在能级中的排布又可以如何表示?
下节预告
原子结构
第2课时
任务一
请画出1~18号元素的原子结构示意图。结合已有的能级知识,分析核外电子在能级中的排布规律。
结合H、He的原子结构示意图可知,电子首先填入能量最低的1s能级,直至将该能级填满。
对于Li和Be,当1s能级填满之后,电子优先填入能量较低的2s能级,直至填满。
对于B至Ne元素,在1s、2s能级填满后,电子填入2p能级,直至2p能级填满。
对于Na至Ar元素,电子首先填入3s能级。填满后,继续填入3p能级,直至3p能级填满。
讨论
核外电子在能级中的排布顺序:
能层 K L M N 最多电子数 2 8 18 32 能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
填充电子数 2 2 6 2 6
1s → 2s → 2p → 3s → 3p
任务二
能层 K L M N 最多电子数 2 8 18 32 能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
填充电子数 2 2 6 2 6 2
当4s能级填满后,下一个电子应该填充在哪个能级?
1s → 2s → 2p → 3s → 3p → 4s → 3d
电子在能级中的排布规律
随核电荷数增大,电子并不总是填满一个能层后再填入下一个能层,这种现象称为能级交错。
能级交错
3p → 4s → 3d
核外电子在能级中的排布顺序:
K、Ca的光谱学实验均表明,二者最外层填充的电子均在4s能级。
能级交错
这种能级交错在核外电子排布中非常普遍:
ns → (n-2)f → (n-1)d → np
构造原理示意图
以光谱学事实为基础,从1s能级开始,随核电荷数递增,新增的电子填入能级的顺序称为构造原理。
作为一个理论模型,构造原理具有一定的局限性。对于个别特殊的过渡元素核外电子的排布并不适用。
电子在能级中的排布规律——构造原理的补充说明
能级排布顺序 1s 2s 2p 3s 3p 4s 3d 4p
填充电子数 2 2 6 2 6 1 5
能级排布顺序 1s 2s 2p 3s 3p 4s 3d 4p
填充电子数 2 2 6 2 6 1 10
24Cr的核外电子在能级中的排布:
29Cu的核外电子在能级中的排布:
例如, H的电子排布式:1s1
Li的电子排布式:1s22s1
从左到右,能级按照离原子核由近到远依次排列。
在能级符号右上角用数字表示该能级填充的电子数。
常用电子排布式表示原子的核外电子在能级中的排布。
请根据构造原理,写出1~36号元素原子的电子排布式
练一练
请根据构造原理,写出1~36号元素原子的电子排布式
练一练
请根据构造原理,写出1~36号元素原子的电子排布式
练一练
请根据构造原理,写出1~36号元素原子的电子排布式
练一练
电子排布式可以简化,如Na的电子排布式可以写成[Ne]3s1。
想一想
[Ne]表示的是Ne的核外电子排布,也称为原子实。
Na 1s22s22p63s1
Na [Ne]3s1
这种原子的核外电子排布的表示方法叫做简化电子排布式。
原子实表示的电子称为内层电子,通常不参与成键。
原子实外的电子称为价层电子,决定元素的化学性质。
请你分析[Ne]表达的含义,并仿照该式写出8O、14Si和22Ti的简化电子排布式。分析该表示方法的优点。
8O [He]2s22p4
14Si [Ne]3s23p2
22Ti [Ar]3d24s2
谢谢观看!
第一节
原子结构
新人教版选择性必修二
第一章 原子结构与性质
原子结构
第1课时
请以钠原子为例,谈谈你对原子结构的认识。
钠的原子结构示意图
问题1 研究核外电子排布的实验依据是什么?
研究原子结构的方法——原子光谱
能量的量子化
激发态
K
L
M
N
能量
基态原子吸收能量,其中的电子会发生跃迁,由于电子跃迁,原子处于比基态能量高的状态,形成激发态原子。
研究原子结构的方法——原子光谱
原子光谱的产生
不同原子的电子发生跃迁时可以吸收不同的光,用光谱仪可以摄取各种原子吸收光谱。
锂、氦、汞的吸收光谱
光
K
L
M
N
光是电子跃迁释放能量的重要形式之一。
当电子从较高能量的状态跃迁至较低能量的状态,乃至基态时,会释放能量。
各种原子的吸收光谱或发射光谱,总称为原子光谱。
锂、氦、汞的吸收光谱
锂、氦、汞的发射光谱
原子光谱的产生
不同原子的电子发生跃迁时可以发射不同的光,用光谱仪可以摄取各种原子的发射光谱。
锂、氦、汞的发射光谱
原子光谱的应用
He 氦
焰色试验 焰火
发现新元素
核外电子有什么运动特点和排布规律?
电子只能在原子核外具有特定能量的“壳层”中运动。
玻尔模型
氢原子光谱实验
任务一 认识能层
请填写下表,并将各能层按能量由低到高排序。
能层 一 二 三 四 五 六 七
符号
最多可容纳电子数
能层,就是电子层。
任务一 认识能层
能层 一 二 三 四 五 六 七
符号 K L M N O P Q
最多可容纳电子数 2 8 18 32 50 72 98
将能量按从低到高排序为:
E(K)< E(L)< E(M)< E(N)< E(O)< E(P)< E(Q)
即离原子核越近,能量越低。
一般来讲,核外电子总是尽量先排布在能量较低的能层,然后依次排布在能量逐渐升高的能层。
原子核外各能层最多容纳2n2个电子。
最外层最多容纳8个电子(K层为最外层最多只能容纳2个电子。)
原子核外电子在能层中排布的表示方法
原子结构示意图
实验
核外电子的
运动状态
核外电子的
排布规律
表示方法
钠原子光谱
分析钠原子光谱时发现:
即便是相同的两个能层之间发生电子跃迁,也会出现多条谱线。
对于这个现象,你会提出何种假设?
原子结构理论的发展 II
能级
多电子原子中,同一能层的电子,能量也可能不同。 还可以把一个能层分为不同能级。
科学家据此进一步完善玻尔模型。
将所谓的“壳层”由“能层” 落实为“能层”中的“能级”。
原子结构理论的发展 II 能级
1.任一能层的能级总是从s开始。
2.任一能层的能级数等于能层序数。
3.能级符号按照s、p、d、f、g……排序。
4.能级符号前面用数字表示能层序数。
例如,K层中只有1s能级,L层中有2s和2p能级
能级的能量特点如下:
单电子原子中:E(ns) = E(np) = E(nd) = E(nf)
多电子原子中:E(ns) < E(np) < E(nd) < E(nf)
请填写下表,归纳各能级最多可容纳的电子数有何规律。
能层 K L M N 最多电子数 2 8 18 32 能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
最多电子数 2 2 6 2 6 10 2 6 10 14
s、p、d、f能级可容纳的最多电子数分别为2、6、10、14,依次为奇数数列1、3、5、7的二倍。
任务二 认识能级
第五能层最多可以容纳多少电子?分别容纳在哪些能级中?各能级最多容纳多少个电子?
第五能层最多可以容纳的电子数: 2×52 = 50
分别容纳在5s、5p、5d、5f、5g五个能级中。
思考——各能级最多容纳的电子数
各能级最多容纳的电子数为:
5s能级 2×1=2
5p能级 2×3=6
5d能级 2×5=10
5f能级 2×7=14
5g能级 2×9=18
总计50个电子,与前面能层的计算结果相同。
总结
(1)原子光谱实验为原子模型的建构提供证据。
(2)核外电子运动能量具有量子化的特点。
(3)核外电子在不同能级的跃迁会产生原子光谱。
核外电子在能级中依据什么规律排布?
核外电子在能级中的排布又可以如何表示?
下节预告
原子结构
第2课时
任务一
请画出1~18号元素的原子结构示意图。结合已有的能级知识,分析核外电子在能级中的排布规律。
结合H、He的原子结构示意图可知,电子首先填入能量最低的1s能级,直至将该能级填满。
对于Li和Be,当1s能级填满之后,电子优先填入能量较低的2s能级,直至填满。
对于B至Ne元素,在1s、2s能级填满后,电子填入2p能级,直至2p能级填满。
对于Na至Ar元素,电子首先填入3s能级。填满后,继续填入3p能级,直至3p能级填满。
讨论
核外电子在能级中的排布顺序:
能层 K L M N 最多电子数 2 8 18 32 能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
填充电子数 2 2 6 2 6
1s → 2s → 2p → 3s → 3p
任务二
能层 K L M N 最多电子数 2 8 18 32 能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
填充电子数 2 2 6 2 6 2
当4s能级填满后,下一个电子应该填充在哪个能级?
1s → 2s → 2p → 3s → 3p → 4s → 3d
电子在能级中的排布规律
随核电荷数增大,电子并不总是填满一个能层后再填入下一个能层,这种现象称为能级交错。
能级交错
3p → 4s → 3d
核外电子在能级中的排布顺序:
K、Ca的光谱学实验均表明,二者最外层填充的电子均在4s能级。
能级交错
这种能级交错在核外电子排布中非常普遍:
ns → (n-2)f → (n-1)d → np
构造原理示意图
以光谱学事实为基础,从1s能级开始,随核电荷数递增,新增的电子填入能级的顺序称为构造原理。
作为一个理论模型,构造原理具有一定的局限性。对于个别特殊的过渡元素核外电子的排布并不适用。
电子在能级中的排布规律——构造原理的补充说明
能级排布顺序 1s 2s 2p 3s 3p 4s 3d 4p
填充电子数 2 2 6 2 6 1 5
能级排布顺序 1s 2s 2p 3s 3p 4s 3d 4p
填充电子数 2 2 6 2 6 1 10
24Cr的核外电子在能级中的排布:
29Cu的核外电子在能级中的排布:
例如, H的电子排布式:1s1
Li的电子排布式:1s22s1
从左到右,能级按照离原子核由近到远依次排列。
在能级符号右上角用数字表示该能级填充的电子数。
常用电子排布式表示原子的核外电子在能级中的排布。
请根据构造原理,写出1~36号元素原子的电子排布式
练一练
请根据构造原理,写出1~36号元素原子的电子排布式
练一练
请根据构造原理,写出1~36号元素原子的电子排布式
练一练
请根据构造原理,写出1~36号元素原子的电子排布式
练一练
电子排布式可以简化,如Na的电子排布式可以写成[Ne]3s1。
想一想
[Ne]表示的是Ne的核外电子排布,也称为原子实。
Na 1s22s22p63s1
Na [Ne]3s1
这种原子的核外电子排布的表示方法叫做简化电子排布式。
原子实表示的电子称为内层电子,通常不参与成键。
原子实外的电子称为价层电子,决定元素的化学性质。
请你分析[Ne]表达的含义,并仿照该式写出8O、14Si和22Ti的简化电子排布式。分析该表示方法的优点。
8O [He]2s22p4
14Si [Ne]3s23p2
22Ti [Ar]3d24s2
谢谢观看!
