人教版(2019)高中物理选择性必修三 4.4氢原子光谱和波尔的原子模型(共15张PPT)
文档属性
| 名称 | 人教版(2019)高中物理选择性必修三 4.4氢原子光谱和波尔的原子模型(共15张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 867.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 物理 | ||
| 更新时间 | 2023-01-08 22:19:33 | ||
图片预览






文档简介
(共15张PPT)
第四章 原子结构和波粒二象性
第4节 氢原子光谱和波尔的原子模型
核心素养目标
1.了解光谱、连续谱和线状谱等概念。知道氢原子光谱的实验规律
2.知道经典理论的困难在于无法解释原子的稳定性和光谱的分立特征
3.了解波尔原子理论的基本假设的主要内容。能用波尔原子理论解释氢原子能级图及光谱
问题引入
把食盐放在火中灼烧,会发出黄色的光。食盐为什么发黄光而不发生其他颜色的光呢?
一、光谱
1.什么叫光谱?
用棱镜或光栅把物质发出的光按波长(频率)展开,
获得波长(频率)和强度分布的记录.既光谱。
2.光谱有怎么的分类?
(1)线状谱:光谱是一条条的亮线.
(2)连续谱:光谱是连在一起的光带.
3.什么是特征谱线?
气体中中性原子的发光光谱都是线状谱,说明原子只发出几种特定频率的光,不同原子的亮线位置不同,说明不同原子的发光频率不一样,光谱中的亮线称为原子的特征谱线.
几种常见的光谱
二、氢原子光谱的实验规律
氢原子的光谱的结果显示氢原子只能发出一系列特定的波长的光。
1885年,瑞士科学及巴尔末对当时已知的氢原子在可见光区的四条谱线
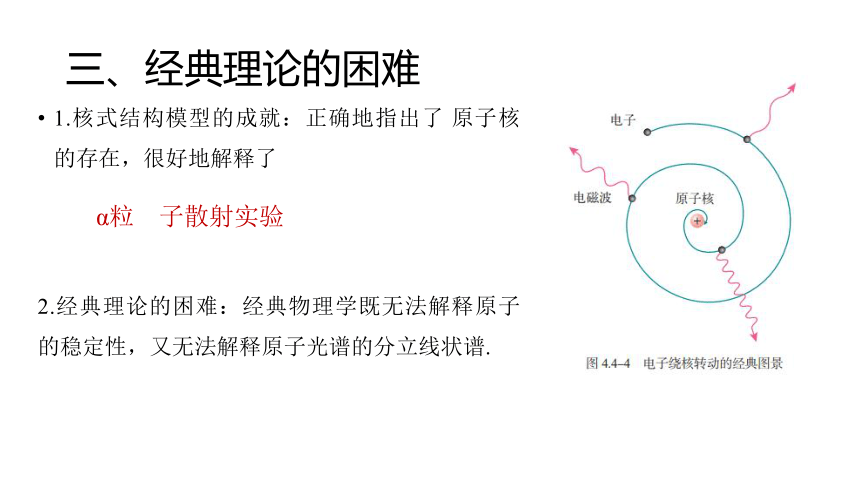
三、经典理论的困难
1.核式结构模型的成就:正确地指出了 原子核 的存在,很好地解释了
2.经典理论的困难:经典物理学既无法解释原子的稳定性,又无法解释原子光谱的分立线状谱.
α粒
子散射实验
四、波尔原子理论的基本假设
1.轨道量子化与定态
(1)原子中的电子在库仑引力的作用下,绕原子核做圆周运动.
(2)电子运行轨道的半径不是任意的,也就是说电子的轨道是量子化的
(3)电子在这些轨道上绕核的运动是稳定的,不产生电磁辐射.
2.定态
(1)当电子在不同的轨道上运动时,原子处于不同的状态,具有不同的能量.电子只能在特定轨道上运动,原子的能量只能取一系列特定的值.这些量子化的能量值叫作能级.
(2)原子中这些具有确定能量的稳定状态,称为定态.能量最低的状态称为基态,其他的状态叫作激发态.
2.频率条件
当电子从能量较高的定态轨道(其能量记为En)跃迁到能量较低的定态轨道(能量记为Em,m<n)时,会放出能量为hν的光子,该光子的能量hν=En-Em,该式称为频率条件,又称辐射条件.
五、波尔理论对
氢光谱的解释
1.轨道量子化
(1)轨道半径只能够是一些不连续的、某些分立的数值.
(2)氢原子的电子轨道最小半径为r1=0.053 nm,其余轨道半径满足rn=n2r1,式中n称为量子数,对应不同的轨道,只能取正整数.
2.能量量子化
(1)不同轨道对应不同的状态,在这些状态中,尽管电子做变速运动,却不辐射能量,因此这些状态是稳定的,原子在不同状态有不同的能量,所以原子的能量也是量子化的.
(2)基态:原子最低的能量状态称为基态,对应的电子在离核最近的轨道上运动,氢原子基态能量E1=-13.6 eV.
(3)激发态:除基态之外的其他能量状态称为激发态,对应的电子在离核较远的轨道上运动.
氢原子各能级的关系为:En=E1(E1=-13.6 eV,n=1,2,3,…)
3.跃迁
原子从一种定态跃迁到另一种定态时,它辐射或吸收一定频率的光子,光子的能量由这两种定态的能量差决定,即高能级Em低能级En.
五、波尔理论的局限性
电子云
量子力学
第四章 原子结构和波粒二象性
第4节 氢原子光谱和波尔的原子模型
核心素养目标
1.了解光谱、连续谱和线状谱等概念。知道氢原子光谱的实验规律
2.知道经典理论的困难在于无法解释原子的稳定性和光谱的分立特征
3.了解波尔原子理论的基本假设的主要内容。能用波尔原子理论解释氢原子能级图及光谱
问题引入
把食盐放在火中灼烧,会发出黄色的光。食盐为什么发黄光而不发生其他颜色的光呢?
一、光谱
1.什么叫光谱?
用棱镜或光栅把物质发出的光按波长(频率)展开,
获得波长(频率)和强度分布的记录.既光谱。
2.光谱有怎么的分类?
(1)线状谱:光谱是一条条的亮线.
(2)连续谱:光谱是连在一起的光带.
3.什么是特征谱线?
气体中中性原子的发光光谱都是线状谱,说明原子只发出几种特定频率的光,不同原子的亮线位置不同,说明不同原子的发光频率不一样,光谱中的亮线称为原子的特征谱线.
几种常见的光谱
二、氢原子光谱的实验规律
氢原子的光谱的结果显示氢原子只能发出一系列特定的波长的光。
1885年,瑞士科学及巴尔末对当时已知的氢原子在可见光区的四条谱线
三、经典理论的困难
1.核式结构模型的成就:正确地指出了 原子核 的存在,很好地解释了
2.经典理论的困难:经典物理学既无法解释原子的稳定性,又无法解释原子光谱的分立线状谱.
α粒
子散射实验
四、波尔原子理论的基本假设
1.轨道量子化与定态
(1)原子中的电子在库仑引力的作用下,绕原子核做圆周运动.
(2)电子运行轨道的半径不是任意的,也就是说电子的轨道是量子化的
(3)电子在这些轨道上绕核的运动是稳定的,不产生电磁辐射.
2.定态
(1)当电子在不同的轨道上运动时,原子处于不同的状态,具有不同的能量.电子只能在特定轨道上运动,原子的能量只能取一系列特定的值.这些量子化的能量值叫作能级.
(2)原子中这些具有确定能量的稳定状态,称为定态.能量最低的状态称为基态,其他的状态叫作激发态.
2.频率条件
当电子从能量较高的定态轨道(其能量记为En)跃迁到能量较低的定态轨道(能量记为Em,m<n)时,会放出能量为hν的光子,该光子的能量hν=En-Em,该式称为频率条件,又称辐射条件.
五、波尔理论对
氢光谱的解释
1.轨道量子化
(1)轨道半径只能够是一些不连续的、某些分立的数值.
(2)氢原子的电子轨道最小半径为r1=0.053 nm,其余轨道半径满足rn=n2r1,式中n称为量子数,对应不同的轨道,只能取正整数.
2.能量量子化
(1)不同轨道对应不同的状态,在这些状态中,尽管电子做变速运动,却不辐射能量,因此这些状态是稳定的,原子在不同状态有不同的能量,所以原子的能量也是量子化的.
(2)基态:原子最低的能量状态称为基态,对应的电子在离核最近的轨道上运动,氢原子基态能量E1=-13.6 eV.
(3)激发态:除基态之外的其他能量状态称为激发态,对应的电子在离核较远的轨道上运动.
氢原子各能级的关系为:En=E1(E1=-13.6 eV,n=1,2,3,…)
3.跃迁
原子从一种定态跃迁到另一种定态时,它辐射或吸收一定频率的光子,光子的能量由这两种定态的能量差决定,即高能级Em低能级En.
五、波尔理论的局限性
电子云
量子力学
同课章节目录
- 第一章 分子动理论
- 1 分子动理论的基本内容
- 2 实验:用油膜法估测油酸分子的大小
- 3 分子运动速率分布规律
- 4 分子动能和分子势能
- 第二章 气体、固体和液体
- 1 温度和温标
- 2 气体的等温变化
- 3 气体的等压变化和等容变化
- 4 固体
- 5 液体
- 第三章 热力学定律
- 1 功、热和内能的改变
- 2 热力学第一定律
- 3 能量守恒定律
- 4 热力学第二定律
- 第四章 原子结构和波粒二象性
- 1 普朗克黑体辐射理论
- 2 光电效应
- 3 原子的核式结构模型
- 4 氢原子光谱和玻尔的原子模型
- 5 粒子的波动性和量子力学的建立
- 第五章 原子核
- 1 原子核的组成
- 2 放射性元素的衰变
- 3 核力与结合能
- 4 核裂变与核聚变
- 5 “基本”粒子
