高一化学人教版(2019)必修第一册 第一章第一节 物质的分类及转化 第1课时(32张ppt)
文档属性
| 名称 | 高一化学人教版(2019)必修第一册 第一章第一节 物质的分类及转化 第1课时(32张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 32.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-12 11:05:45 | ||
图片预览






文档简介
(共30张PPT)
第一节 物质的分类及转化
2019新教材必修一第一章
第1课时 物质的分类
学习目标:
1、通过对生活实例的反思,提炼分类的意义和方法,并迁移至物质分类;准确认识树状分类法和交叉分类法
2、能准确辨识单质、化合物、酸、碱、盐、氧化物
3、能举例说明胶体的典型特征,并通过Fe(OH)3胶体的制备及性质讨论,从微观粒子尺度和宏观性质相结合的角度解释相关现象
重点难点:
1、准确辨识单质、化合物、酸、碱、盐、氧化物
2、能举例说明胶体的典型特征,并通过Fe(OH)3胶体的制备及性质讨论,从微观粒子尺度和宏观性质相结合的角度解释相关现象
超市
图书馆、超市、药房、书店、快递公司等地方都利用了分类的手段,可以提高日常生活、学习和工作的效率
引入
由同种元素组成的几种性质不同的单质;如金刚石、石墨、C60都是碳元素组成的单质,它们互为同素异形体;
又如氧气O2、臭氧O3互为同素异形体;类似还有白磷P4和红磷P。
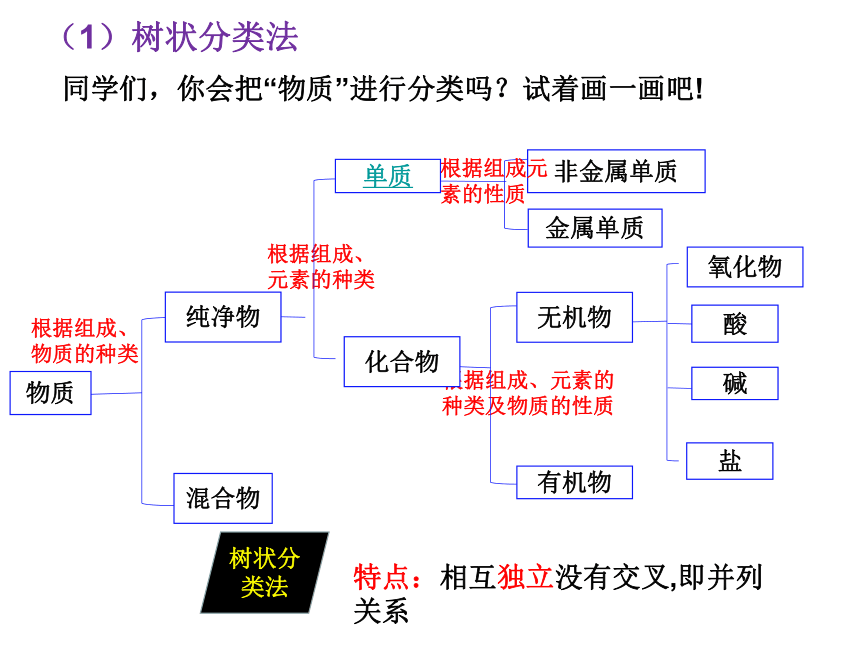
一、根据物质的组成和性质分类
元素
单质
化合物
任何物质都是由 组成的,根据元素组成对物质进行分类是化学研究的基础。
只有一种元素组成的物质叫 ;由两种或两种以上种类元素组成的物质是 。
同素异形体:
物质
氧化物
酸
碱
盐
根据组成、物质的种类
根据组成、元素的种类
非金属单质
金属单质
根据组成元素的性质
根据组成、元素的种类及物质的性质
纯净物
混合物
化合物
单质
有机物
无机物
特点:相互独立没有交叉,即并列关系
同学们,你会把“物质”进行分类吗?试着画一画吧!
树状分类法
(1)树状分类法
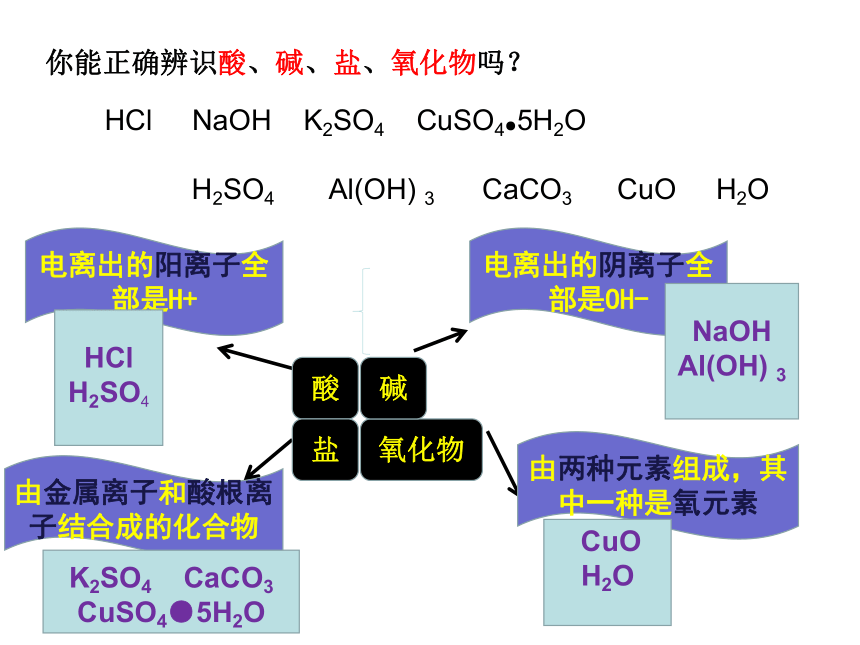
你能正确辨识酸、碱、盐、氧化物吗?
电离出的阳离子全部是H+
由两种元素组成,其中一种是氧元素
由金属离子和酸根离子结合成的化合物
电离出的阴离子全部是OH-
酸
盐
氧化物
碱
HCl NaOH K2SO4 CuSO4●5H2O
H2SO4 Al(OH) 3 CaCO3 CuO H2O
HCl
H2SO4
K2SO4 CaCO3 CuSO4●5H2O
CuO
H2O
NaOH
Al(OH) 3
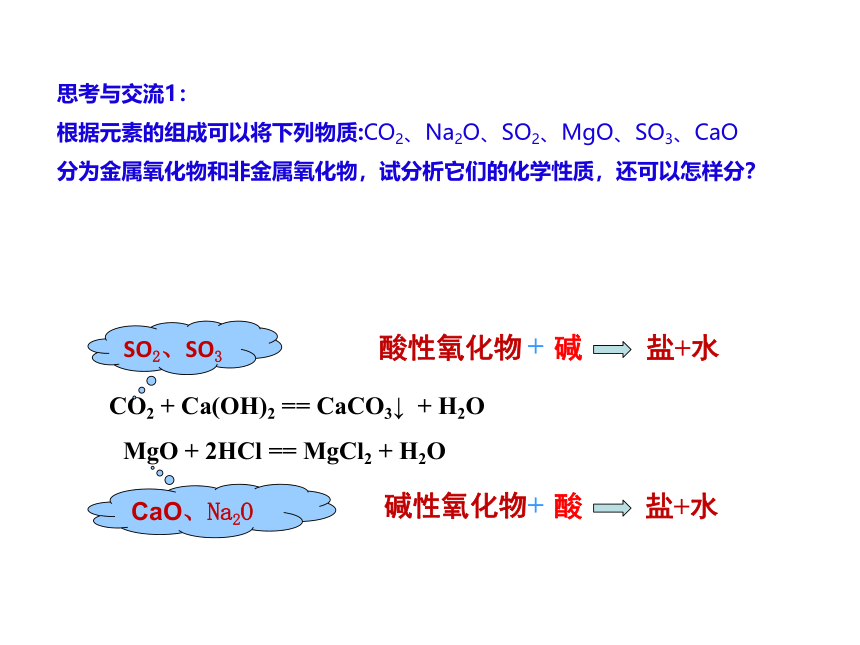
思考与交流1:
根据元素的组成可以将下列物质:CO2、Na2O、SO2、MgO、SO3、CaO
分为金属氧化物和非金属氧化物,试分析它们的化学性质,还可以怎样分?
CO2 + Ca(OH)2 == CaCO3↓ + H2O
MgO + 2HCl == MgCl2 + H2O
SO2、SO3
CaO、Na2O
碱性氧化物
+
酸
盐+水
酸性氧化物
+
碱
盐+水
概念辨析
1、金属氧化物一定是碱性氧化物?
2、非金属氧化物一定是酸性氧化物
2、酸性氧化物都能溶于水生成相应的酸?
Mn2O7是酸性氧化物
NO、CO
×
×
酸性氧化物: 与碱反应生成相应的盐和水的氧化物
碱性氧化物:与酸反应生成相应的盐和水的氧化物
知识拓展:NO、CO等氧化物既不能与酸反应又不能与碱反应生成相应的盐和水,属于不成盐氧化物
× 如SiO2是酸性氧化物,但不溶于水
HMnO4
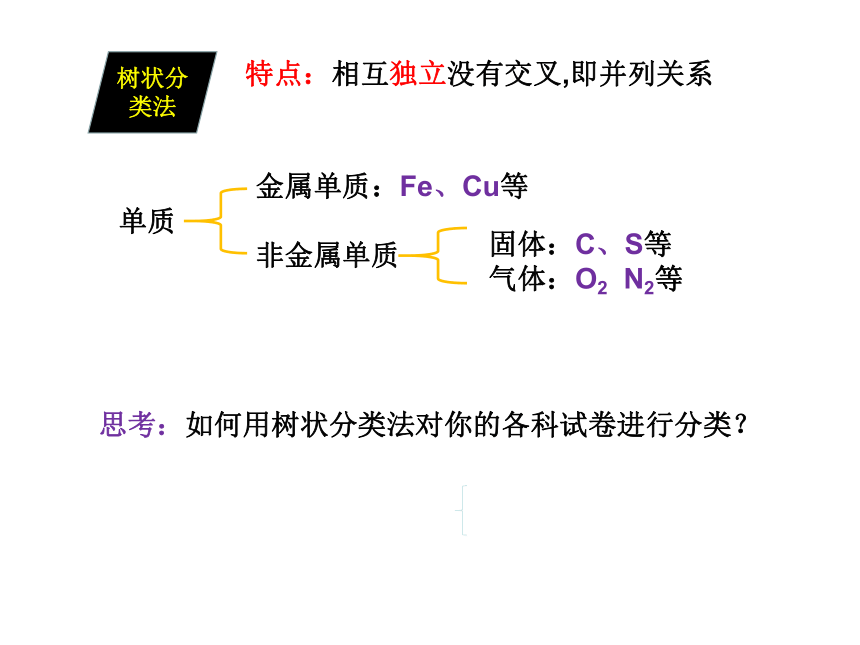
金属单质:Fe、Cu等
非金属单质
固体:C、S等
气体:O2 N2等
单质
树状分类法
特点:相互独立没有交叉,即并列关系
思考:如何用树状分类法对你的各科试卷进行分类?
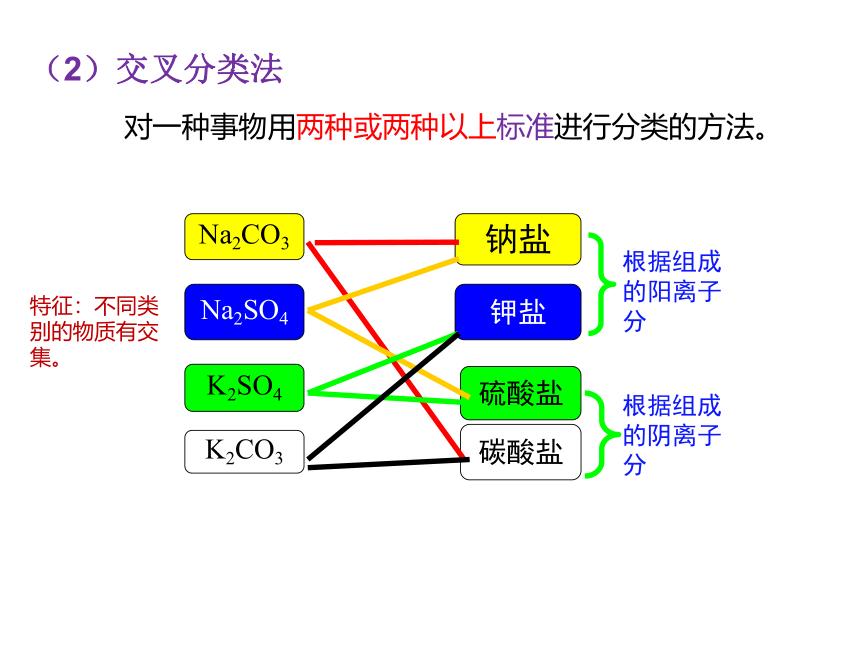
Na2SO4
K2SO4
K2CO3
碳酸盐
硫酸盐
钾盐
钠盐
Na2CO3
根据组成的阳离子分
根据组成的阴离子分
特征:不同类别的物质有交集。
(2)交叉分类法
对一种事物用两种或两种以上标准进行分类的方法。
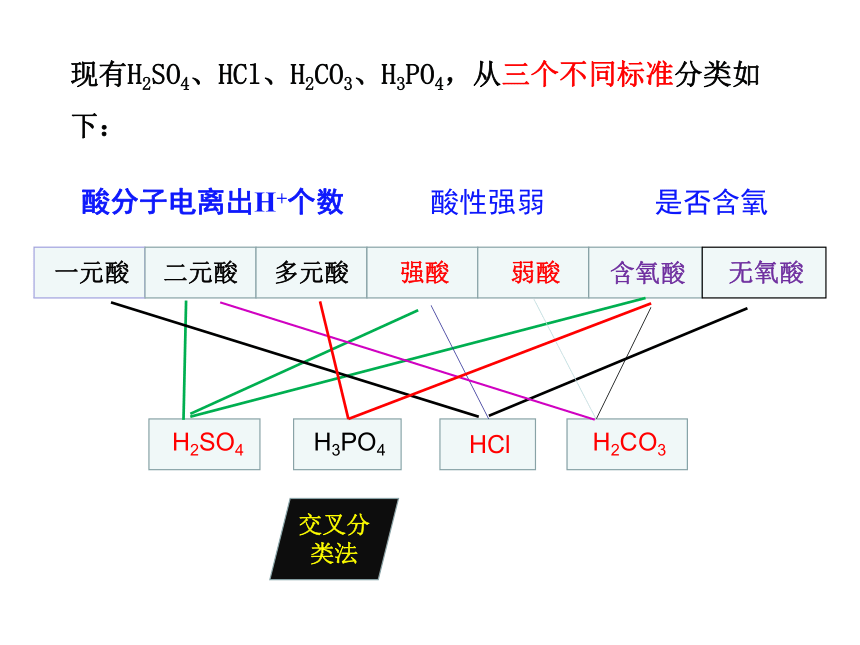
一元酸
二元酸
多元酸
强酸
弱酸
含氧酸
无氧酸
H2SO4
H2CO3
H3PO4
HCl
现有H2SO4、HCl、H2CO3、H3PO4,从三个不同标准分类如下:
是否含氧
酸性强弱
酸分子电离出H+个数
交叉分类法
1.下列每组中的两种物质之间的关系为同素异形体的一组是( )
A.CaO和CaS B. 和
C.C60和C70 D.HCNO和HOCN
C
随堂测1
同素异形体:同种元素形成的性质不同的单质
2.现有下列物质:①H2O ②空气 ③Mg ④CaO ⑤H2SO4 ⑥Ca(OH)2 ⑦CuSO4·5H2O ⑧碘酒 ⑨C2H5OH和⑩NaHCO3。其中属于混合物的是_____(填序号,下同);属于酸的是________;属于碱的是 属于盐的是________;属于有机物的是______;
⑥
②⑧
⑤
⑦⑩
⑨
二、分散系及其分类
CuSO4溶液 泥水 油水混合物
分散系
分散质
分散剂
把一种(或多种)物质分散在另一种 (或多种)物质中所得到的体系。
分散系中起容纳分散质作用的物质
分散系中被分散的物质
几种分散系的比较:
分散系 实例 分散质 分散剂 特征
悬浊液
乳浊液
溶液
水
水
水
土壤粒子
油
酒精分子
浑浊,静置沉淀
浑浊,静置分层
澄清 透明 均一 稳定
泥水
油水
酒精溶液
分散系及其分类
分散质
分散剂
气
固
液
固
液
气
按照分散质或分散剂的聚集状态(气、液、固)来分,有9种类型。
思考与交流2:以CuSO4溶液、泥水、振荡后的植物油与水为例,说说这三种分散系有什么相同点和不同点
相同点:
不同点:
分散剂相同
分散质粒子直径大小不同、稳定性不同
按分散质的粒子直径大小分
溶液
胶体
浊液
< 1 nm
1nm 至100nm
>100nm
稳定性:
不稳定
介稳性
稳定
1.定义:分散质粒子的直径为 1~100 nm的分散系是胶体。
2.胶体分类:
气溶胶
液溶胶
固溶胶
分散剂为气体(如:烟、云、雾)
分散剂为固体(如:有色玻璃、宝石)
分散剂为液体(如:牛奶、豆浆)
分类标准:分散剂的状态
胶 体
实验探究
P8 实验 Fe(OH)3胶体的制备:
逐滴加入到
饱和溶液 5-6滴
煮沸蒸馏水25mL
红褐色液体,透明
FeCl3 + 3H2O Fe(OH)3(胶体) + 3HCl
如何区分溶液和透明的胶体?
胶体的制备和性质
宏观辨识 实验探究
【学习任务三】胶体的制备和性质
丁达尔效应
当光束通过Fe(OH)3胶体时,可以看到一条光亮的“通路”,而光束通过CuSO4溶液时,则看不到此现象。这条光亮的“通路”是由于胶体粒子对光线散射(光波偏离原来方向而分散传播)形成的,叫做丁达尔效应。丁达尔效应可被用来区分胶体和溶液。
溶液 胶体 浊液
微粒直径
微粒组成
特点
能否通过滤纸
光照
能否通过半透膜
实例
<1n m
1~100n m
>100n m
分子或离子
分子的集合体或高分子
小液滴或固体小颗粒
均一、稳定、透明
不均一、不稳定、不透明
均一、介稳性、透明
能 能 不能
可通过无光路
可通过形成光路
透光性差
能 不能 不能
蔗糖水、食盐水
蛋白溶液、淀粉溶液
石灰乳、油水混合物
生活中的丁达尔效应
小结:
1.分类是一种科学的学习方法,科学分类的前提是有准确的分类标准
2.用树状分类法,按物质组成对物质进行分类;按物质性质对氧化物进行分类
3.分散系的概念与分类
4.胶体的概念与分类
5.氢氧化铁胶体的制备
6.丁达尔效应、电泳、聚沉
1.当光束通过下列物质时,不会出现丁达尔效应的是( )。
①Fe(OH)3胶体 ②水 ③蔗糖溶液 ④FeCl3溶液 ⑤云、雾
A. ②④⑤ B.③④⑤
C.②③④ D. ①③④
随堂测2:
C
2.Na2CO3俗名纯碱,下面是对纯碱采用不同分类法的分类。不正确的是( )
A.Na2CO3是碱 B.Na2CO3是盐
C.Na2CO3是钠盐 D.Na2CO3是纯净物
A
3.下列说法正确的有( ) ①“卤水点豆腐”“黄河入海口处三角洲的形成”都与胶体的聚沉有关②提纯Fe(OH)3胶体,可以采用的方法是过滤③明矾能作净水剂是因为铝离子与水作用生成的氢氧化铝胶体具有吸附悬浮杂质的作用④在制备Fe(OH)3胶体实验中,可以长时间加热⑤向Fe(OH)3胶体中加入过量稀硫酸,先有红褐色沉淀生成,然后沉淀溶解形成棕黄色溶液A.2个 B.3个 C.4个 D.5个
A
4.下列说法错误的是( )A.只含有一种元素的物质可能是纯净物也可能是混合物B.酸性氧化物均可跟碱起反应C.金属氧化物均是碱性氧化物
D.酸根中不一定含有氧元素
C
5.下列现象或者性质与胶体的性质无关的是( )
A.同一支钢笔使用不同品牌墨水时,容易发生堵塞现象B.江河入海口,容易形成沙洲
C.医学上治疗肾衰竭等疾病时,血液的净化手段利用血液透析
D.向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀
6.下列属于纯净物的是( )
A.盐酸 B.石油 C.纯碱 D.碱石灰
D
C
一、新冠病毒的传播
新型冠状病毒粒子直径约60-220nm,传播方式以飞沫传播和接触传播为主,也可能经气溶胶近距离传播。
飞沫、气溶胶等都属于分散系。胶体颗粒直径1nm-100nm, 胶体较稳定(介稳性),飞沫的颗粒直径>50um,在空气中悬浮时间较短。气溶胶可在空气中长时间悬浮达几个小时。
视野拓展
在工业生产中,存在污水中的胶体物质,常用投加明矾、硫酸铁等电解质的方法进行处理;有的胶体体系,如大气中的飘尘、工业废气中的固体悬浮物、矿山开采地的粉尘、纺织厂或食品加工厂弥漫于空气中的有机纤维或颗粒等都极为有害,均可利用静电除尘的装置加以清除。
课后活动:
请同学们查阅资料这是利用了胶体的什么性质?生活中还有哪些现象与胶体的性质有关?
谢谢聆听!
第一节 物质的分类及转化
2019新教材必修一第一章
第1课时 物质的分类
学习目标:
1、通过对生活实例的反思,提炼分类的意义和方法,并迁移至物质分类;准确认识树状分类法和交叉分类法
2、能准确辨识单质、化合物、酸、碱、盐、氧化物
3、能举例说明胶体的典型特征,并通过Fe(OH)3胶体的制备及性质讨论,从微观粒子尺度和宏观性质相结合的角度解释相关现象
重点难点:
1、准确辨识单质、化合物、酸、碱、盐、氧化物
2、能举例说明胶体的典型特征,并通过Fe(OH)3胶体的制备及性质讨论,从微观粒子尺度和宏观性质相结合的角度解释相关现象
超市
图书馆、超市、药房、书店、快递公司等地方都利用了分类的手段,可以提高日常生活、学习和工作的效率
引入
由同种元素组成的几种性质不同的单质;如金刚石、石墨、C60都是碳元素组成的单质,它们互为同素异形体;
又如氧气O2、臭氧O3互为同素异形体;类似还有白磷P4和红磷P。
一、根据物质的组成和性质分类
元素
单质
化合物
任何物质都是由 组成的,根据元素组成对物质进行分类是化学研究的基础。
只有一种元素组成的物质叫 ;由两种或两种以上种类元素组成的物质是 。
同素异形体:
物质
氧化物
酸
碱
盐
根据组成、物质的种类
根据组成、元素的种类
非金属单质
金属单质
根据组成元素的性质
根据组成、元素的种类及物质的性质
纯净物
混合物
化合物
单质
有机物
无机物
特点:相互独立没有交叉,即并列关系
同学们,你会把“物质”进行分类吗?试着画一画吧!
树状分类法
(1)树状分类法
你能正确辨识酸、碱、盐、氧化物吗?
电离出的阳离子全部是H+
由两种元素组成,其中一种是氧元素
由金属离子和酸根离子结合成的化合物
电离出的阴离子全部是OH-
酸
盐
氧化物
碱
HCl NaOH K2SO4 CuSO4●5H2O
H2SO4 Al(OH) 3 CaCO3 CuO H2O
HCl
H2SO4
K2SO4 CaCO3 CuSO4●5H2O
CuO
H2O
NaOH
Al(OH) 3
思考与交流1:
根据元素的组成可以将下列物质:CO2、Na2O、SO2、MgO、SO3、CaO
分为金属氧化物和非金属氧化物,试分析它们的化学性质,还可以怎样分?
CO2 + Ca(OH)2 == CaCO3↓ + H2O
MgO + 2HCl == MgCl2 + H2O
SO2、SO3
CaO、Na2O
碱性氧化物
+
酸
盐+水
酸性氧化物
+
碱
盐+水
概念辨析
1、金属氧化物一定是碱性氧化物?
2、非金属氧化物一定是酸性氧化物
2、酸性氧化物都能溶于水生成相应的酸?
Mn2O7是酸性氧化物
NO、CO
×
×
酸性氧化物: 与碱反应生成相应的盐和水的氧化物
碱性氧化物:与酸反应生成相应的盐和水的氧化物
知识拓展:NO、CO等氧化物既不能与酸反应又不能与碱反应生成相应的盐和水,属于不成盐氧化物
× 如SiO2是酸性氧化物,但不溶于水
HMnO4
金属单质:Fe、Cu等
非金属单质
固体:C、S等
气体:O2 N2等
单质
树状分类法
特点:相互独立没有交叉,即并列关系
思考:如何用树状分类法对你的各科试卷进行分类?
Na2SO4
K2SO4
K2CO3
碳酸盐
硫酸盐
钾盐
钠盐
Na2CO3
根据组成的阳离子分
根据组成的阴离子分
特征:不同类别的物质有交集。
(2)交叉分类法
对一种事物用两种或两种以上标准进行分类的方法。
一元酸
二元酸
多元酸
强酸
弱酸
含氧酸
无氧酸
H2SO4
H2CO3
H3PO4
HCl
现有H2SO4、HCl、H2CO3、H3PO4,从三个不同标准分类如下:
是否含氧
酸性强弱
酸分子电离出H+个数
交叉分类法
1.下列每组中的两种物质之间的关系为同素异形体的一组是( )
A.CaO和CaS B. 和
C.C60和C70 D.HCNO和HOCN
C
随堂测1
同素异形体:同种元素形成的性质不同的单质
2.现有下列物质:①H2O ②空气 ③Mg ④CaO ⑤H2SO4 ⑥Ca(OH)2 ⑦CuSO4·5H2O ⑧碘酒 ⑨C2H5OH和⑩NaHCO3。其中属于混合物的是_____(填序号,下同);属于酸的是________;属于碱的是 属于盐的是________;属于有机物的是______;
⑥
②⑧
⑤
⑦⑩
⑨
二、分散系及其分类
CuSO4溶液 泥水 油水混合物
分散系
分散质
分散剂
把一种(或多种)物质分散在另一种 (或多种)物质中所得到的体系。
分散系中起容纳分散质作用的物质
分散系中被分散的物质
几种分散系的比较:
分散系 实例 分散质 分散剂 特征
悬浊液
乳浊液
溶液
水
水
水
土壤粒子
油
酒精分子
浑浊,静置沉淀
浑浊,静置分层
澄清 透明 均一 稳定
泥水
油水
酒精溶液
分散系及其分类
分散质
分散剂
气
固
液
固
液
气
按照分散质或分散剂的聚集状态(气、液、固)来分,有9种类型。
思考与交流2:以CuSO4溶液、泥水、振荡后的植物油与水为例,说说这三种分散系有什么相同点和不同点
相同点:
不同点:
分散剂相同
分散质粒子直径大小不同、稳定性不同
按分散质的粒子直径大小分
溶液
胶体
浊液
< 1 nm
1nm 至100nm
>100nm
稳定性:
不稳定
介稳性
稳定
1.定义:分散质粒子的直径为 1~100 nm的分散系是胶体。
2.胶体分类:
气溶胶
液溶胶
固溶胶
分散剂为气体(如:烟、云、雾)
分散剂为固体(如:有色玻璃、宝石)
分散剂为液体(如:牛奶、豆浆)
分类标准:分散剂的状态
胶 体
实验探究
P8 实验 Fe(OH)3胶体的制备:
逐滴加入到
饱和溶液 5-6滴
煮沸蒸馏水25mL
红褐色液体,透明
FeCl3 + 3H2O Fe(OH)3(胶体) + 3HCl
如何区分溶液和透明的胶体?
胶体的制备和性质
宏观辨识 实验探究
【学习任务三】胶体的制备和性质
丁达尔效应
当光束通过Fe(OH)3胶体时,可以看到一条光亮的“通路”,而光束通过CuSO4溶液时,则看不到此现象。这条光亮的“通路”是由于胶体粒子对光线散射(光波偏离原来方向而分散传播)形成的,叫做丁达尔效应。丁达尔效应可被用来区分胶体和溶液。
溶液 胶体 浊液
微粒直径
微粒组成
特点
能否通过滤纸
光照
能否通过半透膜
实例
<1n m
1~100n m
>100n m
分子或离子
分子的集合体或高分子
小液滴或固体小颗粒
均一、稳定、透明
不均一、不稳定、不透明
均一、介稳性、透明
能 能 不能
可通过无光路
可通过形成光路
透光性差
能 不能 不能
蔗糖水、食盐水
蛋白溶液、淀粉溶液
石灰乳、油水混合物
生活中的丁达尔效应
小结:
1.分类是一种科学的学习方法,科学分类的前提是有准确的分类标准
2.用树状分类法,按物质组成对物质进行分类;按物质性质对氧化物进行分类
3.分散系的概念与分类
4.胶体的概念与分类
5.氢氧化铁胶体的制备
6.丁达尔效应、电泳、聚沉
1.当光束通过下列物质时,不会出现丁达尔效应的是( )。
①Fe(OH)3胶体 ②水 ③蔗糖溶液 ④FeCl3溶液 ⑤云、雾
A. ②④⑤ B.③④⑤
C.②③④ D. ①③④
随堂测2:
C
2.Na2CO3俗名纯碱,下面是对纯碱采用不同分类法的分类。不正确的是( )
A.Na2CO3是碱 B.Na2CO3是盐
C.Na2CO3是钠盐 D.Na2CO3是纯净物
A
3.下列说法正确的有( ) ①“卤水点豆腐”“黄河入海口处三角洲的形成”都与胶体的聚沉有关②提纯Fe(OH)3胶体,可以采用的方法是过滤③明矾能作净水剂是因为铝离子与水作用生成的氢氧化铝胶体具有吸附悬浮杂质的作用④在制备Fe(OH)3胶体实验中,可以长时间加热⑤向Fe(OH)3胶体中加入过量稀硫酸,先有红褐色沉淀生成,然后沉淀溶解形成棕黄色溶液A.2个 B.3个 C.4个 D.5个
A
4.下列说法错误的是( )A.只含有一种元素的物质可能是纯净物也可能是混合物B.酸性氧化物均可跟碱起反应C.金属氧化物均是碱性氧化物
D.酸根中不一定含有氧元素
C
5.下列现象或者性质与胶体的性质无关的是( )
A.同一支钢笔使用不同品牌墨水时,容易发生堵塞现象B.江河入海口,容易形成沙洲
C.医学上治疗肾衰竭等疾病时,血液的净化手段利用血液透析
D.向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀
6.下列属于纯净物的是( )
A.盐酸 B.石油 C.纯碱 D.碱石灰
D
C
一、新冠病毒的传播
新型冠状病毒粒子直径约60-220nm,传播方式以飞沫传播和接触传播为主,也可能经气溶胶近距离传播。
飞沫、气溶胶等都属于分散系。胶体颗粒直径1nm-100nm, 胶体较稳定(介稳性),飞沫的颗粒直径>50um,在空气中悬浮时间较短。气溶胶可在空气中长时间悬浮达几个小时。
视野拓展
在工业生产中,存在污水中的胶体物质,常用投加明矾、硫酸铁等电解质的方法进行处理;有的胶体体系,如大气中的飘尘、工业废气中的固体悬浮物、矿山开采地的粉尘、纺织厂或食品加工厂弥漫于空气中的有机纤维或颗粒等都极为有害,均可利用静电除尘的装置加以清除。
课后活动:
请同学们查阅资料这是利用了胶体的什么性质?生活中还有哪些现象与胶体的性质有关?
谢谢聆听!
