高一化学人教版(2019)必修第一册 第一章第二节 离子反应 第2课时(20张ppt)
文档属性
| 名称 | 高一化学人教版(2019)必修第一册 第一章第二节 离子反应 第2课时(20张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 209.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-12 11:10:41 | ||
图片预览







文档简介
(共20张PPT)
第二节 离子反应
2019新教材必修一第一章
第2课时 离子反应
学习目标:
1、通过实验,探究酸、碱、盐之间反应的事实,认识离子反应。
2、归纳离子反应发生的条件。
3、正确书写离子方程式。
难点:离子反应发生的条件、离子方程式的书写
重点:离子方程式的书写
实验导入
实验1-3:
向盛有2mL Na2SO4 稀溶液的试管中加入2mL BaCl2稀溶液 (两者恰好完全反应),观察现象并分析。
现象 分析
产生白色沉淀 Na2SO4与BaCl2的 电离方程式 混合前溶液 中的离子 混合后溶液
中的离子
Na2SO4=2Na+ + SO42-
BaCl2 = Ba2+ +2Cl-
Na+
SO42-
Ba2+
Cl-
Cl-
Na+
混合后Ba2+和SO42-结合成沉淀,它们的离子浓度减小。
实际参加反应的是:Ba2++SO42- =BaSO4 ↓
1.定义:电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应(即有离子参加或生成的反应)
离子反应
2. 实质:离子浓度的减少
3.表示方法:离子方程式(即用实际参加反应的离子符号来表示反应的式子)
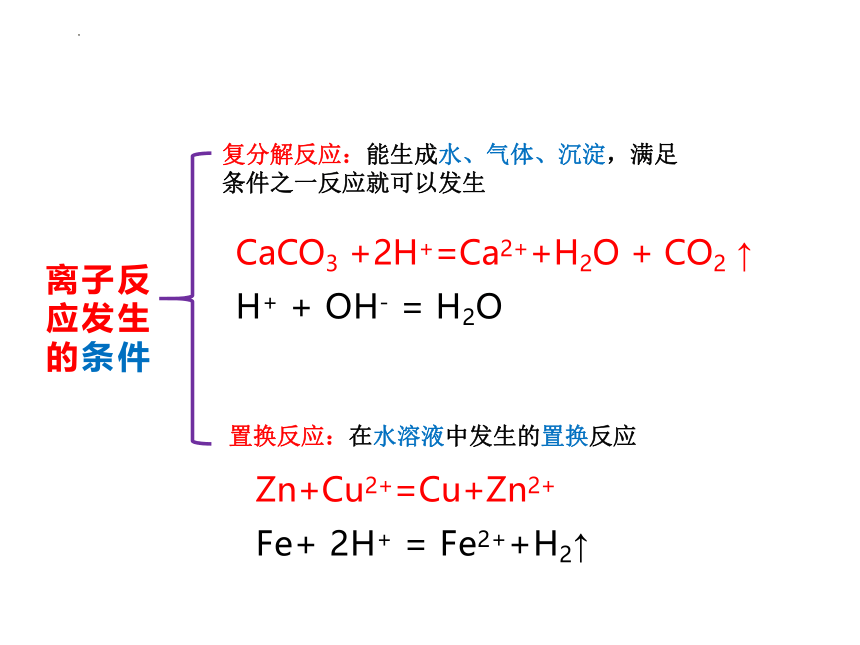
离子反应发生的条件
复分解反应:能生成水、气体、沉淀,满足条件之一反应就可以发生
置换反应:在水溶液中发生的置换反应
CaCO3 +2H+=Ca2++H2O + CO2 ↑
H+ + OH- = H2O
Zn+Cu2+=Cu+Zn2+
Fe+ 2H+ = Fe2++H2↑
离子方程式的书写步骤
用实际参加反应的离子符号表示离子反应的式子。
写
拆
删
查
Na2SO4 + BaCl2 =2NaCl+ BaSO4↓
1. 写出反应的化学方程式(以Na2SO4 溶液和BaCl2溶液反应为例)
2. 把易溶于水且易电离的物质写成离子形式
2Na+ +SO42- + Ba2+ + 2Cl- = 2Na+ + 2Cl- +BaSO4↓
3. 删去方程式两边不参加反应的离子,并将方程化为最简
4.检查方程式两边各元素的原子个数和电荷总数是否相等
(强酸、强碱、大部分可溶性盐)
Ba2++SO42- =BaSO4 ↓
注意:不能拆的物质有沉淀、气体、水、弱酸、弱碱、单质、氧化物
离子方程式书写的最关键步骤是“拆”与“不拆”的理解判断。
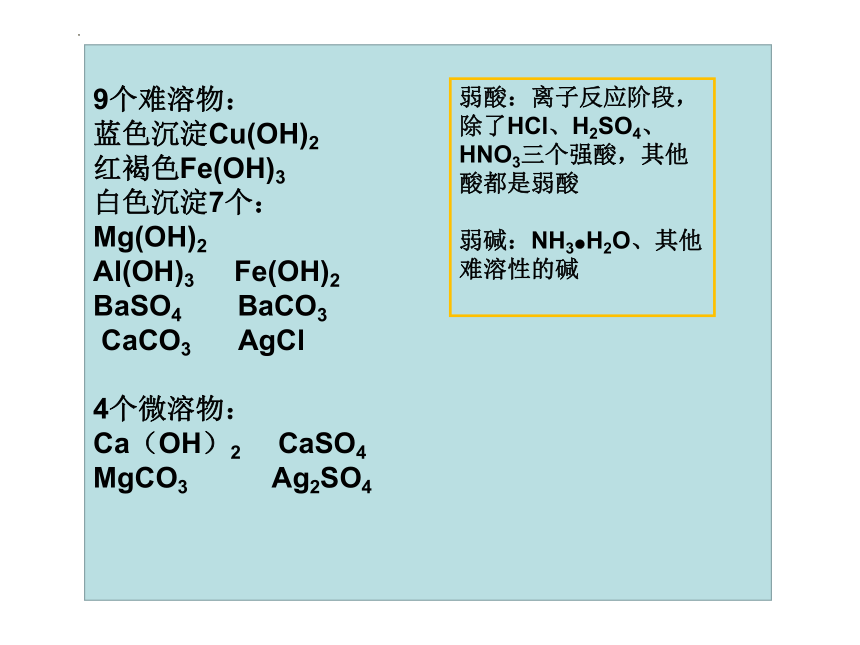
9个难溶物:
蓝色沉淀Cu(OH)2
红褐色Fe(OH)3
白色沉淀7个:
Mg(OH)2
Al(OH)3 Fe(OH)2
BaSO4 BaCO3
CaCO3 AgCl
4个微溶物:
Ca(OH)2 CaSO4
MgCO3 Ag2SO4
弱酸:离子反应阶段,除了HCl、H2SO4、HNO3三个强酸,其他酸都是弱酸
弱碱:NH3●H2O、其他难溶性的碱
思考与讨论
完成下列表格,思考两种方程式表达的含义有什么不同?
反应物 化学方程式 离子方程式 两种化学方程式的不同
HCl+NaOH
HCl+KOH
H2SO4+NaOH
H2SO4+KOH
HCl+KOH=KCl+H2O
HCl+NaOH=NaCl+H2O
H2SO4+2NaOH=Na2SO4+2H2O
H2SO4+2KOH=K2SO4+2H2O
化学方程式表示一个具体的反应,离子方程式表示一类反应
离子方程式的意义:化学方程式仅表示一个反应,离子方程式不仅可以表示某个具体的化学反应,而且可表示同一类型的反应。
H++OH—=H2O
H++OH—=H2O
H++OH—=H2O
H++OH—=H2O
离子方程式的正误判断方法
1、看反应是否符合客观事实
2、看是否符合拆写原则
铁和稀盐酸反应:2Fe + 6H+ = 2Fe3+ + 3H2↑
氧化铁和稀盐酸反应: O2- +2H+=H2O
Fe + 2H+ = Fe2+ + H2↑
Fe2 O3+ 6H+ = 2Fe3+ + 3H2O↑
×
×
5、 看是否符合阴、阳离子的个数配比
4、 看是否漏掉离子反应
稀硫酸和氢氧化钡溶液反应:H++SO42-+OH-+Ba2+=BaSO4↓+H2O
3、看是否遵守质量守恒和电荷守恒定律
铝和硝酸铜溶液反应:Al + Cu2+ = Al3+ + Cu
硫酸铜和氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
2Al + 3Cu2+ = 2Al3+ +3 Cu
Cu2++SO42-+Ba2++2OH—=BaSO4↓ + Cu(OH)2↓
2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O
×
×
×
×
漏Cu(OH)2
课堂小结:
1. 离子反应的条件:能生成沉淀、气体、水或有离子参加的置换反应
2. 离子方程式书写的步骤:写、拆、删、查
3. 不能拆写成离子的物质:单质、氧化物、气体、水、
沉淀、弱酸、弱碱
随堂测:
1. 写出下列化学反应的离子方程式:
(1)Zn和硫酸铜溶液反应
(2)CaCO3溶液和稀盐酸反应
(3)铁与稀硫酸反应
(4)盐酸与氢氧化钡溶液
(5)硫酸铜溶液与氢氧化钡溶液
2.下列离子方程式正确的是( )
A .铁和稀硫酸反应:2Fe + 6H+ = 2Fe3+ + 3H2↑
B.铜和硝酸银溶液反应:Ag ++ Cu = Ag + Cu 2+
C.硫酸与氢氧化钡溶液的反应 :
H++SO42-+OH-+Ba2+=BaSO4↓+H2O
D.稀盐酸与氢氧化钠反应:H+ + OH- = H2O
D
不符合反应事实
Fe2+
电荷不守恒
配比不符合反应事实
2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O
3、下列化学反应的离子方程式其中正确的是( )
A.碳酸钙与盐酸反应:CO32―+2H+=CO2↑+H2O
B.氨水与盐酸反应:OH―+H+=H2O
C.氢氧化钡溶液与硫酸反应:Ba2++OH―+H++SO42―=BaSO4↓+H2O
D.铁与稀盐酸溶液反应:Fe+2 H+=Fe2++H2↑
D
3、下列反应的离子方程式书写正确的是( )
A.铜和醋酸反应:Cu+2CH3COOH=2CH3COO-+Cu2++H2↑
B.氧化亚铁与稀盐酸反应:FeO+2H+===Fe2++H2O
C.锌与硝酸银溶液反应:Zn+Ag+=Zn2++Ag
D.醋酸和氢氧化钠溶液反应:H++OH-=H2O
B
4.下列离子方程式书写正确的是( )
A.碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O
B.硫酸钠和氯化钡溶液反应:Ba2++SO42-=BaSO4↓
C.澄清石灰水中通入少量的二氧化碳:2OH-+CO2=CO
+H2O
D.稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
B
5.能正确表示下列反应的离子方程式是( )A.氢氧化钠溶液与醋酸反应:
B.MgSO4溶液中滴加稀氨水:
C.澄清石灰水中通入少量的二氧化碳:
D.Fe2(SO4)3溶液与Ba(OH)2溶液反应:
C
谢谢聆听
第二节 离子反应
2019新教材必修一第一章
第2课时 离子反应
学习目标:
1、通过实验,探究酸、碱、盐之间反应的事实,认识离子反应。
2、归纳离子反应发生的条件。
3、正确书写离子方程式。
难点:离子反应发生的条件、离子方程式的书写
重点:离子方程式的书写
实验导入
实验1-3:
向盛有2mL Na2SO4 稀溶液的试管中加入2mL BaCl2稀溶液 (两者恰好完全反应),观察现象并分析。
现象 分析
产生白色沉淀 Na2SO4与BaCl2的 电离方程式 混合前溶液 中的离子 混合后溶液
中的离子
Na2SO4=2Na+ + SO42-
BaCl2 = Ba2+ +2Cl-
Na+
SO42-
Ba2+
Cl-
Cl-
Na+
混合后Ba2+和SO42-结合成沉淀,它们的离子浓度减小。
实际参加反应的是:Ba2++SO42- =BaSO4 ↓
1.定义:电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应(即有离子参加或生成的反应)
离子反应
2. 实质:离子浓度的减少
3.表示方法:离子方程式(即用实际参加反应的离子符号来表示反应的式子)
离子反应发生的条件
复分解反应:能生成水、气体、沉淀,满足条件之一反应就可以发生
置换反应:在水溶液中发生的置换反应
CaCO3 +2H+=Ca2++H2O + CO2 ↑
H+ + OH- = H2O
Zn+Cu2+=Cu+Zn2+
Fe+ 2H+ = Fe2++H2↑
离子方程式的书写步骤
用实际参加反应的离子符号表示离子反应的式子。
写
拆
删
查
Na2SO4 + BaCl2 =2NaCl+ BaSO4↓
1. 写出反应的化学方程式(以Na2SO4 溶液和BaCl2溶液反应为例)
2. 把易溶于水且易电离的物质写成离子形式
2Na+ +SO42- + Ba2+ + 2Cl- = 2Na+ + 2Cl- +BaSO4↓
3. 删去方程式两边不参加反应的离子,并将方程化为最简
4.检查方程式两边各元素的原子个数和电荷总数是否相等
(强酸、强碱、大部分可溶性盐)
Ba2++SO42- =BaSO4 ↓
注意:不能拆的物质有沉淀、气体、水、弱酸、弱碱、单质、氧化物
离子方程式书写的最关键步骤是“拆”与“不拆”的理解判断。
9个难溶物:
蓝色沉淀Cu(OH)2
红褐色Fe(OH)3
白色沉淀7个:
Mg(OH)2
Al(OH)3 Fe(OH)2
BaSO4 BaCO3
CaCO3 AgCl
4个微溶物:
Ca(OH)2 CaSO4
MgCO3 Ag2SO4
弱酸:离子反应阶段,除了HCl、H2SO4、HNO3三个强酸,其他酸都是弱酸
弱碱:NH3●H2O、其他难溶性的碱
思考与讨论
完成下列表格,思考两种方程式表达的含义有什么不同?
反应物 化学方程式 离子方程式 两种化学方程式的不同
HCl+NaOH
HCl+KOH
H2SO4+NaOH
H2SO4+KOH
HCl+KOH=KCl+H2O
HCl+NaOH=NaCl+H2O
H2SO4+2NaOH=Na2SO4+2H2O
H2SO4+2KOH=K2SO4+2H2O
化学方程式表示一个具体的反应,离子方程式表示一类反应
离子方程式的意义:化学方程式仅表示一个反应,离子方程式不仅可以表示某个具体的化学反应,而且可表示同一类型的反应。
H++OH—=H2O
H++OH—=H2O
H++OH—=H2O
H++OH—=H2O
离子方程式的正误判断方法
1、看反应是否符合客观事实
2、看是否符合拆写原则
铁和稀盐酸反应:2Fe + 6H+ = 2Fe3+ + 3H2↑
氧化铁和稀盐酸反应: O2- +2H+=H2O
Fe + 2H+ = Fe2+ + H2↑
Fe2 O3+ 6H+ = 2Fe3+ + 3H2O↑
×
×
5、 看是否符合阴、阳离子的个数配比
4、 看是否漏掉离子反应
稀硫酸和氢氧化钡溶液反应:H++SO42-+OH-+Ba2+=BaSO4↓+H2O
3、看是否遵守质量守恒和电荷守恒定律
铝和硝酸铜溶液反应:Al + Cu2+ = Al3+ + Cu
硫酸铜和氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
2Al + 3Cu2+ = 2Al3+ +3 Cu
Cu2++SO42-+Ba2++2OH—=BaSO4↓ + Cu(OH)2↓
2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O
×
×
×
×
漏Cu(OH)2
课堂小结:
1. 离子反应的条件:能生成沉淀、气体、水或有离子参加的置换反应
2. 离子方程式书写的步骤:写、拆、删、查
3. 不能拆写成离子的物质:单质、氧化物、气体、水、
沉淀、弱酸、弱碱
随堂测:
1. 写出下列化学反应的离子方程式:
(1)Zn和硫酸铜溶液反应
(2)CaCO3溶液和稀盐酸反应
(3)铁与稀硫酸反应
(4)盐酸与氢氧化钡溶液
(5)硫酸铜溶液与氢氧化钡溶液
2.下列离子方程式正确的是( )
A .铁和稀硫酸反应:2Fe + 6H+ = 2Fe3+ + 3H2↑
B.铜和硝酸银溶液反应:Ag ++ Cu = Ag + Cu 2+
C.硫酸与氢氧化钡溶液的反应 :
H++SO42-+OH-+Ba2+=BaSO4↓+H2O
D.稀盐酸与氢氧化钠反应:H+ + OH- = H2O
D
不符合反应事实
Fe2+
电荷不守恒
配比不符合反应事实
2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O
3、下列化学反应的离子方程式其中正确的是( )
A.碳酸钙与盐酸反应:CO32―+2H+=CO2↑+H2O
B.氨水与盐酸反应:OH―+H+=H2O
C.氢氧化钡溶液与硫酸反应:Ba2++OH―+H++SO42―=BaSO4↓+H2O
D.铁与稀盐酸溶液反应:Fe+2 H+=Fe2++H2↑
D
3、下列反应的离子方程式书写正确的是( )
A.铜和醋酸反应:Cu+2CH3COOH=2CH3COO-+Cu2++H2↑
B.氧化亚铁与稀盐酸反应:FeO+2H+===Fe2++H2O
C.锌与硝酸银溶液反应:Zn+Ag+=Zn2++Ag
D.醋酸和氢氧化钠溶液反应:H++OH-=H2O
B
4.下列离子方程式书写正确的是( )
A.碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O
B.硫酸钠和氯化钡溶液反应:Ba2++SO42-=BaSO4↓
C.澄清石灰水中通入少量的二氧化碳:2OH-+CO2=CO
+H2O
D.稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
B
5.能正确表示下列反应的离子方程式是( )A.氢氧化钠溶液与醋酸反应:
B.MgSO4溶液中滴加稀氨水:
C.澄清石灰水中通入少量的二氧化碳:
D.Fe2(SO4)3溶液与Ba(OH)2溶液反应:
C
谢谢聆听
