9.3溶液的浓度课件(共33张PPT)—2022-2023学年九年级化学人教版下册
文档属性
| 名称 | 9.3溶液的浓度课件(共33张PPT)—2022-2023学年九年级化学人教版下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-09 22:22:01 | ||
图片预览








文档简介
(共33张PPT)
溶液的浓度
授课人:李佳欣
第三十五中学
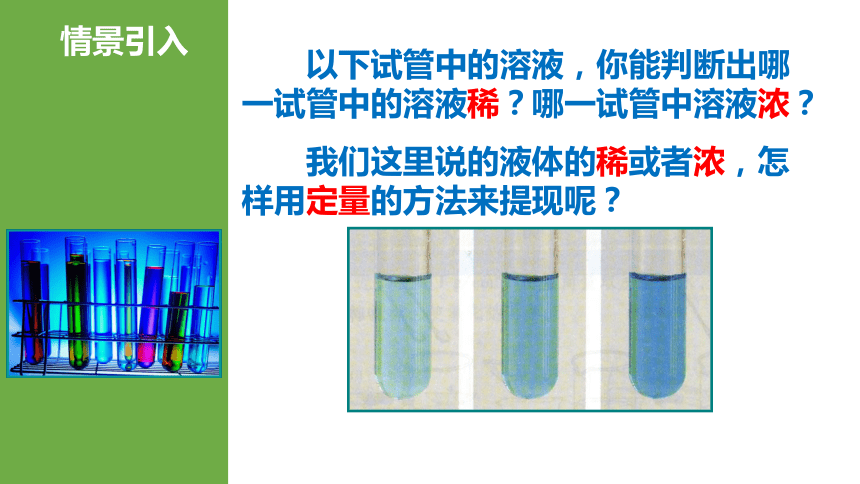
情景引入
以下试管中的溶液,你能判断出哪一试管中的溶液稀?哪一试管中溶液浓?
我们这里说的液体的稀或者浓,怎样用定量的方法来提现呢?
CONTENTS
01
02
浓溶液和稀溶液
溶质的质量分数
03
计算
01
浓溶液和稀溶液
01
浓溶液和稀溶液
浓溶液、稀溶液
3种不同浓稀硫酸铜溶液的配置:
实验结论:在溶剂质量相同的条件下,加入溶质多的溶液颜色深;加入溶质少的溶液颜色浅。
01
浓溶液和稀溶液
浓溶液、稀溶液
3种不同浓稀硫酸铜溶液的配置:
判断根据:
通过观察它们的颜色,颜色深的就“浓”,颜色浅的就“稀”。
一定量溶液里,所含溶质的多少。
01
浓溶液和稀溶液
浓溶液、稀溶液
①对于有色溶液来说,根据颜色深浅可以判断溶液是浓
还是稀。将溶液分为浓溶液和稀溶液,但是这种分法比较
粗略,不能准确地表明一定量的溶液里究竟含有多少溶质。
②在实际应用中,常常要准确知道一定量的溶液里所含溶质的量,即溶液的浓度。
③表示溶液浓度的方法很多,今天我们学习:溶质的质量分数。
02
溶质的质量分数
02
溶质的质量分数
溶质的质量分数
1、定义:
是溶质质量和溶液质量之比 。
2、公式:
溶质质量
溶液质量
×100%
溶质质量分数=
或=
溶质质量
溶质质量+溶剂质量
×100%
02
溶质的质量分数
计算溶质的质量分数
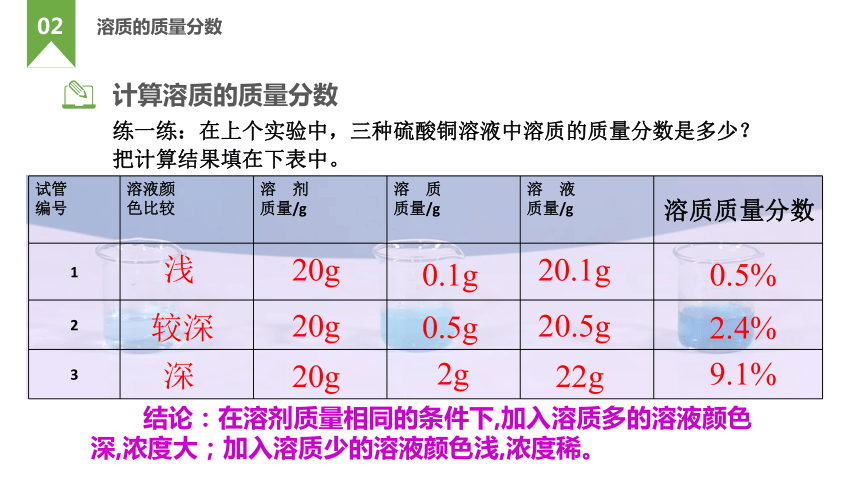
试管 编号 溶液颜 色比较 溶 剂 质量/g 溶 质 质量/g 溶 液 质量/g
1
2
3
浅
较深
深
20g
20g
20g
0.1g
0.5g
2g
20.1g
20.5g
22g
0.5%
2.4%
9.1%
溶质质量分数
结论:在溶剂质量相同的条件下,加入溶质多的溶液颜色深,浓度大;加入溶质少的溶液颜色浅,浓度稀。
练一练:在上个实验中,三种硫酸铜溶液中溶质的质量分数是多少?
把计算结果填在下表中。
02
溶质的质量分数
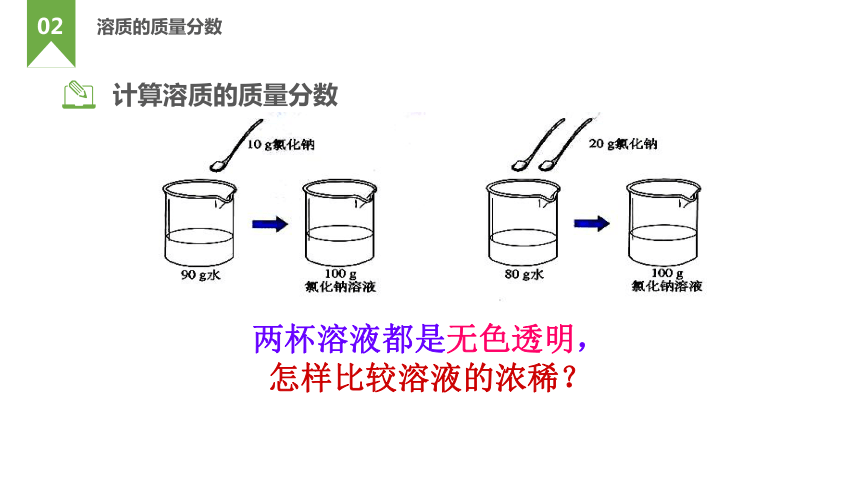
计算溶质的质量分数
两杯溶液都是无色透明,
怎样比较溶液的浓稀?
02
溶质的质量分数
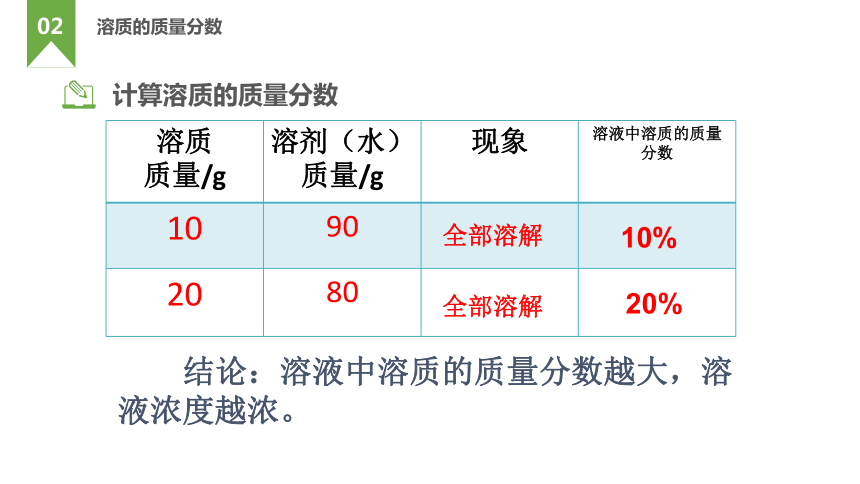
计算溶质的质量分数
溶质 质量/g 溶剂(水) 质量/g 现象 溶液中溶质的质量分数
10 90
20 80
结论:溶液中溶质的质量分数越大,溶液浓度越浓。
全部溶解
全部溶解
10%
20%
02
溶质的质量分数
溶质的质量分数de概念要点
定义:溶质的质量与溶液的质量之比。(通常以百分数表示)
溶质质量
溶液质量
×100%
溶质的质量分数=
或=
溶质质量
溶质质量+溶剂质量
×100%
注意:
①溶质的质量: 溶质质量指被溶解的那部分质量,没有溶解的质量不能计算在内。
②溶液的质量 = 溶质的质量 + 溶剂的质量。
(必须分清溶液与溶质、溶剂)。
③公式中分子、分母单位要统一。
④一定要×100%,最后结果才是百分数。
02
溶质的质量分数
讨论
讨论:已知20℃时,NaCl的溶解度为36g。有人说“20℃时NaCl饱和溶液的溶质质量分数为36%。”这种说法对吗?为什么?
答:不对。因为20℃时NaCl饱和溶液的溶质质量分数为:
=26.5%
36g
100g+36g
×100%
26.5%< 36%。 达不到36%。
结论:饱和溶液的溶质质量分数=
溶解度
100g+溶解度
03
计算
03
计算
溶质质量分数计算
[题型一] :有关溶质、溶剂和溶液之间的换算
溶质质量
溶液质量
×100%
溶质质量分数=
溶液质量 = 溶质质量 + 溶剂质量
计算的依据 :
03
计算
溶质质量分数计算
【例题1】在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
【解】
溶质的质量分数
溶质质量
溶液质量
100%
溶质质量
溶液质量
×溶质的质量分数
答: 配制150kg质量分数为16%的氯化钠溶液需24 kg氯化钠和126 kg水。
溶剂质量
溶液质量
溶质质量
—
150kg
16%
24kg
150kg
24kg
126kg
03
计算
溶质质量分数计算
[题型二] :饱和溶液中溶质质量分数的计算
溶质质量
溶液质量
×100%
溶质质量分数=
饱和溶液的定义
计算的依据 :
某温度下某物质的溶解度为ag,则同温下它的饱和溶液中溶质质量分数_____a%(填大于,小于或等于)
小于
03
计算
溶质质量分数计算
例 已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质质量分数。
解:20℃时食盐饱和溶液的溶质质量分数为:
=26.5%
36g
100g+36g
答:20℃时食盐饱和溶液的溶质质量分数26.5%
讨论:在20℃时食盐的溶解度为36g,将20g食盐放入100g水中得到 g溶液,此时溶液饱和吗?溶质的质量分数?如果是40g呢?
03
计算
溶质质量分数计算
[题型三] :溶液稀释与浓缩的相关计算
计算的依据 :
稀释前溶质质量 = 稀释后溶质质量
浓缩前溶质质量 = 浓缩后溶质质量
稀释后溶液质量等于稀释前溶液质量和加入的水的质量之和。
03
计算
溶质质量分数计算
例: 化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?
分析:解决这道题的关键是什么?
解:
溶液稀释前后溶质的质量不变
设稀释后溶液的质量为x。
50g× 98%=X × 20%
X=245g
需要水的质量=245g-50g=195g
答:需要水的质量为195g。
公式: m浓×c浓%= m稀×c稀%
液体质量(克)=液体体积(毫升)×密度(克/毫升)
03
计算
溶质质量分数计算
练习:配制10%硫酸98g,要98%硫酸(密度为1.84g/m L )多少mL ?
解:设需要98%硫酸的体积为V.
Vx1.84g/mL x98% = 98g x10%
V =
答:要98%硫酸5.4mL
03
计算
溶质质量分数计算
[题型四] :根据化学反应的计算
计算的依据 :
溶质质量
溶液质量
×100%
溶质质量分数=
化学反应相关计算
03
计算
溶质质量分数计算
1.50g的稀盐酸与6.5g锌恰好完全反应,得0.2g氢气,求盐酸的溶质的质量分数.
解:此稀盐酸中溶质的质量为x.
Zn+2HCl=ZnCl2+H2
65 73
6.5g x
X=7.3g
7.3g
50g
x 100%=14.6%
答:略
你能说出反应后溶质、溶剂、溶液分别是?
溶质质量分数是?
04
浓度
练一练
1.某温度时,蒸干35g氯化钾溶液,得到7g氯化钾,求该溶液中溶质的质量分数。
【解】
溶质的质量分数= ×100%
溶质质量
溶液质量
溶质的质量分数 = × 100% = 20%
7g
35g
答:该溶液中溶质的质量分数为20%
04
浓度
练一练
【解】溶液质量 = 溶液体积 × 溶液密度
= 500mL ×1.1g/cm3 = 550g
溶质质量 = 550g ×10% = 55g
溶剂质量 = 550g — 55g = 495g
答:需要氢氧化钠55g,水495g。
2.配制500mL质量分数为10%的氢氧化钠溶液 (密度1.1g/cm3),需要氢氧化钠和水的质量各是多少?
04
浓度
练一练
3.在20℃时,将40g硝酸钾固体加入100g水中,充分搅拌后,仍有8.4g硝酸钾固体未溶解。请填写下列空白:
① 所得溶液是20℃时硝酸钾的______溶液;(填“饱和”或“不饱和”)
② 20℃时硝酸钾的溶解度为________;
③ 所得溶液中硝酸钾的质量分数为______。
24%
31.6g
饱和
05
一定质量分数氯化钠溶液的配制
如何配制50g质量分数为6%的氯化钠溶液?
05
一定质量分数氯化钠溶液的配制
如何配制50g质量分数为6%的氯化钠溶液?
1、计算:配制时所需NaCl质量为__________,
所需水的质量_____,
2、称量(或量取)
用托盘天平称3gNaCl固体,倒入烧杯中
用量筒量取47m L水的体积,倒入盛有NaCl
的烧杯中
3、溶解:用玻璃棒搅拌烧杯中的溶液,使NaCl溶解
4、把配好的溶液装入试剂瓶中,盖好瓶塞并贴上标签。
(标签上应包括药品名称和溶液中溶质的质量分数)
05
一定质量分数氯化钠溶液的配制
练习:下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的错误,并说明理由。
1、
2、
3、
4、
05
一定质量分数氯化钠溶液的配制
误差分析
导致溶液的溶质质量分数偏小的原因:
1、天平使用不正确,如药品.砝码放反(称量时使用游码),使药品称量质量偏小。
2、量取水的过程中仰视读数,使水量取多了。
3、烧杯不干燥,原来内部就有一些水。
4、固体药品中含有杂质等。
05
一定质量分数氯化钠溶液的配制
误差分析
导致溶液的溶质质量分数偏大的原因:
1、天平使用不正确,如称量前没有调平衡,指针偏右,导致药品称量偏多。
2、砝码已生锈。
3、量取水的过程中俯视读数,使水量取少了。
4、将量筒中的水倒入烧杯时,一部分洒在外面等。
感谢您的观看
END
第三十五中学
溶液的浓度
授课人:李佳欣
第三十五中学
情景引入
以下试管中的溶液,你能判断出哪一试管中的溶液稀?哪一试管中溶液浓?
我们这里说的液体的稀或者浓,怎样用定量的方法来提现呢?
CONTENTS
01
02
浓溶液和稀溶液
溶质的质量分数
03
计算
01
浓溶液和稀溶液
01
浓溶液和稀溶液
浓溶液、稀溶液
3种不同浓稀硫酸铜溶液的配置:
实验结论:在溶剂质量相同的条件下,加入溶质多的溶液颜色深;加入溶质少的溶液颜色浅。
01
浓溶液和稀溶液
浓溶液、稀溶液
3种不同浓稀硫酸铜溶液的配置:
判断根据:
通过观察它们的颜色,颜色深的就“浓”,颜色浅的就“稀”。
一定量溶液里,所含溶质的多少。
01
浓溶液和稀溶液
浓溶液、稀溶液
①对于有色溶液来说,根据颜色深浅可以判断溶液是浓
还是稀。将溶液分为浓溶液和稀溶液,但是这种分法比较
粗略,不能准确地表明一定量的溶液里究竟含有多少溶质。
②在实际应用中,常常要准确知道一定量的溶液里所含溶质的量,即溶液的浓度。
③表示溶液浓度的方法很多,今天我们学习:溶质的质量分数。
02
溶质的质量分数
02
溶质的质量分数
溶质的质量分数
1、定义:
是溶质质量和溶液质量之比 。
2、公式:
溶质质量
溶液质量
×100%
溶质质量分数=
或=
溶质质量
溶质质量+溶剂质量
×100%
02
溶质的质量分数
计算溶质的质量分数
试管 编号 溶液颜 色比较 溶 剂 质量/g 溶 质 质量/g 溶 液 质量/g
1
2
3
浅
较深
深
20g
20g
20g
0.1g
0.5g
2g
20.1g
20.5g
22g
0.5%
2.4%
9.1%
溶质质量分数
结论:在溶剂质量相同的条件下,加入溶质多的溶液颜色深,浓度大;加入溶质少的溶液颜色浅,浓度稀。
练一练:在上个实验中,三种硫酸铜溶液中溶质的质量分数是多少?
把计算结果填在下表中。
02
溶质的质量分数
计算溶质的质量分数
两杯溶液都是无色透明,
怎样比较溶液的浓稀?
02
溶质的质量分数
计算溶质的质量分数
溶质 质量/g 溶剂(水) 质量/g 现象 溶液中溶质的质量分数
10 90
20 80
结论:溶液中溶质的质量分数越大,溶液浓度越浓。
全部溶解
全部溶解
10%
20%
02
溶质的质量分数
溶质的质量分数de概念要点
定义:溶质的质量与溶液的质量之比。(通常以百分数表示)
溶质质量
溶液质量
×100%
溶质的质量分数=
或=
溶质质量
溶质质量+溶剂质量
×100%
注意:
①溶质的质量: 溶质质量指被溶解的那部分质量,没有溶解的质量不能计算在内。
②溶液的质量 = 溶质的质量 + 溶剂的质量。
(必须分清溶液与溶质、溶剂)。
③公式中分子、分母单位要统一。
④一定要×100%,最后结果才是百分数。
02
溶质的质量分数
讨论
讨论:已知20℃时,NaCl的溶解度为36g。有人说“20℃时NaCl饱和溶液的溶质质量分数为36%。”这种说法对吗?为什么?
答:不对。因为20℃时NaCl饱和溶液的溶质质量分数为:
=26.5%
36g
100g+36g
×100%
26.5%< 36%。 达不到36%。
结论:饱和溶液的溶质质量分数=
溶解度
100g+溶解度
03
计算
03
计算
溶质质量分数计算
[题型一] :有关溶质、溶剂和溶液之间的换算
溶质质量
溶液质量
×100%
溶质质量分数=
溶液质量 = 溶质质量 + 溶剂质量
计算的依据 :
03
计算
溶质质量分数计算
【例题1】在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
【解】
溶质的质量分数
溶质质量
溶液质量
100%
溶质质量
溶液质量
×溶质的质量分数
答: 配制150kg质量分数为16%的氯化钠溶液需24 kg氯化钠和126 kg水。
溶剂质量
溶液质量
溶质质量
—
150kg
16%
24kg
150kg
24kg
126kg
03
计算
溶质质量分数计算
[题型二] :饱和溶液中溶质质量分数的计算
溶质质量
溶液质量
×100%
溶质质量分数=
饱和溶液的定义
计算的依据 :
某温度下某物质的溶解度为ag,则同温下它的饱和溶液中溶质质量分数_____a%(填大于,小于或等于)
小于
03
计算
溶质质量分数计算
例 已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质质量分数。
解:20℃时食盐饱和溶液的溶质质量分数为:
=26.5%
36g
100g+36g
答:20℃时食盐饱和溶液的溶质质量分数26.5%
讨论:在20℃时食盐的溶解度为36g,将20g食盐放入100g水中得到 g溶液,此时溶液饱和吗?溶质的质量分数?如果是40g呢?
03
计算
溶质质量分数计算
[题型三] :溶液稀释与浓缩的相关计算
计算的依据 :
稀释前溶质质量 = 稀释后溶质质量
浓缩前溶质质量 = 浓缩后溶质质量
稀释后溶液质量等于稀释前溶液质量和加入的水的质量之和。
03
计算
溶质质量分数计算
例: 化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?
分析:解决这道题的关键是什么?
解:
溶液稀释前后溶质的质量不变
设稀释后溶液的质量为x。
50g× 98%=X × 20%
X=245g
需要水的质量=245g-50g=195g
答:需要水的质量为195g。
公式: m浓×c浓%= m稀×c稀%
液体质量(克)=液体体积(毫升)×密度(克/毫升)
03
计算
溶质质量分数计算
练习:配制10%硫酸98g,要98%硫酸(密度为1.84g/m L )多少mL ?
解:设需要98%硫酸的体积为V.
Vx1.84g/mL x98% = 98g x10%
V =
答:要98%硫酸5.4mL
03
计算
溶质质量分数计算
[题型四] :根据化学反应的计算
计算的依据 :
溶质质量
溶液质量
×100%
溶质质量分数=
化学反应相关计算
03
计算
溶质质量分数计算
1.50g的稀盐酸与6.5g锌恰好完全反应,得0.2g氢气,求盐酸的溶质的质量分数.
解:此稀盐酸中溶质的质量为x.
Zn+2HCl=ZnCl2+H2
65 73
6.5g x
X=7.3g
7.3g
50g
x 100%=14.6%
答:略
你能说出反应后溶质、溶剂、溶液分别是?
溶质质量分数是?
04
浓度
练一练
1.某温度时,蒸干35g氯化钾溶液,得到7g氯化钾,求该溶液中溶质的质量分数。
【解】
溶质的质量分数= ×100%
溶质质量
溶液质量
溶质的质量分数 = × 100% = 20%
7g
35g
答:该溶液中溶质的质量分数为20%
04
浓度
练一练
【解】溶液质量 = 溶液体积 × 溶液密度
= 500mL ×1.1g/cm3 = 550g
溶质质量 = 550g ×10% = 55g
溶剂质量 = 550g — 55g = 495g
答:需要氢氧化钠55g,水495g。
2.配制500mL质量分数为10%的氢氧化钠溶液 (密度1.1g/cm3),需要氢氧化钠和水的质量各是多少?
04
浓度
练一练
3.在20℃时,将40g硝酸钾固体加入100g水中,充分搅拌后,仍有8.4g硝酸钾固体未溶解。请填写下列空白:
① 所得溶液是20℃时硝酸钾的______溶液;(填“饱和”或“不饱和”)
② 20℃时硝酸钾的溶解度为________;
③ 所得溶液中硝酸钾的质量分数为______。
24%
31.6g
饱和
05
一定质量分数氯化钠溶液的配制
如何配制50g质量分数为6%的氯化钠溶液?
05
一定质量分数氯化钠溶液的配制
如何配制50g质量分数为6%的氯化钠溶液?
1、计算:配制时所需NaCl质量为__________,
所需水的质量_____,
2、称量(或量取)
用托盘天平称3gNaCl固体,倒入烧杯中
用量筒量取47m L水的体积,倒入盛有NaCl
的烧杯中
3、溶解:用玻璃棒搅拌烧杯中的溶液,使NaCl溶解
4、把配好的溶液装入试剂瓶中,盖好瓶塞并贴上标签。
(标签上应包括药品名称和溶液中溶质的质量分数)
05
一定质量分数氯化钠溶液的配制
练习:下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的错误,并说明理由。
1、
2、
3、
4、
05
一定质量分数氯化钠溶液的配制
误差分析
导致溶液的溶质质量分数偏小的原因:
1、天平使用不正确,如药品.砝码放反(称量时使用游码),使药品称量质量偏小。
2、量取水的过程中仰视读数,使水量取多了。
3、烧杯不干燥,原来内部就有一些水。
4、固体药品中含有杂质等。
05
一定质量分数氯化钠溶液的配制
误差分析
导致溶液的溶质质量分数偏大的原因:
1、天平使用不正确,如称量前没有调平衡,指针偏右,导致药品称量偏多。
2、砝码已生锈。
3、量取水的过程中俯视读数,使水量取少了。
4、将量筒中的水倒入烧杯时,一部分洒在外面等。
感谢您的观看
END
第三十五中学
同课章节目录
