化学人教版(2019)选择性必修2 3.4.1配合物(共62张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.4.1配合物(共62张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 13.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-12 00:00:00 | ||
图片预览











文档简介
(共62张PPT)
第三章 晶体结构与性质
第四节 配合物与超分子
第1课时 配合物
【课程目标】
1、通过熟悉的无水硫酸铜与其溶液颜色不同这一现象,认识配位键的特征,并能与共价键进行简单比较。
2、在配位键的基础上,认识配合物的存在、结构特点及常见配合物的制取等。
CuSO4·5H2O晶体
无水硫酸铜
一、配合物:
Why?
情景引入
无水CuSO4是白色的,为什么CuSO4·5H2O晶体却是蓝色的?
一、配合物:
P95
②CuCl2 2H2O:绿色
CuCl2:棕(黄)色
说明:
一、配合物:
天蓝色
无色
CuSO4溶液、CuCl2溶液、CuBr2溶液
Cu2+呈天蓝色;
SO42-、Cl—、Br—、Na+、K+没有颜色
一、配合物:
P95
②CuCl2 2H2O:绿色
CuCl2:棕(黄)色
说明:
CuSO4溶液 CuCl2溶液 CuBr2溶液
蓝色 蓝色 蓝色
观察下列固体物质的颜色,你能得出什么结论?
CuSO4晶体 CuCl2晶体 CuBr2晶体
白色 棕(黄)色 深褐色
【观察思考1】
固态Cu2+盐不一定显蓝色
结论修正:Cu2+在水溶液中常显蓝色
结论:
CuSO4·5H2O晶体 CuCl2·2H2O晶体
蓝色 绿色
【观察思考2】
观察下列晶体的颜色,你能得出什么结论?
CuSO4·5H2O晶体也显蓝色
理论解释:
Cu2+与水结合显蓝色
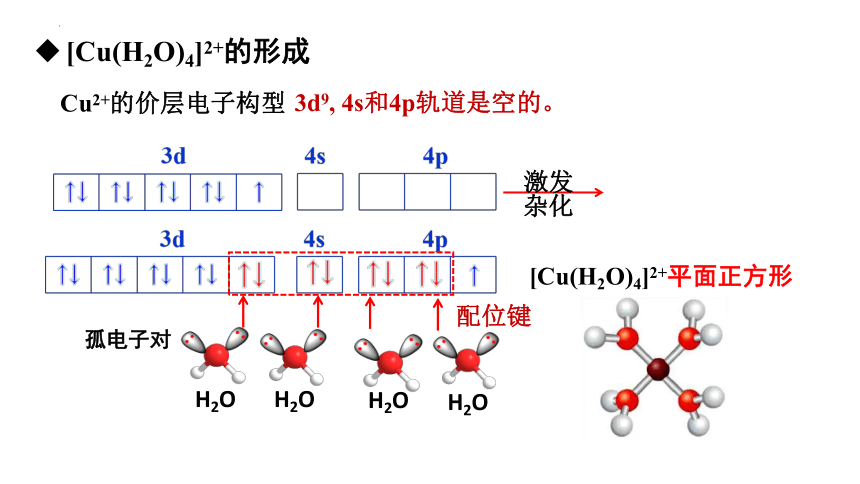
实验证明,硫酸铜晶体和 Cu2+的水溶液呈蓝色,实际上是Cu2+和H2O形成的[Cu(H2O)4]2+呈蓝色。[Cu(H2O)4]2+叫做四水合铜离子。
思考:Cu2+与H2O是如何结合的呢?
一、配合物:
Cu2+的价层电子构型
[Cu(H2O)4]2+的形成
激发
杂化
H2O
H2O
H2O
H2O
[Cu(H2O)4]2+平面正方形
配位键
3d9, 4s和4p轨道是空的。
孤电子对
1、配位键:
⑴概念:
⑵条件:中心原子(离子)提供空轨道,配体提供孤电子对
一、配合物:
成键原子或离子一方提供空轨道,另一方提供孤电子对而形成的,这类“电子对给予-接受”键被称为配位键。
形成条件
一方能提供孤电子对
另一方能提供空轨道
如分子有NH3、H2O、HF、CO等;
离子有Cl-、OH-、CN-、SCN-等。
如H+、Al3+、B及过渡金属的原子或离子Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等。
⑶特点:
⑷表示方法:
1、配位键:
一、配合物:
一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
或
(A提供孤电子对) A→B (B提供空轨道) 或 A—B
配位键是一种特殊的共价键,具有方向性和饱和性。
练习1:写出NH4+和H3O+的配位键的表示法?
(1)相同原子间形成的配位键与它们之间形成的共价单键相同,如
故其结构式也可表示为
NH4+的空间结构是正四面体形
(2)配位键一般是共价单键,属于σ键。
说明
中的4个N-H(键能、键长和键角)完全相同,
(1)中心原子(离子):提供空轨道的金属离子或原子。一般是过渡金属,必须有空轨道。
(2)配位体:含有孤电子对的分子或离子,如 NH3 H2O CO Cl- SCN- CN-
(3)配位原子:配位体中具有孤电子对的原子N O P S,一般是ⅤA Ⅵ A ⅦA的非金属原子
(4)配位数:直接同中心原子配位的分子或原子数目,一般是2、4、6、8
(5)配离子的电荷:等于中心离子和配体总电荷的代数和,如[Fe(SCN)6]3-
一、配合物:
2、配位化合物:
1).概念:把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以 配位键 结合形成的化合物称为配位化合物,
简称配合物。
一、配合物:
P96
配位化合物一定含有配位键,
但含有配位键的化合物不一定是配位化合物。
例如:CO、NH4+、H3O+、、P2O5
如氢氧化二氨合银{[Ag(NH3)2]OH}、硫酸四氨合铜[Cu(NH3)4]SO4}等
= [Cu(H2O)4]2+
2、配位化合物:
2).组成:
配合物由内界和外界构成,配合单元是内界,
内界由中心离子(原子)和配体构成。外界是带异号电荷的离子。
内界与外界以离子键结合,
在水中完全电离,内界较稳定。
一、配合物:
P96
内界
外界
中心离子
配体
配位数
+ SO42-
配
位
原
子
配位原子:配体中给出孤电子对与中心形成配位键的原子。
如H2O中O,CO中的C,NH3中的N 。
内界微粒很难电离(电离程度很小),因此,配合物[Co(NH3)5C1]Cl2内界中的C1—不能被Ag+沉淀,只有外界的C1—才能与AgNO3溶液反应产生沉淀。
配合物在水溶液中电离成内界和外界两部分,
如 [Co(NH3)5Cl]Cl2 = [Co(NH3)5C1]2+ + 2C1—,
注意:
配合物 内界 外界 中心粒子 配位体 配位数
[Ag(NH3)2]OH 氢氧化二氨合银
K3[Fe(CN)6]
[Co(NH3)5Cl]Cl2
Ni(CO)4
请根据给出的配合物完成下表
[Ag(NH3)2]+
OH-
Ag+
NH3
2
【思考与讨论】
[Fe(CN)6]3-
K+
Fe3+
CN-
6
[Co(NH3)5Cl]2+
Cl-
Co3+
NH3、Cl-
6
4
无
Ni
CO
Ni(CO)4
六氰合铁酸钾
四羰基镍
配合物结构小结:
2、中心粒子可以是阳离子,也可以是中性原子;
3、配位体可以是离子或分子,可以有一种或同时存在多种;
4、配位数通常为2、4、6、8这样的偶数。
1.有些配合物没有外界;如 Ni(CO)4 、Fe(CO)5
1.下列不属于配位化合物的是( )
六氟合铝(Ⅲ)酸钠:
氢氧化二氨合银(Ⅰ):
C.六氟合铁(Ⅲ)酸钾:
D.十二水硫酸铝钾:
E. 六氰合铁(Ⅱ)酸钾: K4[Fe(CN)6]
F. 光卤石:KCl·MgCl ·6H O
D F
跟踪练习
2、0.01 mol氯化铬(CrCl3·6H2O)在水溶液中用过量硝酸银溶液处理,
产生0.02 mol AgCl沉淀。此氯化铬最可能是( )
A.[Cr(H2O)6]Cl3
B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl2]Cl·2H2O
D.[Cr(H2O)3Cl3]·3H2O
跟踪练习
B
3. 可写成 ,其结构如图, 下列说法正确的是( )
A.在上述结构中,所有氧原子都采用 sp2 杂化
B.在上述结构中,存在配位键、共价键,不存在离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的两种结晶水在不同的温度下会分步失去
D
跟踪练习
4. 配合物Na2[Fe(CN)5(NO)]可用于离子检验,下列说法不正确的是( )。
A.配离子为[Fe(CN)5(NO)]2-,中心离子为Fe3+,配位数为6,配位原子有C和N
B.该配合物为离子化合物,易电离,1mol该配合物电离共得到的离子数目为3NA
C.1 mol该配合物中σ键的数目为12NA
D.此配合物中存在离子键、配位键、极性键、非极性键
D
跟踪练习
3、常见的配合物及其制取
(1)[Cu(H2O)4]2+
一、配合物:
已知配合物的品种超过数百万种,是一个庞大的化合物家族。
(2)[Cu(NH3)4](OH)2
P96
3、常见的配合物及其制取
一、配合物:
加氨水
继续加氨水
加乙醇
静置
蓝色溶液
蓝色沉淀
沉淀溶解,得深蓝色溶液
得深蓝色晶体
实验3-3 制取 [Cu(NH3)4](OH)2
反应①:
①
②
③
反应②:
[Cu(NH3)4]2+ + SO42- + H2O = [Cu(NH3)4]SO4·H2O↓
乙醇
深蓝色晶体
该晶体在乙醇中的溶解度较小
硫酸四氨合铜晶体
Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH4+
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
深蓝色溶液
反应③:
实验证明,无论在得到的深蓝色透明溶液中,还是在析出的深蓝色晶体中,深蓝色都是由于存在[Cu(NH3)4]2+,中心离子是Cu2+,而配体是NH3,配位数为4。
深蓝色
平面正方形
实验3-3 制取 [Cu(NH3)4](OH)2
四氨合铜离子
思考:
与
的稳定性?
比较
NaOH
Cu(OH)2
氨水
NaOH
不反应
更稳定,配位键更强
回想一下,如何检验Fe3+?
必修一
思考:Fe3+与SCN-如何反应?
Fe3+ + 3SCN- Fe(SCN)3
(3) K3Fe(SCN)6
P97
3、常见的配合物及其制取
一、配合物:
六氰合铁酸钾
硫氰化钾(KSCN)溶液
溶液变为血红色
FeCl3溶液棕黄色
Fe3+ + n SCN- [Fe(SCN)n]3-n
n = 1∽6,随SCN-的浓度而异
实验原理
Fe3+ + SCN- Fe(SCN)2+
Fe(SCN)2+ + SCN- Fe(SCN)2+
Fe(SCN)52- + SCN- Fe(SCN)63-
…………
应用:检验或鉴定Fe3+,用于电影特技和魔术表演
(4)[Ag(NH3)2]Cl
P97
3、常见的配合物及其制取
一、配合物:
加NaCl溶液
逐滴加氨水
AgNO3溶液
AgCl沉淀
沉淀消失,得澄清的无色溶液
Ag++Cl-=AgCl↓
AgCl+2NH3=[Ag(NH3)2]Cl
二氨合银离子
实验3-5 制取[Ag(NH3)2]Cl
1.怎样配制银氨溶液?发生哪些反应?
思考与讨论:
向AgNO3溶液中逐滴加稀氨水,直到最初生成的沉淀恰好溶解为止。
氨水呈弱碱性,滴入AgNO3溶液中,会形成AgOH白色沉淀,
AgOH+2NH3·H2O = [Ag(NH3)2]+ + OH- + 2H2O
继续滴加氨水时,NH3分子与Ag+形成[Ag(NH3)2]+配合离子,配合离子很稳定,会使AgOH逐渐溶解。
Ag+ + NH3·H2O = AgOH↓ + NH4+
2. 配合物[Cu(NH3)4]SO4中含有的化学键类型有哪些
3. 分析NH3和BF3可以形成配位键吗?
有离子键、共价键、配位键。
可以形成NH3·BF3
思考与讨论:
4.解决问题
0.1mol/L CuCl2溶液
2mol/L CuCl2溶液
蓝色
蓝绿色
溶液浓度变化为什么会导致色调变化?
一、配合物:
Cu2+ Cl- 颜色
①0.1 mol/L CuCl2溶液 稀 稀 蓝
②2 mol/L CuCl2溶液 浓 浓 蓝绿
③
④
哪个因素导致浓CuCl2溶液变蓝绿色?
4.解决问题
一、配合物:
能设计实验来证明吗?
Cu2+ Cl- 颜色
①0.1 mol/L CuCl2溶液 稀 稀 蓝
②2 mol/L CuCl2溶液 浓 浓 蓝绿
③0.1 mol/L CuCl2溶液 +饱和CuSO4溶液
④0.1 mol/L CuCl2溶液 +6 mol/L NaCl溶液
4.解决问题
一、配合物:
哪个因素导致浓CuCl2溶液变蓝绿色?
浓
稀
蓝
对比
对比①和③,说明 .
增大Cu2+的浓度不会导致溶液颜色变为蓝绿色。
Cu2+ Cl- 颜色
①0.1 mol/L CuCl2溶液 稀 稀 蓝
②2 mol/L CuCl2溶液 浓 浓 蓝绿
③0.1 mol/L CuCl2溶液 +饱和CuSO4溶液
④0.1 mol/L CuCl2溶液 +6 mol/L NaCl溶液
4.解决问题
一、配合物:
哪个因素导致浓CuCl2溶液变蓝绿色?
浓
浓
稀
稀
蓝
蓝绿
对比
对比①和④,说明 。
在含有Cu2+的溶液中,增大Cl-的浓度会使溶液变为蓝绿色。
综合对上述实验的分析,Cl-的浓度较高是CuCl2的浓溶液不呈纯蓝色而呈蓝绿色的原因。
① Cu2+与Cl-可以形成一系列配合物,在水溶液中,作为配体的Cl-可以多至4个。在Cl-的浓度极高时,形成的CuCl42-呈黄色。
4.解决问题
一、配合物:
② 颜色叠加:蓝 + 黄 = 绿。
查阅资料:
Cu
Cl
Cl
Cl
Cl
2-
四氯合铜酸根
配体:Cl-
中心离子:Cu2+
配位数:4
CuCl 也是配离子 含配阴离子的化合物
4
2-
4.解决问题
一、配合物:
c(CuCl2) 0.1mol/L 0.1mol/L 0.1mol/L 0.1mol/L
c(NaCl) 0 mol/L 2 mol/L 6 mol/L 饱和
颜色
含0.1 mol/L Cu2+的溶液中,Cl-的浓度越高,
配位的Cl-越多,颜色越偏绿色,直至黄绿色
4.解决问题
一、配合物:
5、配合物的形成对性质的影响
(1)对溶解性的影响
一些难溶于水的金属氢氧化物、卤化物、氰化物,可以溶解于氨水中,或依次溶解于含过量的OH—、Cl—、Br—、I—、CN—的溶液中,形成可溶性的配合物。
一、配合物:
如:Cu(OH)2 + 4NH3 =[Cu(NH3)4]2+ + 2OH—
Al(OH)3 + NaOH = Na[Al(OH)4]
四羟基合铝酸钠
AgCl + 2NH3·H2O = Ag(NH3)2Cl + 2H2O
CuCl难溶于水,可溶于浓盐酸和氨水
5、配合物的形成对性质的影响
(2)颜色的改变
当简单离子形成配离子时,颜色会发生变化,据此可以判断是否有配离子生成。
一、配合物:
如Fe3+与SCN-形成硫氰化铁配离子,其溶液显红色。
5、配合物的形成对性质的影响
一、配合物:
(3)稳定性增强
当中心原子(离子)相同时,配合物的稳定性与配体的性质有关。
配合物具有一定的稳定性,配位键越强,配合物越稳定。
例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO中毒。
在人和动物体内起输送氧气作用的血红素,是Fe的配合物。
配合物在生产和科学技术方面的应用也很广泛.
例如,在医药科学、化学催化剂、新型分子材料等领域都有着广泛的应用。
6.配合物的应用
一、配合物:
6.配合物的应用
①在生命体中的应用
②在医药中的应用
叶绿素
血红素
抗癌药物
酶
维生素B12
钴配合物
含锌的配合物
含锌酶有80多种
Fe2+的配合物
Mg2+的配合物
③配合物与生物固氮
固氮酶
④在生产生活中的应用
王水溶金
电解氧化铝的助熔剂 Na3[AlF6]
热水瓶胆镀银 [Ag(NH3)2]+
H[AuCl4]
一、配合物:
拓展视野
在配位化学及其应用领域做出重要贡献的我国著名化学家
→唐敖庆教授是我国现代理论化学的开拓者和奠基人。他从20世纪 60 年代起系统地开展配位场理论的研究;70年代,进行了配合化学模拟生物固氮作用的研究,开展了分子氮配位作用的化学键理论研究,其"配位场理论方法"获 1982 年国家自然科学奖一等奖。
→徐光宪教授长期从事物理化学和无机化学的教学及研究,涉及量子化学、化学键理论、配位化学、萃取化学、核燃料化学和稀土科学等领域。基于对稀土化学键、配位化学和物质结构等基本规律的深刻认识,他发现了稀土溶剂萃取体系具有"恒定混合萃取比"基本规律。20世纪 70年代,│他建立了具有普适性的串级萃取理论,极大提升了利用配合│物萃取分离稀土元素的效率,为我国稀土工业的发展做出了突出贡献,获得 2008 年度"国家最高科学技术奖"。
1.若X、Y两种粒子之间可形成配位键,则下列说法正确的是( )
A.X、Y只能是分子
B.X、Y只能是离子
C.若X提供空轨道,则Y至少要提供一对孤电子对
D.若X提供空轨道,则配位键表示为X→Y
C
【课堂练习】
2.下列粒子中含配位键的是( )
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)3
⑥Fe(SCN)3 ⑦H3O+ ⑧Ag(NH3)2OH
A.①②④⑦⑧ B.③④⑤⑥⑦
C.①④⑤⑥⑦⑧ D.全部
C
【课堂练习】
3.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象的说法正确的是( )
A.沉淀溶解后,生成深蓝色的配合离子[Cu(NH3)4]2+
B.[Cu(H2O)4]2+比[Cu(NH3)4]2+中的配位键稳定
C.用硝酸铜溶液代替硫酸铜溶液进行实验,不能观察到同样的现象
D.在[Cu(NH3)4]2+中,Cu2+给出孤电子对,NH3提供空轨道
A
【课堂练习】
4.下列物质中,不能作为配合物的配体的是( )。
A.NH3 B.NH4 C.H2O D.SCN-
+
【课堂练习】
H:N:H
H
:
:
H:O:H
:
:
:S::C::N:
:
:
-
H:N:H
H
:
:
H
+
B
Cu(NH3)4
2+
Cu(H2O)4
2+
Fe(SCN)2+
实例:
[Co(NH3)4Cl2]+ Cl-
[Co(NH3)4Cl2]+ NO3
5.能区别[Co(NH3)4Cl2]Cl和[Co(NH3)4Cl2]NO3两种溶液的试剂是( )
A.AgNO3溶液 B.NaOH溶液 C.CCl4 D.浓氨水
-
【课堂练习】
A
产生白色沉淀
6.硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4的中心离子是_____, 配体是____,配位数是____。
Ni2+
6
NH3
[Ni(NH3)6]2+ SO4
Ni2+ 6NH3
2-
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为 ,提供孤电子对的成键原子是 。
配位键
N
H-N-H
H
-
:
【课堂练习】
7.指出下列各配合物中的配离子、中心离子、配位体、配位原子和配位数。
① K3[Fe(CN)6] ②(NH4)2[PtCl6] ③[Cd(NH3)4](OH)2
【课堂练习】
① K3[Fe(CN)6] === 3K+ + [Fe(CN)6]3-
配离子 中心离子 配位体 配位原子 配位数
[Fe(CN)6]3-
Fe3+
CN-
6
C
:C N:
-
:
:
:
:
7.指出下列各配合物中的配离子、中心离子、配位体、配位原子和配位数。
① K3[Fe(CN)6] ②(NH4)2[PtCl6] ③[Cd(NH3)4](OH)2
【课堂练习】
配离子 中心离子 配位体 配位原子 配位数
[PtCl6]2-
6
Cl
② (NH4)2[PtCl6] === 2NH4 + [PtCl6]2-
+
Pt4+
Cl-
7.指出下列各配合物中的配离子、中心离子、配位体、配位原子和配位数。
① K3[Fe(CN)6] ②(NH4)2[PtCl6] ③[Cd(NH3)4](OH)2
【课堂练习】
配离子 中心离子 配位体 配位原子 配位数
[Cd(NH3)4]2+
4
N
③[Cd(NH3)4](OH)2 === [Cd(NH3)4]2+ + 2OH-
Cd2+
NH3
8.取CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)各1 mol,分别溶于水,加入足量AgNO3溶液,立即产生AgCl沉淀的物质的量分别为3 mol、2 mol。请根据实验事实用配合物的形式写出它们的化学式。
[Co(NH3)6]Cl3
[Co(NH3)5Cl]Cl2
9.回答下列问题:
(1)配合物[Ag(NH3)2]OH的中心离子是____,配位原子是___,配位数是_____,它的电离方程式是 。
(2)向盛有少量NaCl溶液的试管中滴入少量AgNO3溶液,再加入氨水,观察到的现象是 。
Ag+
N
2
[Ag(NH3)2]OH==[Ag(NH3)2]++OH-
先产生白色沉淀,加入氨水后,白色沉淀溶解
10.(1)Zn的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,1 mol该配合物中含有σ键的数目为________。
(2)关于配合物[Zn(NH3)4]Cl2的说法正确的是________。
A.配位数为6 B.配体为NH3和Cl-
C.[Zn(NH3)4]2+为内界 D.Zn2+和NH3以离子键结合
[解析] (1)[Zn(NH3)4]Cl2中[Zn(NH3)4]2+与Cl-形成离子键,
而1个[Zn(NH3)4]2+中含有4个N→Zn键(配位键)和12个N—H键,共16个σ键
16NA
C
4
配位键
第三章 晶体结构与性质
第四节 配合物与超分子
第1课时 配合物
【课程目标】
1、通过熟悉的无水硫酸铜与其溶液颜色不同这一现象,认识配位键的特征,并能与共价键进行简单比较。
2、在配位键的基础上,认识配合物的存在、结构特点及常见配合物的制取等。
CuSO4·5H2O晶体
无水硫酸铜
一、配合物:
Why?
情景引入
无水CuSO4是白色的,为什么CuSO4·5H2O晶体却是蓝色的?
一、配合物:
P95
②CuCl2 2H2O:绿色
CuCl2:棕(黄)色
说明:
一、配合物:
天蓝色
无色
CuSO4溶液、CuCl2溶液、CuBr2溶液
Cu2+呈天蓝色;
SO42-、Cl—、Br—、Na+、K+没有颜色
一、配合物:
P95
②CuCl2 2H2O:绿色
CuCl2:棕(黄)色
说明:
CuSO4溶液 CuCl2溶液 CuBr2溶液
蓝色 蓝色 蓝色
观察下列固体物质的颜色,你能得出什么结论?
CuSO4晶体 CuCl2晶体 CuBr2晶体
白色 棕(黄)色 深褐色
【观察思考1】
固态Cu2+盐不一定显蓝色
结论修正:Cu2+在水溶液中常显蓝色
结论:
CuSO4·5H2O晶体 CuCl2·2H2O晶体
蓝色 绿色
【观察思考2】
观察下列晶体的颜色,你能得出什么结论?
CuSO4·5H2O晶体也显蓝色
理论解释:
Cu2+与水结合显蓝色
实验证明,硫酸铜晶体和 Cu2+的水溶液呈蓝色,实际上是Cu2+和H2O形成的[Cu(H2O)4]2+呈蓝色。[Cu(H2O)4]2+叫做四水合铜离子。
思考:Cu2+与H2O是如何结合的呢?
一、配合物:
Cu2+的价层电子构型
[Cu(H2O)4]2+的形成
激发
杂化
H2O
H2O
H2O
H2O
[Cu(H2O)4]2+平面正方形
配位键
3d9, 4s和4p轨道是空的。
孤电子对
1、配位键:
⑴概念:
⑵条件:中心原子(离子)提供空轨道,配体提供孤电子对
一、配合物:
成键原子或离子一方提供空轨道,另一方提供孤电子对而形成的,这类“电子对给予-接受”键被称为配位键。
形成条件
一方能提供孤电子对
另一方能提供空轨道
如分子有NH3、H2O、HF、CO等;
离子有Cl-、OH-、CN-、SCN-等。
如H+、Al3+、B及过渡金属的原子或离子Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等。
⑶特点:
⑷表示方法:
1、配位键:
一、配合物:
一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
或
(A提供孤电子对) A→B (B提供空轨道) 或 A—B
配位键是一种特殊的共价键,具有方向性和饱和性。
练习1:写出NH4+和H3O+的配位键的表示法?
(1)相同原子间形成的配位键与它们之间形成的共价单键相同,如
故其结构式也可表示为
NH4+的空间结构是正四面体形
(2)配位键一般是共价单键,属于σ键。
说明
中的4个N-H(键能、键长和键角)完全相同,
(1)中心原子(离子):提供空轨道的金属离子或原子。一般是过渡金属,必须有空轨道。
(2)配位体:含有孤电子对的分子或离子,如 NH3 H2O CO Cl- SCN- CN-
(3)配位原子:配位体中具有孤电子对的原子N O P S,一般是ⅤA Ⅵ A ⅦA的非金属原子
(4)配位数:直接同中心原子配位的分子或原子数目,一般是2、4、6、8
(5)配离子的电荷:等于中心离子和配体总电荷的代数和,如[Fe(SCN)6]3-
一、配合物:
2、配位化合物:
1).概念:把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以 配位键 结合形成的化合物称为配位化合物,
简称配合物。
一、配合物:
P96
配位化合物一定含有配位键,
但含有配位键的化合物不一定是配位化合物。
例如:CO、NH4+、H3O+、、P2O5
如氢氧化二氨合银{[Ag(NH3)2]OH}、硫酸四氨合铜[Cu(NH3)4]SO4}等
= [Cu(H2O)4]2+
2、配位化合物:
2).组成:
配合物由内界和外界构成,配合单元是内界,
内界由中心离子(原子)和配体构成。外界是带异号电荷的离子。
内界与外界以离子键结合,
在水中完全电离,内界较稳定。
一、配合物:
P96
内界
外界
中心离子
配体
配位数
+ SO42-
配
位
原
子
配位原子:配体中给出孤电子对与中心形成配位键的原子。
如H2O中O,CO中的C,NH3中的N 。
内界微粒很难电离(电离程度很小),因此,配合物[Co(NH3)5C1]Cl2内界中的C1—不能被Ag+沉淀,只有外界的C1—才能与AgNO3溶液反应产生沉淀。
配合物在水溶液中电离成内界和外界两部分,
如 [Co(NH3)5Cl]Cl2 = [Co(NH3)5C1]2+ + 2C1—,
注意:
配合物 内界 外界 中心粒子 配位体 配位数
[Ag(NH3)2]OH 氢氧化二氨合银
K3[Fe(CN)6]
[Co(NH3)5Cl]Cl2
Ni(CO)4
请根据给出的配合物完成下表
[Ag(NH3)2]+
OH-
Ag+
NH3
2
【思考与讨论】
[Fe(CN)6]3-
K+
Fe3+
CN-
6
[Co(NH3)5Cl]2+
Cl-
Co3+
NH3、Cl-
6
4
无
Ni
CO
Ni(CO)4
六氰合铁酸钾
四羰基镍
配合物结构小结:
2、中心粒子可以是阳离子,也可以是中性原子;
3、配位体可以是离子或分子,可以有一种或同时存在多种;
4、配位数通常为2、4、6、8这样的偶数。
1.有些配合物没有外界;如 Ni(CO)4 、Fe(CO)5
1.下列不属于配位化合物的是( )
六氟合铝(Ⅲ)酸钠:
氢氧化二氨合银(Ⅰ):
C.六氟合铁(Ⅲ)酸钾:
D.十二水硫酸铝钾:
E. 六氰合铁(Ⅱ)酸钾: K4[Fe(CN)6]
F. 光卤石:KCl·MgCl ·6H O
D F
跟踪练习
2、0.01 mol氯化铬(CrCl3·6H2O)在水溶液中用过量硝酸银溶液处理,
产生0.02 mol AgCl沉淀。此氯化铬最可能是( )
A.[Cr(H2O)6]Cl3
B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl2]Cl·2H2O
D.[Cr(H2O)3Cl3]·3H2O
跟踪练习
B
3. 可写成 ,其结构如图, 下列说法正确的是( )
A.在上述结构中,所有氧原子都采用 sp2 杂化
B.在上述结构中,存在配位键、共价键,不存在离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的两种结晶水在不同的温度下会分步失去
D
跟踪练习
4. 配合物Na2[Fe(CN)5(NO)]可用于离子检验,下列说法不正确的是( )。
A.配离子为[Fe(CN)5(NO)]2-,中心离子为Fe3+,配位数为6,配位原子有C和N
B.该配合物为离子化合物,易电离,1mol该配合物电离共得到的离子数目为3NA
C.1 mol该配合物中σ键的数目为12NA
D.此配合物中存在离子键、配位键、极性键、非极性键
D
跟踪练习
3、常见的配合物及其制取
(1)[Cu(H2O)4]2+
一、配合物:
已知配合物的品种超过数百万种,是一个庞大的化合物家族。
(2)[Cu(NH3)4](OH)2
P96
3、常见的配合物及其制取
一、配合物:
加氨水
继续加氨水
加乙醇
静置
蓝色溶液
蓝色沉淀
沉淀溶解,得深蓝色溶液
得深蓝色晶体
实验3-3 制取 [Cu(NH3)4](OH)2
反应①:
①
②
③
反应②:
[Cu(NH3)4]2+ + SO42- + H2O = [Cu(NH3)4]SO4·H2O↓
乙醇
深蓝色晶体
该晶体在乙醇中的溶解度较小
硫酸四氨合铜晶体
Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH4+
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
深蓝色溶液
反应③:
实验证明,无论在得到的深蓝色透明溶液中,还是在析出的深蓝色晶体中,深蓝色都是由于存在[Cu(NH3)4]2+,中心离子是Cu2+,而配体是NH3,配位数为4。
深蓝色
平面正方形
实验3-3 制取 [Cu(NH3)4](OH)2
四氨合铜离子
思考:
与
的稳定性?
比较
NaOH
Cu(OH)2
氨水
NaOH
不反应
更稳定,配位键更强
回想一下,如何检验Fe3+?
必修一
思考:Fe3+与SCN-如何反应?
Fe3+ + 3SCN- Fe(SCN)3
(3) K3Fe(SCN)6
P97
3、常见的配合物及其制取
一、配合物:
六氰合铁酸钾
硫氰化钾(KSCN)溶液
溶液变为血红色
FeCl3溶液棕黄色
Fe3+ + n SCN- [Fe(SCN)n]3-n
n = 1∽6,随SCN-的浓度而异
实验原理
Fe3+ + SCN- Fe(SCN)2+
Fe(SCN)2+ + SCN- Fe(SCN)2+
Fe(SCN)52- + SCN- Fe(SCN)63-
…………
应用:检验或鉴定Fe3+,用于电影特技和魔术表演
(4)[Ag(NH3)2]Cl
P97
3、常见的配合物及其制取
一、配合物:
加NaCl溶液
逐滴加氨水
AgNO3溶液
AgCl沉淀
沉淀消失,得澄清的无色溶液
Ag++Cl-=AgCl↓
AgCl+2NH3=[Ag(NH3)2]Cl
二氨合银离子
实验3-5 制取[Ag(NH3)2]Cl
1.怎样配制银氨溶液?发生哪些反应?
思考与讨论:
向AgNO3溶液中逐滴加稀氨水,直到最初生成的沉淀恰好溶解为止。
氨水呈弱碱性,滴入AgNO3溶液中,会形成AgOH白色沉淀,
AgOH+2NH3·H2O = [Ag(NH3)2]+ + OH- + 2H2O
继续滴加氨水时,NH3分子与Ag+形成[Ag(NH3)2]+配合离子,配合离子很稳定,会使AgOH逐渐溶解。
Ag+ + NH3·H2O = AgOH↓ + NH4+
2. 配合物[Cu(NH3)4]SO4中含有的化学键类型有哪些
3. 分析NH3和BF3可以形成配位键吗?
有离子键、共价键、配位键。
可以形成NH3·BF3
思考与讨论:
4.解决问题
0.1mol/L CuCl2溶液
2mol/L CuCl2溶液
蓝色
蓝绿色
溶液浓度变化为什么会导致色调变化?
一、配合物:
Cu2+ Cl- 颜色
①0.1 mol/L CuCl2溶液 稀 稀 蓝
②2 mol/L CuCl2溶液 浓 浓 蓝绿
③
④
哪个因素导致浓CuCl2溶液变蓝绿色?
4.解决问题
一、配合物:
能设计实验来证明吗?
Cu2+ Cl- 颜色
①0.1 mol/L CuCl2溶液 稀 稀 蓝
②2 mol/L CuCl2溶液 浓 浓 蓝绿
③0.1 mol/L CuCl2溶液 +饱和CuSO4溶液
④0.1 mol/L CuCl2溶液 +6 mol/L NaCl溶液
4.解决问题
一、配合物:
哪个因素导致浓CuCl2溶液变蓝绿色?
浓
稀
蓝
对比
对比①和③,说明 .
增大Cu2+的浓度不会导致溶液颜色变为蓝绿色。
Cu2+ Cl- 颜色
①0.1 mol/L CuCl2溶液 稀 稀 蓝
②2 mol/L CuCl2溶液 浓 浓 蓝绿
③0.1 mol/L CuCl2溶液 +饱和CuSO4溶液
④0.1 mol/L CuCl2溶液 +6 mol/L NaCl溶液
4.解决问题
一、配合物:
哪个因素导致浓CuCl2溶液变蓝绿色?
浓
浓
稀
稀
蓝
蓝绿
对比
对比①和④,说明 。
在含有Cu2+的溶液中,增大Cl-的浓度会使溶液变为蓝绿色。
综合对上述实验的分析,Cl-的浓度较高是CuCl2的浓溶液不呈纯蓝色而呈蓝绿色的原因。
① Cu2+与Cl-可以形成一系列配合物,在水溶液中,作为配体的Cl-可以多至4个。在Cl-的浓度极高时,形成的CuCl42-呈黄色。
4.解决问题
一、配合物:
② 颜色叠加:蓝 + 黄 = 绿。
查阅资料:
Cu
Cl
Cl
Cl
Cl
2-
四氯合铜酸根
配体:Cl-
中心离子:Cu2+
配位数:4
CuCl 也是配离子 含配阴离子的化合物
4
2-
4.解决问题
一、配合物:
c(CuCl2) 0.1mol/L 0.1mol/L 0.1mol/L 0.1mol/L
c(NaCl) 0 mol/L 2 mol/L 6 mol/L 饱和
颜色
含0.1 mol/L Cu2+的溶液中,Cl-的浓度越高,
配位的Cl-越多,颜色越偏绿色,直至黄绿色
4.解决问题
一、配合物:
5、配合物的形成对性质的影响
(1)对溶解性的影响
一些难溶于水的金属氢氧化物、卤化物、氰化物,可以溶解于氨水中,或依次溶解于含过量的OH—、Cl—、Br—、I—、CN—的溶液中,形成可溶性的配合物。
一、配合物:
如:Cu(OH)2 + 4NH3 =[Cu(NH3)4]2+ + 2OH—
Al(OH)3 + NaOH = Na[Al(OH)4]
四羟基合铝酸钠
AgCl + 2NH3·H2O = Ag(NH3)2Cl + 2H2O
CuCl难溶于水,可溶于浓盐酸和氨水
5、配合物的形成对性质的影响
(2)颜色的改变
当简单离子形成配离子时,颜色会发生变化,据此可以判断是否有配离子生成。
一、配合物:
如Fe3+与SCN-形成硫氰化铁配离子,其溶液显红色。
5、配合物的形成对性质的影响
一、配合物:
(3)稳定性增强
当中心原子(离子)相同时,配合物的稳定性与配体的性质有关。
配合物具有一定的稳定性,配位键越强,配合物越稳定。
例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO中毒。
在人和动物体内起输送氧气作用的血红素,是Fe的配合物。
配合物在生产和科学技术方面的应用也很广泛.
例如,在医药科学、化学催化剂、新型分子材料等领域都有着广泛的应用。
6.配合物的应用
一、配合物:
6.配合物的应用
①在生命体中的应用
②在医药中的应用
叶绿素
血红素
抗癌药物
酶
维生素B12
钴配合物
含锌的配合物
含锌酶有80多种
Fe2+的配合物
Mg2+的配合物
③配合物与生物固氮
固氮酶
④在生产生活中的应用
王水溶金
电解氧化铝的助熔剂 Na3[AlF6]
热水瓶胆镀银 [Ag(NH3)2]+
H[AuCl4]
一、配合物:
拓展视野
在配位化学及其应用领域做出重要贡献的我国著名化学家
→唐敖庆教授是我国现代理论化学的开拓者和奠基人。他从20世纪 60 年代起系统地开展配位场理论的研究;70年代,进行了配合化学模拟生物固氮作用的研究,开展了分子氮配位作用的化学键理论研究,其"配位场理论方法"获 1982 年国家自然科学奖一等奖。
→徐光宪教授长期从事物理化学和无机化学的教学及研究,涉及量子化学、化学键理论、配位化学、萃取化学、核燃料化学和稀土科学等领域。基于对稀土化学键、配位化学和物质结构等基本规律的深刻认识,他发现了稀土溶剂萃取体系具有"恒定混合萃取比"基本规律。20世纪 70年代,│他建立了具有普适性的串级萃取理论,极大提升了利用配合│物萃取分离稀土元素的效率,为我国稀土工业的发展做出了突出贡献,获得 2008 年度"国家最高科学技术奖"。
1.若X、Y两种粒子之间可形成配位键,则下列说法正确的是( )
A.X、Y只能是分子
B.X、Y只能是离子
C.若X提供空轨道,则Y至少要提供一对孤电子对
D.若X提供空轨道,则配位键表示为X→Y
C
【课堂练习】
2.下列粒子中含配位键的是( )
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)3
⑥Fe(SCN)3 ⑦H3O+ ⑧Ag(NH3)2OH
A.①②④⑦⑧ B.③④⑤⑥⑦
C.①④⑤⑥⑦⑧ D.全部
C
【课堂练习】
3.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象的说法正确的是( )
A.沉淀溶解后,生成深蓝色的配合离子[Cu(NH3)4]2+
B.[Cu(H2O)4]2+比[Cu(NH3)4]2+中的配位键稳定
C.用硝酸铜溶液代替硫酸铜溶液进行实验,不能观察到同样的现象
D.在[Cu(NH3)4]2+中,Cu2+给出孤电子对,NH3提供空轨道
A
【课堂练习】
4.下列物质中,不能作为配合物的配体的是( )。
A.NH3 B.NH4 C.H2O D.SCN-
+
【课堂练习】
H:N:H
H
:
:
H:O:H
:
:
:S::C::N:
:
:
-
H:N:H
H
:
:
H
+
B
Cu(NH3)4
2+
Cu(H2O)4
2+
Fe(SCN)2+
实例:
[Co(NH3)4Cl2]+ Cl-
[Co(NH3)4Cl2]+ NO3
5.能区别[Co(NH3)4Cl2]Cl和[Co(NH3)4Cl2]NO3两种溶液的试剂是( )
A.AgNO3溶液 B.NaOH溶液 C.CCl4 D.浓氨水
-
【课堂练习】
A
产生白色沉淀
6.硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4的中心离子是_____, 配体是____,配位数是____。
Ni2+
6
NH3
[Ni(NH3)6]2+ SO4
Ni2+ 6NH3
2-
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为 ,提供孤电子对的成键原子是 。
配位键
N
H-N-H
H
-
:
【课堂练习】
7.指出下列各配合物中的配离子、中心离子、配位体、配位原子和配位数。
① K3[Fe(CN)6] ②(NH4)2[PtCl6] ③[Cd(NH3)4](OH)2
【课堂练习】
① K3[Fe(CN)6] === 3K+ + [Fe(CN)6]3-
配离子 中心离子 配位体 配位原子 配位数
[Fe(CN)6]3-
Fe3+
CN-
6
C
:C N:
-
:
:
:
:
7.指出下列各配合物中的配离子、中心离子、配位体、配位原子和配位数。
① K3[Fe(CN)6] ②(NH4)2[PtCl6] ③[Cd(NH3)4](OH)2
【课堂练习】
配离子 中心离子 配位体 配位原子 配位数
[PtCl6]2-
6
Cl
② (NH4)2[PtCl6] === 2NH4 + [PtCl6]2-
+
Pt4+
Cl-
7.指出下列各配合物中的配离子、中心离子、配位体、配位原子和配位数。
① K3[Fe(CN)6] ②(NH4)2[PtCl6] ③[Cd(NH3)4](OH)2
【课堂练习】
配离子 中心离子 配位体 配位原子 配位数
[Cd(NH3)4]2+
4
N
③[Cd(NH3)4](OH)2 === [Cd(NH3)4]2+ + 2OH-
Cd2+
NH3
8.取CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)各1 mol,分别溶于水,加入足量AgNO3溶液,立即产生AgCl沉淀的物质的量分别为3 mol、2 mol。请根据实验事实用配合物的形式写出它们的化学式。
[Co(NH3)6]Cl3
[Co(NH3)5Cl]Cl2
9.回答下列问题:
(1)配合物[Ag(NH3)2]OH的中心离子是____,配位原子是___,配位数是_____,它的电离方程式是 。
(2)向盛有少量NaCl溶液的试管中滴入少量AgNO3溶液,再加入氨水,观察到的现象是 。
Ag+
N
2
[Ag(NH3)2]OH==[Ag(NH3)2]++OH-
先产生白色沉淀,加入氨水后,白色沉淀溶解
10.(1)Zn的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,1 mol该配合物中含有σ键的数目为________。
(2)关于配合物[Zn(NH3)4]Cl2的说法正确的是________。
A.配位数为6 B.配体为NH3和Cl-
C.[Zn(NH3)4]2+为内界 D.Zn2+和NH3以离子键结合
[解析] (1)[Zn(NH3)4]Cl2中[Zn(NH3)4]2+与Cl-形成离子键,
而1个[Zn(NH3)4]2+中含有4个N→Zn键(配位键)和12个N—H键,共16个σ键
16NA
C
4
配位键
