化学人教版(2019)选择性必修1第1章化学反应的热效应单元复习(共39张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1第1章化学反应的热效应单元复习(共39张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-12 12:49:49 | ||
图片预览






文档简介
(共39张PPT)
高二—人教版—化学—选择性必修1—第一章
化学反应的热效应
单元复习
学习目标
1.能从体系和环境、体系内能变化、化学键断裂和形成时的能量变化等不同角度定性认识反应热。
2.能从物质变化和能量变化的角度书写热化学方程式。
3.能根据热化学方程式、盖斯定律、化学键等定量计算反应热。
4.能从宏观、微观和符号三个角度认识反应热。
情景导入:化学反应热效应在生活、生产中的应用
2C2H2(g)+ 5 O2(g)=4CO2(g)+2H2O(l)△H=-2733.6kJ/mol
【问题】能哪些视角分析该热化学方程式?
1. 物质变化视角
2. 能量变化视角
2C2H2(g)+ 5 O2(g)=4CO2(g)+2H2O(l)△H=-2733.6kJ/mol
【问题】能哪些视角分析该热化学方程式?
1. 物质变化视角
2. 能量变化视角
宏观角度:体系释放能量到环境中。
微观角度:断键吸收的总能量小于
成键释放的总能量。
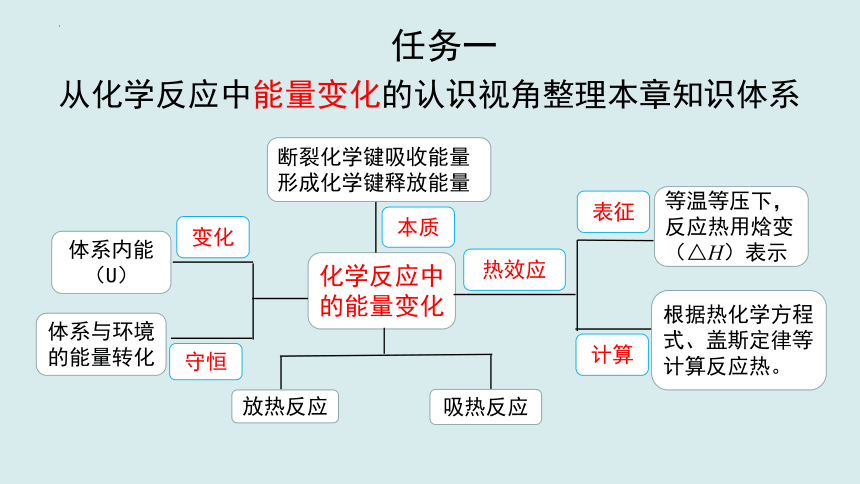
任务一
从化学反应中能量变化的认识视角整理本章知识体系
化学反应中的能量变化
热效应
变化
守恒
体系内能
(U)
体系与环境的能量转化
表征
计算
等温等压下,反应热用焓变(△H)表示
根据热化学方程式、盖斯定律等计算反应热。
放热反应
吸热反应
本质
断裂化学键吸收能量
形成化学键释放能量
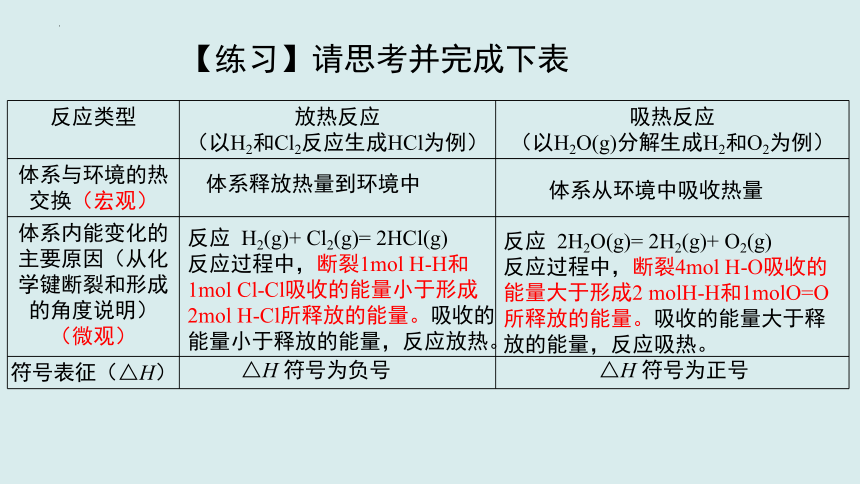
【练习】请思考并完成下表
反应类型 放热反应 (以H2和Cl2反应生成HCl为例) 吸热反应
(以H2O(g)分解生成H2和O2为例)
体系与环境的热交换(宏观)
体系内能变化的主要原因(从化学键断裂和形成的角度说明) (微观)
符号表征(△H)
体系释放热量到环境中
反应 H2(g)+ Cl2(g)= 2HCl(g)
反应过程中,断裂1mol H-H和1mol Cl-Cl吸收的能量小于形成2mol H-Cl所释放的能量。吸收的能量小于释放的能量,反应放热。
△H 符号为负号
体系从环境中吸收热量
反应 2H2O(g)= 2H2(g)+ O2(g)
反应过程中,断裂4mol H-O吸收的能量大于形成2 molH-H和1molO=O所释放的能量。吸收的能量大于释放的能量,反应吸热。
△H 符号为正号
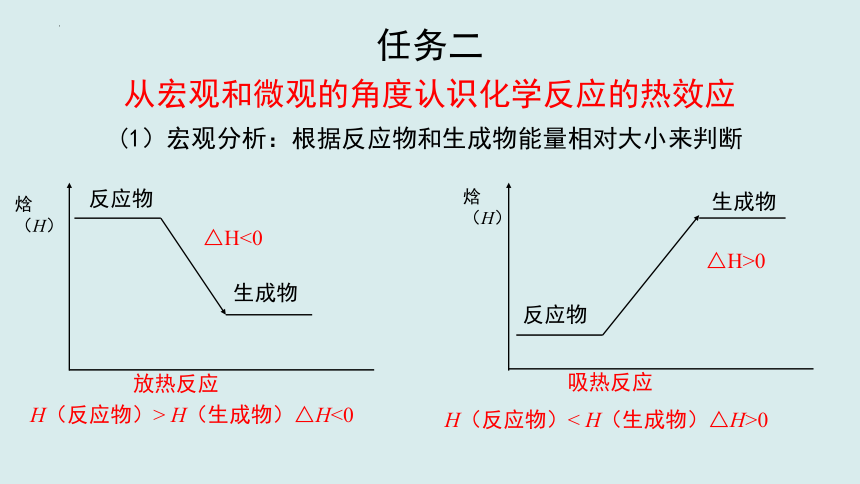
反应物
生成物
放热反应
焓(H)
△H<0
焓(H)
反应物
生成物
△H>0
吸热反应
(1)宏观分析:根据反应物和生成物能量相对大小来判断
H(反应物)> H(生成物)△H<0
H(反应物)< H(生成物)△H>0
任务二
从宏观和微观的角度认识化学反应的热效应
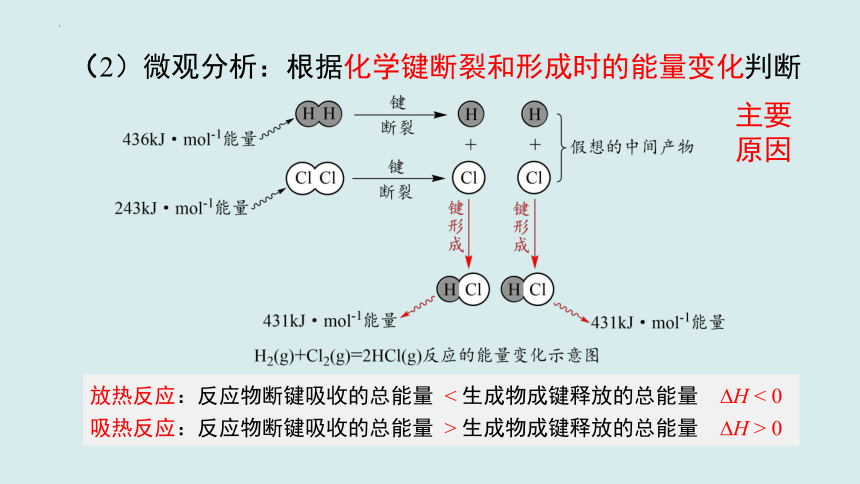
(2)微观分析:根据化学键断裂和形成时的能量变化判断
主要原因
放热反应:反应物断键吸收的总能量 < 生成物成键释放的总能量 H < 0
吸热反应:反应物断键吸收的总能量 > 生成物成键释放的总能量 H > 0
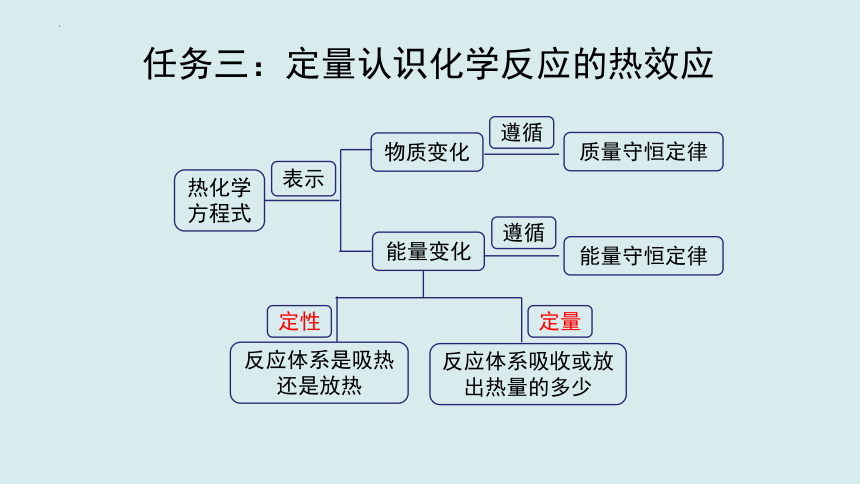
任务三:定量认识化学反应的热效应
热化学
方程式
表示
物质变化
能量变化
遵循
遵循
质量守恒定律
能量守恒定律
定性
定量
反应体系是吸热还是放热
反应体系吸收或放出热量的多少
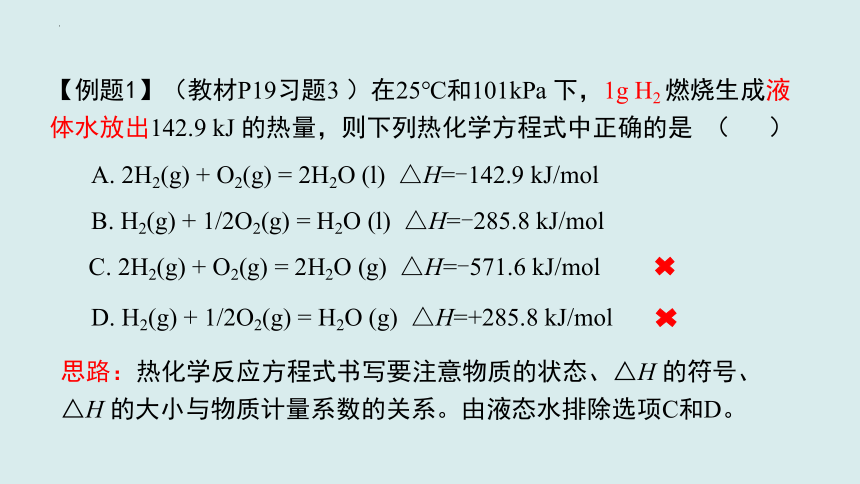
【例题1】(教材P19习题3 )在25℃和101kPa 下,1g H2 燃烧生成液体水放出142.9 kJ 的热量,则下列热化学方程式中正确的是 ( )
A. 2H2(g) + O2(g) = 2H2O (l) △H=-142.9 kJ/mol
B. H2(g) + 1/2O2(g) = H2O (l) △H=-285.8 kJ/mol
C. 2H2(g) + O2(g) = 2H2O (g) △H=-571.6 kJ/mol
D. H2(g) + 1/2O2(g) = H2O (g) △H=+285.8 kJ/mol
思路:热化学反应方程式书写要注意物质的状态、△H 的符号、△H 的大小与物质计量系数的关系。由液态水排除选项C和D。
【解析】
A和B选项就是△H 的大小不同。题目给了H2的质量,我们要求出
H2 的质量与化学计量系数之间的关系,从而求出△H 的值。
由n=m/M可得,1g H2 的物质的量为n=1g/2(g/mol)=0.5mol,即0.5mol H2 燃烧释放142.9 kJ的热量,即1mol H2燃烧释放142.9kJ×2=285.8 kJ的热量,则选 B
【例题1】在25℃和101 kPa下,1gH2 燃烧生成液体水放出142.9 kJ
的热量,则下列热化学方程式中书写正确的是 ( )
A. 2H2(g) + O2(g) = 2H2O (l) △H=-142.9 kJ/mol
B. H2(g) + 1/2O2(g) = H2O (l) △H=-285.8 kJ/mol
B
任务四:求算化学反应的反应热
1.由盖斯定律求算反应热
ΔH=ΔH1+ΔH2
如何利用盖斯定律求化学反应的热效应
物质变化
能量变化
根据目标方程式
找出已知方程式
确定中间产物
模型应用
调整已知方程式的方向和计量数消去中间产物
将调整好的
△H 加和
【例2】 (教材P20习题9 )2008年北京奥运会“祥云”火炬的燃料是丙烷(C3H8),1996年亚特兰大奥运会火炬的燃料是丙烯(C3H6)。丙烷脱氢可得到丙烯。
已知:
① C3H8(g) = CH4 (g) + C2H2 (g) +H2 (g) ΔH1= +255.7 kJ/mol
② C3H6(g) = CH4 (g) + C2H2 (g) ΔH2= +131.5 kJ/mol
计算 ③ C3H8(g) = C3H6(g) + H2 (g) 的ΔH。
解题思维模型
找出求算量
找出关联点
找出已知量
利用盖斯定律间接求算反应热的步骤
根据目标方程式找出已知方程式
调整已知方程式的方向和计量数
将调整好的△H加和
运用模型
找出求算量
计算③ C3H8(g) = C3H6(g) + H2 (g) 的ΔH。
找出已知量
① C3H8(g) = CH4 (g) + C2H2 (g) +H2 (g) ΔH1= +255.7 kJ/mol
② C3H6(g) = CH4 (g) + C2H2 (g) ΔH2= +131.5 kJ/mol
找出关联点
可知:反应③= 反应①- 反应②
ΔH = ΔH1 - ΔH2
ΔH = ΔH1 - ΔH2= +255.7 kJ/mol -( +131.5 kJ/mol )= +124.2 kJ/mol
C3H8(g)
CH4 (g) + C2H2 (g) +H2 (g)
C3H6(g) + H2 (g)
ΔH
ΔH1
ΔH2
2. 利用键能计算反应热
H=∑E (反应物断键吸收的总能量)-∑E (生成物成键放出的总能量)
【例3】(教材P19习题2) 已知:N2(g) + 3H2(g) =2NH3(g) △H=-92.4 kJ/mol。若断裂1 mol H-H、 1 mol N-H 需要吸收的能量分别为436kJ、391kJ,则断裂 1 mol N≡N 需要吸收的能量为( )
A. 431kJ B. 945.6kJ C. 649kJ D. 869kJ
运用模型
找出求算量
求断裂 1 mol N≡N需要吸收的能量
找出已知量
N2(g) + 3H2(g) =2NH3(g) △H=-92.4 kJ/mol。
断裂1 mol H-H、 1 mol N-H需要吸收的能量分别为436kJ、391kJ
找出关联点
H=∑E (反应物断键吸收的总能量)-∑E (生成物成键放出的总能量)
H= E( N≡N )+ 3× E(H-H)- 2×3×E(N-H)
-92.4 kJ/mol = E( N≡N )+ 3× 436 kJ/mol - 6×391 kJ/mol;
求得 : E( N≡N )= 945.6 kJ/mol
A. 431 kJ B. 945.6 kJ C. 649 kJ D. 869 kJ
解析:本题要求断裂1 mol N≡N所需的能量,由 H=∑E (反应物断键吸收的总能量)-∑E (生成物成键放出的总能量)可把化学键与已知的反应热关联,得: H= E( N≡N )+ 3× E(H-H)- 2×3×E(N-H)
即 -92.4 kJ/mol = E( N≡N )+ 3× 436 kJ/mol - 6×391 kJ/mol;
得: E( N≡N )= 945.6 kJ/mol
答案 选 B
B
【例3】(教材P19习题2) 已知:N2(g) + 3H2(g) =2NH3(g) △H=-92.4 kJ/mol。若断裂1 mol H-H、 1 mol N-H需要吸收的能量分别为436kJ、391kJ,则断裂 1 mol N≡N需要吸收的能量为( )
1.结合本章所学内容,回答为什么选用天然气作为燃料?
任务五:知识迁移运用
【例4】已知下列反应,请问为什么选用天然气作为燃料?
物质变化
能量变化
CH4(g) + 2O2(g) =CO2 (g) + 2H2O (l) △H=-890.3 kJ/mol
H2(g) + 1/2O2(g) = H2O (l) △H=-285.8 kJ/mol
C (s) + O2(g) =CO2 (g) △H=-393.5 kJ/mol
C (s) + 1/2O2(g) =CO (g) △H=-110.5 kJ/mol
选择燃料要考虑哪些因素?
H2的来源少,但CH4的储量丰富,来源多、价格便宜且热值大。所以选用天然气作为燃料。
(环保廉价)
(热值大)
【例5】(教材P19习题6 )已知:
① H2O(g)= H2(g)+ 1/2O2(g) △H= +241.8 kJ/mol
② C (s) + 1/2O2(g) =CO (g) △H= -110.5 kJ/mol
③ C (s) + O2(g) =CO2 (g) △H= -393.5 kJ/mol
请填写下列空白。
(1)上述反应中属于吸热反应的是————————(填序号)
(2)表示C燃烧热的热化学方程式的是————— (填序号)
(3)10gH2完全燃烧生成水蒸气,放出的热量为—————
(4)写出CO燃烧的热化学方程式:——————————————。
解题思维模型
找出求算量
找出关联点
找出已知量
请填写下列空白。
(1)上述反应中属于吸热反应的是————————(填序号)
关联点是什么?
①
根据△H 符号可知,反应①中△H 为正号,为吸热反应;
其他反应△H 都为负号,为放热反应。答案选择①。
【例5】(教材P19习题6 )已知:
① H2O(g)= H2(g)+ 1/2O2(g) △H1= +241.8 kJ/mol
② C (s) + 1/2O2(g) =CO (g) △H2= -110.5 kJ/mol
③ C (s) + O2(g) =CO2 (g) △H3= -393.5 kJ/mol
请填写下列空白。
(2)表示C燃烧热的热化学方程式的是————— (填序号)
根据燃烧热的定义:在101KPa时,1mol纯物质完全燃烧生成指定产物时所释放的热量,叫做该物质的燃烧热。而C元素完全燃烧生成的指定物质是CO2(g),所以答案选反应③
③
【例5】(教材P19习题6 )已知:
① H2O(g)= H2(g)+ 1/2O2(g) △H1= +241.8 kJ/mol
② C (s) + 1/2O2(g) =CO (g) △H2= -110.5 kJ/mol
③ C (s) + O2(g) =CO2 (g) △H3= -393.5 kJ/mol
关联点是什么?
请填写下列空白。
(3)10g H2完全燃烧生成水蒸气,放出的热量为——
【例5】(教材P19习题6 )已知:
① H2O(g)= H2(g)+ 1/2O2(g) △H= +241.8 kJ/mol
② C (s) + 1/2O2(g) =CO (g) △H= -110.5 kJ/mol
③ C (s) + O2(g) =CO2 (g) △H= -393.5 kJ/mol
运用模型
找出求算量
反应放出的热量
找出已知量
10g H2完全燃烧
找出关联点
1)△H 大小与计量数成正比
2)n=m/M
由思维模型分析可得:
由n=m/M可得,10g H2 的物质的量为 n=10g÷2(g/mol)=5mol,由反应① H2O(g)= H2(g)+ 1/2O2(g) △H1= +241.8 kJ/mol
可得:反应 H2(g)+ 1/2O2(g) = H2O(g) △H= -241.8 kJ/mol
即:1mol H2燃烧释放241.8 kJ的热量,
则:5mol H2燃烧释放241.8kJ/mol ×5mol=1209 kJ 的热量,
则:答案为1209 kJ
(3)10gH2完全燃烧生成水蒸气,放出的热量为—————
1209 kJ
H2(g)+ 1/2O2(g) = H2O(g)
△H=?
请填写下列空白。
(4) 写出CO燃烧的热化学方程式:—————————。
【例5】(教材P19习题6 )已知:
① H2O(g)= H2(g)+ 1/2O2(g) △H1= +241.8 kJ/mol
② C (s) + 1/2O2(g) =CO (g) △H2= -110.5 kJ/mol
③ C (s) + O2(g) =CO2 (g) △H3= -393.5 kJ/mol
热化学方程式的书写思维模型:
写化学反应方程式
标状态
标条件
标 H
写出配平的
化学反应方程式
标明各物质的状态
(s、l、g、aq)
注明反应时的温度和压强
(不注明指25℃和101kPa )
注意吸热用“+”,
放热用“-”,
根据化学计量数计算
H的值,单位 kJ/mol
如何表示物质变化的过程?
能量的变化和哪些条件有关呢?
物质的状态、温度、压强、化学计量数等
表
示
物
质
和
能
量
变
化
的
过
程
利用盖斯定律间接求算反应热的步骤
根据目标方程式找出已知方程式
调整已知方程式的方向和计量数
将调整好的△H加和
解析:① 写出CO燃烧的热化学反应方程式:
CO(g)+ O2(g)= CO2(g) △H=
C (s) + O2(g)
CO2 (g)
CO(g)+ O2(g)
△H2
△H3
△H
△H3-△H2
=- 393.5 kJ/mol –
(-110.5 kJ/mol)
=-283 kJ/mol
【例5】(教材P19习题6 )已知:
① H2O(g)= H2(g)+ 1/2O2(g) △H1= +241.8 kJ/mol
② C (s) + 1/2O2(g) =CO (g) △H2= -110.5 kJ/mol
③ C (s) + O2(g) =CO2 (g) △H3= -393.5 kJ/mol
请填写下列空白。
(1)上述反应中属于吸热反应的是———————(填序号)
(2)表示C燃烧热的热化学方程式的是————(填序号)
(3)10gH2完全燃烧生成水蒸气,放出的热量为—————
(4)写出CO燃烧的热化学反应方程式:
①
③
1209 kJ
CO(g)+ O2(g)= CO2(g) △H= -283 kJ/mol
【例6】已知 H2(g)、C2H4(g)和 C2H5OH(l)的燃烧热分别是
-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g) 和 H2O(l) 反应生成 C2H5OH(l) 的△H为( ) A.-44.2 kJ·mol-1 B.+44.2 kJ·mol-1
C.-330 kJ·mol-1 D.+330 kJ·mol-1
由题干条件可知如下反应:
① H2(g)+1/2 O2(g) = H2O(l);ΔH1=-285.8 kJ·mol-1
② C2H4(g)+3O2(g) = 2CO2(g)+2H2O(l);ΔH2= -1411.0 kJ·mol-1
③ C2H5OH(l)+3O2(g) = 2CO2(g)+3H2O(l);ΔH3= -1366.8 kJ·mol-1
利用盖斯定律间接求算反应热的步骤
根据目标方程式找出已知方程式
调整已知方程式的方向和计量数
将调整好的△H加和
解析:
1. 根据目标方程式:④ C2H4(g)+H2O(l) = C2H5OH(l) ΔH=
2. 找到已知方程式:
① H2(g)+1/2 O2(g) = H2O(l);ΔH1=-285.8 kJ·mol-1
② C2H4(g)+3O2(g) = 2CO2(g)+2H2O(l);ΔH2= -1411.0 kJ·mol-1
③ C2H5OH(l)+3O2(g) = 2CO2(g)+3H2O(l);ΔH3= -1366.8 kJ·mol-1
3. 调整已知方程式的方向和计量数:反应④=反应②- 反应③
可得:反应④ C2H4(g)+H2O(l) = C2H5OH(l) ΔH=
ΔH2-ΔH3
ΔH= -1411.0 kJ·mol-1-(-1366.8 kJ·mol-1)= -44.2 kJ·mol-1
【例6】已知 H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是
-285.8 kJ·mol-1、-1411.0 kJ·mol-1和-1366.8 kJ·mol-1,则由C2H4(g) 和 H2O(l) 反应生成 C2H5OH(l) 的△H为( ) A.-44.2 kJ·mol-1 B.+44.2 kJ·mol-1
C.-330 kJ·mol-1 D.+330 kJ·mol-1
B
由反应④=反应②- 反应③
内容小结
1.本节课学习了从体系和环境、体系内能变化、化学键断裂和形成时的能量变化等不同角度定性认识反应热。
2.本节课学习了从物质变化和能量变化的角度书写热化学方程式。
3.本节课学习了根据热化学方程式、盖斯定律、化学键等定量计算反应热。
4.本节课从宏观、微观和符号三个角度学习了反应热。
谢谢
高二—人教版—化学—选择性必修1—第一章
化学反应的热效应
单元复习
学习目标
1.能从体系和环境、体系内能变化、化学键断裂和形成时的能量变化等不同角度定性认识反应热。
2.能从物质变化和能量变化的角度书写热化学方程式。
3.能根据热化学方程式、盖斯定律、化学键等定量计算反应热。
4.能从宏观、微观和符号三个角度认识反应热。
情景导入:化学反应热效应在生活、生产中的应用
2C2H2(g)+ 5 O2(g)=4CO2(g)+2H2O(l)△H=-2733.6kJ/mol
【问题】能哪些视角分析该热化学方程式?
1. 物质变化视角
2. 能量变化视角
2C2H2(g)+ 5 O2(g)=4CO2(g)+2H2O(l)△H=-2733.6kJ/mol
【问题】能哪些视角分析该热化学方程式?
1. 物质变化视角
2. 能量变化视角
宏观角度:体系释放能量到环境中。
微观角度:断键吸收的总能量小于
成键释放的总能量。
任务一
从化学反应中能量变化的认识视角整理本章知识体系
化学反应中的能量变化
热效应
变化
守恒
体系内能
(U)
体系与环境的能量转化
表征
计算
等温等压下,反应热用焓变(△H)表示
根据热化学方程式、盖斯定律等计算反应热。
放热反应
吸热反应
本质
断裂化学键吸收能量
形成化学键释放能量
【练习】请思考并完成下表
反应类型 放热反应 (以H2和Cl2反应生成HCl为例) 吸热反应
(以H2O(g)分解生成H2和O2为例)
体系与环境的热交换(宏观)
体系内能变化的主要原因(从化学键断裂和形成的角度说明) (微观)
符号表征(△H)
体系释放热量到环境中
反应 H2(g)+ Cl2(g)= 2HCl(g)
反应过程中,断裂1mol H-H和1mol Cl-Cl吸收的能量小于形成2mol H-Cl所释放的能量。吸收的能量小于释放的能量,反应放热。
△H 符号为负号
体系从环境中吸收热量
反应 2H2O(g)= 2H2(g)+ O2(g)
反应过程中,断裂4mol H-O吸收的能量大于形成2 molH-H和1molO=O所释放的能量。吸收的能量大于释放的能量,反应吸热。
△H 符号为正号
反应物
生成物
放热反应
焓(H)
△H<0
焓(H)
反应物
生成物
△H>0
吸热反应
(1)宏观分析:根据反应物和生成物能量相对大小来判断
H(反应物)> H(生成物)△H<0
H(反应物)< H(生成物)△H>0
任务二
从宏观和微观的角度认识化学反应的热效应
(2)微观分析:根据化学键断裂和形成时的能量变化判断
主要原因
放热反应:反应物断键吸收的总能量 < 生成物成键释放的总能量 H < 0
吸热反应:反应物断键吸收的总能量 > 生成物成键释放的总能量 H > 0
任务三:定量认识化学反应的热效应
热化学
方程式
表示
物质变化
能量变化
遵循
遵循
质量守恒定律
能量守恒定律
定性
定量
反应体系是吸热还是放热
反应体系吸收或放出热量的多少
【例题1】(教材P19习题3 )在25℃和101kPa 下,1g H2 燃烧生成液体水放出142.9 kJ 的热量,则下列热化学方程式中正确的是 ( )
A. 2H2(g) + O2(g) = 2H2O (l) △H=-142.9 kJ/mol
B. H2(g) + 1/2O2(g) = H2O (l) △H=-285.8 kJ/mol
C. 2H2(g) + O2(g) = 2H2O (g) △H=-571.6 kJ/mol
D. H2(g) + 1/2O2(g) = H2O (g) △H=+285.8 kJ/mol
思路:热化学反应方程式书写要注意物质的状态、△H 的符号、△H 的大小与物质计量系数的关系。由液态水排除选项C和D。
【解析】
A和B选项就是△H 的大小不同。题目给了H2的质量,我们要求出
H2 的质量与化学计量系数之间的关系,从而求出△H 的值。
由n=m/M可得,1g H2 的物质的量为n=1g/2(g/mol)=0.5mol,即0.5mol H2 燃烧释放142.9 kJ的热量,即1mol H2燃烧释放142.9kJ×2=285.8 kJ的热量,则选 B
【例题1】在25℃和101 kPa下,1gH2 燃烧生成液体水放出142.9 kJ
的热量,则下列热化学方程式中书写正确的是 ( )
A. 2H2(g) + O2(g) = 2H2O (l) △H=-142.9 kJ/mol
B. H2(g) + 1/2O2(g) = H2O (l) △H=-285.8 kJ/mol
B
任务四:求算化学反应的反应热
1.由盖斯定律求算反应热
ΔH=ΔH1+ΔH2
如何利用盖斯定律求化学反应的热效应
物质变化
能量变化
根据目标方程式
找出已知方程式
确定中间产物
模型应用
调整已知方程式的方向和计量数消去中间产物
将调整好的
△H 加和
【例2】 (教材P20习题9 )2008年北京奥运会“祥云”火炬的燃料是丙烷(C3H8),1996年亚特兰大奥运会火炬的燃料是丙烯(C3H6)。丙烷脱氢可得到丙烯。
已知:
① C3H8(g) = CH4 (g) + C2H2 (g) +H2 (g) ΔH1= +255.7 kJ/mol
② C3H6(g) = CH4 (g) + C2H2 (g) ΔH2= +131.5 kJ/mol
计算 ③ C3H8(g) = C3H6(g) + H2 (g) 的ΔH。
解题思维模型
找出求算量
找出关联点
找出已知量
利用盖斯定律间接求算反应热的步骤
根据目标方程式找出已知方程式
调整已知方程式的方向和计量数
将调整好的△H加和
运用模型
找出求算量
计算③ C3H8(g) = C3H6(g) + H2 (g) 的ΔH。
找出已知量
① C3H8(g) = CH4 (g) + C2H2 (g) +H2 (g) ΔH1= +255.7 kJ/mol
② C3H6(g) = CH4 (g) + C2H2 (g) ΔH2= +131.5 kJ/mol
找出关联点
可知:反应③= 反应①- 反应②
ΔH = ΔH1 - ΔH2
ΔH = ΔH1 - ΔH2= +255.7 kJ/mol -( +131.5 kJ/mol )= +124.2 kJ/mol
C3H8(g)
CH4 (g) + C2H2 (g) +H2 (g)
C3H6(g) + H2 (g)
ΔH
ΔH1
ΔH2
2. 利用键能计算反应热
H=∑E (反应物断键吸收的总能量)-∑E (生成物成键放出的总能量)
【例3】(教材P19习题2) 已知:N2(g) + 3H2(g) =2NH3(g) △H=-92.4 kJ/mol。若断裂1 mol H-H、 1 mol N-H 需要吸收的能量分别为436kJ、391kJ,则断裂 1 mol N≡N 需要吸收的能量为( )
A. 431kJ B. 945.6kJ C. 649kJ D. 869kJ
运用模型
找出求算量
求断裂 1 mol N≡N需要吸收的能量
找出已知量
N2(g) + 3H2(g) =2NH3(g) △H=-92.4 kJ/mol。
断裂1 mol H-H、 1 mol N-H需要吸收的能量分别为436kJ、391kJ
找出关联点
H=∑E (反应物断键吸收的总能量)-∑E (生成物成键放出的总能量)
H= E( N≡N )+ 3× E(H-H)- 2×3×E(N-H)
-92.4 kJ/mol = E( N≡N )+ 3× 436 kJ/mol - 6×391 kJ/mol;
求得 : E( N≡N )= 945.6 kJ/mol
A. 431 kJ B. 945.6 kJ C. 649 kJ D. 869 kJ
解析:本题要求断裂1 mol N≡N所需的能量,由 H=∑E (反应物断键吸收的总能量)-∑E (生成物成键放出的总能量)可把化学键与已知的反应热关联,得: H= E( N≡N )+ 3× E(H-H)- 2×3×E(N-H)
即 -92.4 kJ/mol = E( N≡N )+ 3× 436 kJ/mol - 6×391 kJ/mol;
得: E( N≡N )= 945.6 kJ/mol
答案 选 B
B
【例3】(教材P19习题2) 已知:N2(g) + 3H2(g) =2NH3(g) △H=-92.4 kJ/mol。若断裂1 mol H-H、 1 mol N-H需要吸收的能量分别为436kJ、391kJ,则断裂 1 mol N≡N需要吸收的能量为( )
1.结合本章所学内容,回答为什么选用天然气作为燃料?
任务五:知识迁移运用
【例4】已知下列反应,请问为什么选用天然气作为燃料?
物质变化
能量变化
CH4(g) + 2O2(g) =CO2 (g) + 2H2O (l) △H=-890.3 kJ/mol
H2(g) + 1/2O2(g) = H2O (l) △H=-285.8 kJ/mol
C (s) + O2(g) =CO2 (g) △H=-393.5 kJ/mol
C (s) + 1/2O2(g) =CO (g) △H=-110.5 kJ/mol
选择燃料要考虑哪些因素?
H2的来源少,但CH4的储量丰富,来源多、价格便宜且热值大。所以选用天然气作为燃料。
(环保廉价)
(热值大)
【例5】(教材P19习题6 )已知:
① H2O(g)= H2(g)+ 1/2O2(g) △H= +241.8 kJ/mol
② C (s) + 1/2O2(g) =CO (g) △H= -110.5 kJ/mol
③ C (s) + O2(g) =CO2 (g) △H= -393.5 kJ/mol
请填写下列空白。
(1)上述反应中属于吸热反应的是————————(填序号)
(2)表示C燃烧热的热化学方程式的是————— (填序号)
(3)10gH2完全燃烧生成水蒸气,放出的热量为—————
(4)写出CO燃烧的热化学方程式:——————————————。
解题思维模型
找出求算量
找出关联点
找出已知量
请填写下列空白。
(1)上述反应中属于吸热反应的是————————(填序号)
关联点是什么?
①
根据△H 符号可知,反应①中△H 为正号,为吸热反应;
其他反应△H 都为负号,为放热反应。答案选择①。
【例5】(教材P19习题6 )已知:
① H2O(g)= H2(g)+ 1/2O2(g) △H1= +241.8 kJ/mol
② C (s) + 1/2O2(g) =CO (g) △H2= -110.5 kJ/mol
③ C (s) + O2(g) =CO2 (g) △H3= -393.5 kJ/mol
请填写下列空白。
(2)表示C燃烧热的热化学方程式的是————— (填序号)
根据燃烧热的定义:在101KPa时,1mol纯物质完全燃烧生成指定产物时所释放的热量,叫做该物质的燃烧热。而C元素完全燃烧生成的指定物质是CO2(g),所以答案选反应③
③
【例5】(教材P19习题6 )已知:
① H2O(g)= H2(g)+ 1/2O2(g) △H1= +241.8 kJ/mol
② C (s) + 1/2O2(g) =CO (g) △H2= -110.5 kJ/mol
③ C (s) + O2(g) =CO2 (g) △H3= -393.5 kJ/mol
关联点是什么?
请填写下列空白。
(3)10g H2完全燃烧生成水蒸气,放出的热量为——
【例5】(教材P19习题6 )已知:
① H2O(g)= H2(g)+ 1/2O2(g) △H= +241.8 kJ/mol
② C (s) + 1/2O2(g) =CO (g) △H= -110.5 kJ/mol
③ C (s) + O2(g) =CO2 (g) △H= -393.5 kJ/mol
运用模型
找出求算量
反应放出的热量
找出已知量
10g H2完全燃烧
找出关联点
1)△H 大小与计量数成正比
2)n=m/M
由思维模型分析可得:
由n=m/M可得,10g H2 的物质的量为 n=10g÷2(g/mol)=5mol,由反应① H2O(g)= H2(g)+ 1/2O2(g) △H1= +241.8 kJ/mol
可得:反应 H2(g)+ 1/2O2(g) = H2O(g) △H= -241.8 kJ/mol
即:1mol H2燃烧释放241.8 kJ的热量,
则:5mol H2燃烧释放241.8kJ/mol ×5mol=1209 kJ 的热量,
则:答案为1209 kJ
(3)10gH2完全燃烧生成水蒸气,放出的热量为—————
1209 kJ
H2(g)+ 1/2O2(g) = H2O(g)
△H=?
请填写下列空白。
(4) 写出CO燃烧的热化学方程式:—————————。
【例5】(教材P19习题6 )已知:
① H2O(g)= H2(g)+ 1/2O2(g) △H1= +241.8 kJ/mol
② C (s) + 1/2O2(g) =CO (g) △H2= -110.5 kJ/mol
③ C (s) + O2(g) =CO2 (g) △H3= -393.5 kJ/mol
热化学方程式的书写思维模型:
写化学反应方程式
标状态
标条件
标 H
写出配平的
化学反应方程式
标明各物质的状态
(s、l、g、aq)
注明反应时的温度和压强
(不注明指25℃和101kPa )
注意吸热用“+”,
放热用“-”,
根据化学计量数计算
H的值,单位 kJ/mol
如何表示物质变化的过程?
能量的变化和哪些条件有关呢?
物质的状态、温度、压强、化学计量数等
表
示
物
质
和
能
量
变
化
的
过
程
利用盖斯定律间接求算反应热的步骤
根据目标方程式找出已知方程式
调整已知方程式的方向和计量数
将调整好的△H加和
解析:① 写出CO燃烧的热化学反应方程式:
CO(g)+ O2(g)= CO2(g) △H=
C (s) + O2(g)
CO2 (g)
CO(g)+ O2(g)
△H2
△H3
△H
△H3-△H2
=- 393.5 kJ/mol –
(-110.5 kJ/mol)
=-283 kJ/mol
【例5】(教材P19习题6 )已知:
① H2O(g)= H2(g)+ 1/2O2(g) △H1= +241.8 kJ/mol
② C (s) + 1/2O2(g) =CO (g) △H2= -110.5 kJ/mol
③ C (s) + O2(g) =CO2 (g) △H3= -393.5 kJ/mol
请填写下列空白。
(1)上述反应中属于吸热反应的是———————(填序号)
(2)表示C燃烧热的热化学方程式的是————(填序号)
(3)10gH2完全燃烧生成水蒸气,放出的热量为—————
(4)写出CO燃烧的热化学反应方程式:
①
③
1209 kJ
CO(g)+ O2(g)= CO2(g) △H= -283 kJ/mol
【例6】已知 H2(g)、C2H4(g)和 C2H5OH(l)的燃烧热分别是
-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g) 和 H2O(l) 反应生成 C2H5OH(l) 的△H为( ) A.-44.2 kJ·mol-1 B.+44.2 kJ·mol-1
C.-330 kJ·mol-1 D.+330 kJ·mol-1
由题干条件可知如下反应:
① H2(g)+1/2 O2(g) = H2O(l);ΔH1=-285.8 kJ·mol-1
② C2H4(g)+3O2(g) = 2CO2(g)+2H2O(l);ΔH2= -1411.0 kJ·mol-1
③ C2H5OH(l)+3O2(g) = 2CO2(g)+3H2O(l);ΔH3= -1366.8 kJ·mol-1
利用盖斯定律间接求算反应热的步骤
根据目标方程式找出已知方程式
调整已知方程式的方向和计量数
将调整好的△H加和
解析:
1. 根据目标方程式:④ C2H4(g)+H2O(l) = C2H5OH(l) ΔH=
2. 找到已知方程式:
① H2(g)+1/2 O2(g) = H2O(l);ΔH1=-285.8 kJ·mol-1
② C2H4(g)+3O2(g) = 2CO2(g)+2H2O(l);ΔH2= -1411.0 kJ·mol-1
③ C2H5OH(l)+3O2(g) = 2CO2(g)+3H2O(l);ΔH3= -1366.8 kJ·mol-1
3. 调整已知方程式的方向和计量数:反应④=反应②- 反应③
可得:反应④ C2H4(g)+H2O(l) = C2H5OH(l) ΔH=
ΔH2-ΔH3
ΔH= -1411.0 kJ·mol-1-(-1366.8 kJ·mol-1)= -44.2 kJ·mol-1
【例6】已知 H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是
-285.8 kJ·mol-1、-1411.0 kJ·mol-1和-1366.8 kJ·mol-1,则由C2H4(g) 和 H2O(l) 反应生成 C2H5OH(l) 的△H为( ) A.-44.2 kJ·mol-1 B.+44.2 kJ·mol-1
C.-330 kJ·mol-1 D.+330 kJ·mol-1
B
由反应④=反应②- 反应③
内容小结
1.本节课学习了从体系和环境、体系内能变化、化学键断裂和形成时的能量变化等不同角度定性认识反应热。
2.本节课学习了从物质变化和能量变化的角度书写热化学方程式。
3.本节课学习了根据热化学方程式、盖斯定律、化学键等定量计算反应热。
4.本节课从宏观、微观和符号三个角度学习了反应热。
谢谢
