化学人教版(2019)选择性必修1 1.2反应热的计算 课件(共2课时,73张PPT)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 1.2反应热的计算 课件(共2课时,73张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-12 12:51:07 | ||
图片预览








文档简介
(共73张PPT)
第二节 反应热的计算
第1课时 盖斯定律
高二—人教版—化学—选择性必修1—第一章
学习目标
1.从化学史角度发现并认识盖斯定律;
2.通过生活经验、路径角度和化学计算模型理解盖斯定律的内涵本质,了解其意义;
3.通过实例,能运用盖斯定律计算反应热以及解决生产生活中的实际问题。
化学反应的热效应
测定
中和反应反应热的测定
表示
焓变(ΔH)、热化学方程式
【知识回顾】
CH4 (g) + 2O2 (g) = CO2 (g) + 2H2O(l) ΔH = 890.3kJ/mol
CH4 (g) + 3/2O2 (g) = CO (g) + 2H2O(l)
——图片来源于网络
【思考】能否定量比较天然气完全燃烧和不完全燃烧所释放的能量?
【问题】能通过实验直接测定得到甲烷不完全燃烧
的反应热吗?
ΔH = ?
CO(g) + 1/2O2(g) = CO2(g) ΔH < 0
1.有些反应的产品不纯(有副反应发生),
如甲烷的不完全燃烧,大多数有机反应;
这些都给测量反应热造成了困难,利用盖斯定律可以间接地把它们的反应热计算出来。
在众多的化学反应中:
2.有些反应进行得很慢,如煤炭,石油的形成;
3.有些反应不容易直接发生,如石墨和氢气生成甲烷的反应。
热化学研究的先驱
最早研究反应热的是法国化学家拉瓦锡和法国数学家、天文学家拉普拉斯,他们利用冰量热计(即以被熔化了的冰的质量来计算热量)测定了碳单质的燃烧热,测得的数值与现代精确测定值十分接近。
拉瓦锡
拉普拉斯
任务1 发现盖斯定律
化学家盖斯利用自己设计的量热计,测定了大量的反应热。并依据氨水、氢氧化钠、氢氧化钾、石灰分别与硫酸反应的反应热总结出了盖斯定律。1840年,他将这一重大发现公之于众,对反应热的研究做出重大贡献。
盖斯
热化学研究的先驱
任务1 发现盖斯定律
【问题】什么是盖斯定律?
一个化学反应,不管是一步完成的还是分几步完成的,其反应热都是相同的。
盖斯
任务2 理解盖斯定律
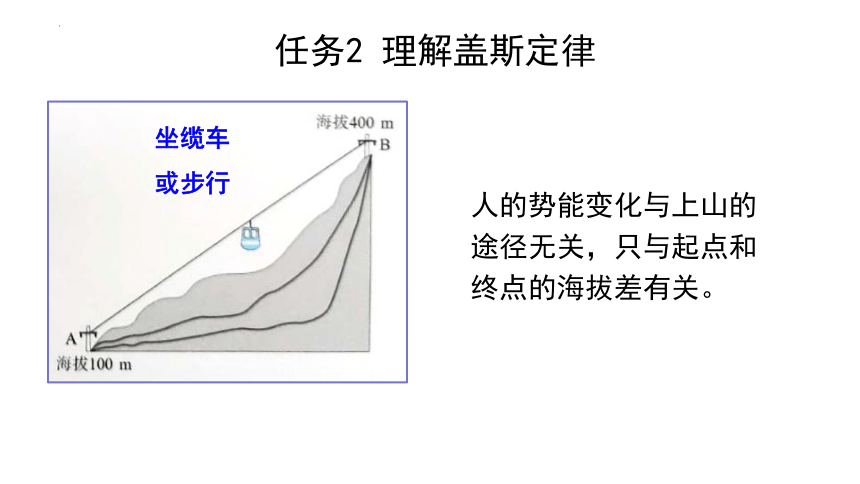
盖斯定律表明,在一定条件下,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
坐缆车
或步行
人的势能变化与上山的途径无关,只与起点和终点的海拔差有关。
任务2 理解盖斯定律
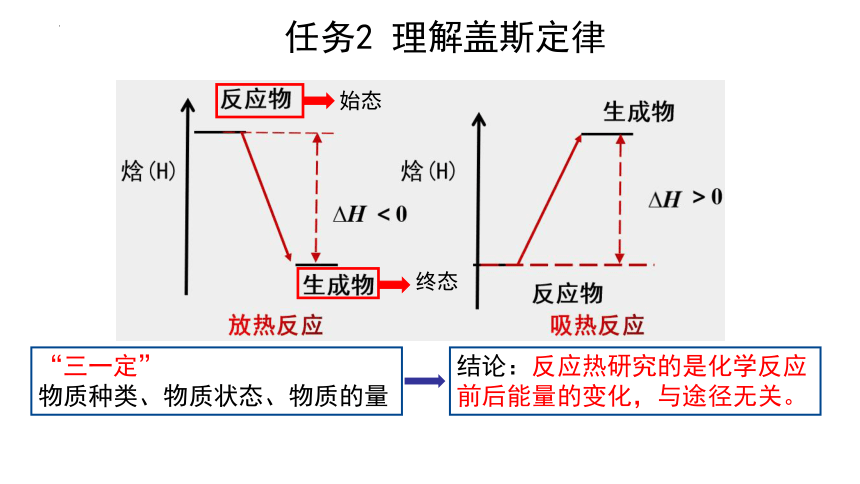
“三一定”
物质种类、物质状态、物质的量
任务2 理解盖斯定律
始态
终态
结论:反应热研究的是化学反应前后能量的变化,与途径无关。
例 已知在298K时:
① C(s) + O2(g) = CO2(g) ΔH1= 393.5kJ/mol
② CO(g) + 1/2O2(g) = CO2(g) ΔH2= 283.0kJ/mol
问题:要测出C(s) + 1/2O2(g) = CO(g) ΔH3=?
任务2 理解盖斯定律
【思考】以上热化学方程式中的物质变化有何联系
CO (g) + 1/2O2 (g)
② CO(g) + 1/2O2(g) = CO2(g) ΔH2= 283.0kJ/mol
任务2 理解盖斯定律
C(s) + O2(g)
CO2(g)
始态
终态
③ C(s) + 1/2O2(g) = CO(g) ΔH3=?
① C(s) + O2(g) = CO2(g) ΔH1= 393.5kJ/mol
分步进行
一步完成
物质变化
ΔH1 = ΔH2 + ΔH3
ΔH3 = ΔH1 – ΔH2
= –393.5kJ/mol – (–283.0kJ/mol)
= –110.5kJ/mol
任务2 理解盖斯定律
【问题】化学反应发生物质变化的同时,能量变化之间存在什么关系?
求从始态到终态的ΔH与ΔH1、ΔH2的关系?
ΔH = ΔH1 + ΔH2
任务2 理解盖斯定律
若一个反应体系的始态到终态可以一步完成(反应热ΔH)。分两步进行:先从始态到a(反应热为ΔH1),再从a到终态(反应热为ΔH2)。
路径法
【练习1】已知:
① H2 (g) + 1/2O2 (g) = H2O (l) ΔH1= 285.8kJ/mol
② H2O (l) = H2O (g) ΔH2= +44kJ/mol
③ H2 (g) + 1/2O2 (g) = H2O (g) ΔH3= 241.8kJ/mol
设计成如下转化路径,请填空:
H2 (g) + 1/2O2 (g)
H2O (g)
ΔH1
ΔH2
ΔH3
H2O (l)
ΔH1 =
ΔH3 ΔH2
例 已知在298K时:
① C(s) + O2(g) = CO2(g) ΔH1= 393.5kJ/mol
② CO(g) + 1/2O2(g) = CO2(g) ΔH2= 283.0kJ/mol
问题:要测出C(s) + 1/2O2(g) = CO(g) ΔH3=?
任务2 理解盖斯定律
请同学们仔细观察思考,除了利用路径法进行图解,还有其他计算方法吗?
C(s) + O2(g) = CO2(g) ΔH1= 393.5 kJ/mol
+)
ΔH3 = ΔH1 ΔH2
= 393.5 kJ/mol ( 283.0 kJ/mol)= 110.5 kJ/mol
C(s) + 1/2O2(g) = CO(g) ΔH3=?
CO(g) + 1/2O2(g) = CO2(g) ΔH2= 283.0 kJ/mol
C(s) + 1/2O2(g) = CO(g) ΔH3= 110.5 kJ/mol
结论:若一个化学方程式可由另外几个化学方程式相加减而得到,则该反应的焓变即为这几个化学反应焓变的代数和。
CO可以消去,视为中间产物。
【思考】如何利用盖斯定律书写热化学方程式
将调整好的ΔH加和,确定目标反应的焓变ΔH。
物质变化
根据目标热化学方程式中各物质找已知热化学方程式。
①比较目标方程式,确定中间产物。
能量变化
思维模型建构
②调整已知热化学方程式的方向和计量数并相加和,消去中间产物。
【练习2】如何计算甲烷不完全燃烧的反应热呢?
①CH4 (g) + 2O2 (g) = CO2 (g) + 2H2O(l)
ΔH1= 890.3 kJ/mol
ΔH2= ?
② CH4 (g) + 3/2O2 (g) = CO (g) + 2H2O(l)
任务3 应用盖斯定律
【思考】根据盖斯定律分析,本题还缺少哪个热化学方程式?
③ CO (g) + 1/2O2 (g) = CO2 (g) ΔH3= 283.0 kJ/mol
CO(g) + 2H2O(l) + 1/2O2(g)
CH4(g) + 2O2(g)
CO2(g) + 2H2O(l)
始态
终态
ΔH2
ΔH1
ΔH3
①CH4 (g) + 2O2 (g) = CO2 (g) + 2H2O(l)
ΔH1= 890.3 kJ/mol
ΔH2= ?
② CH4 (g) + 3/2O2 (g) = CO (g) + 2H2O(l)
【路径法】
物质变化
能量变化
【能量变化图】
③ CO (g) + 1/2O2 (g) = CO2 (g) ΔH3= 283.0 kJ/mol
① CH4 (g) + 2O2 (g) = CO2 (g) + 2H2O(l) Δ H1 = 890.3 kJ/mol
② CH4 (g) + 3/2O2 (g) = CO (g) + 2H2O(l) Δ H2 = ?
③ CO (g) + 1/2O2 (g) = CO2 (g) Δ H3= 283.0 kJ/mol
任务3 应用盖斯定律
根据目标方程式
找出已知方程式
确定中间产物
调整已知方程式的方向和计量数
消去中间产物
将调整好的ΔH加和
【练习2】计算甲烷不完全燃烧的反应热是多少?
模型应用
物质变化
能量变化
ΔH2 = ΔH1 ΔH3
= 890.3 kJ/mol ( 283.0kJ/mol)
= 607.3kJ/mol
① ③ = ②
任务3 应用盖斯定律
根据目标方程式
找出已知方程式
确定中间产物
调整已知方程式的方向和计量数
消去中间产物
将调整好的ΔH加和
①,③ ;CO2(g)
①, ③
ΔH2 = ?
CH4 (g) + 3/2O2 (g) = CO (g) + 2H2O(l)
CH4 (g) + 3/2O2 (g) = CO (g) + 2H2O(l) ΔH2= 607.3kJ/mol
① CH4 (g) + 2O2 (g) = CO2 (g) + 2H2O(l) Δ H1 = 890.3 kJ/mol
③ CO (g) + 1/2O2 (g) = CO2 (g) Δ H3= 283.0 kJ/mol
物质变化
能量变化
【练习3,课本17页第4题】火箭发射时可以用肼(N2H4,液态)作燃料,
NO2作氧化剂,二者反应生成N2和水蒸气。已知:
① N2(g) + 2O2(g) = 2NO2(g) ΔH1= +66.4kJ/mol
② N2H4(l) + O2(g) = N2(g) + 2H2O(g) ΔH2= 534kJ/mol
请写出N2H4(l)与NO2反应的热化学方程式。
根据目标方程式
找出已知方程式
确定中间产物
调整已知方程式的方向和计量数
消去中间产物
将调整好的ΔH加和
模型应用
物质变化
能量变化
任务3 应用盖斯定律
根据目标方程式
找出已知方程式
确定中间产物
调整已知方程式的方向和计量数
消去中间产物
将调整好的ΔH加和
2N2H4(l) + 2NO2(g) = 3N2(g) + 4H2O(g)
ΔH =?
① + 2②
①,②;O2(g)
① ,2②
2N2H4(l) + 2NO2(g) = 3N2(g) + 4H2O(g)
ΔH = 1134.4 kJ/mol
ΔH = ΔH1 + 2ΔH2
= 66.4kJ/mol + 2×( 534) kJ/mol
= 1134.4 kJ/mol
① N2(g) + 2O2(g) = 2NO2(g) ΔH1= +66.4kJ/mol
② N2H4(l) + O2(g) = N2(g) + 2H2O(g) ΔH2= 534kJ/mol
物质变化
能量变化
总结
一、盖斯定律的内容:一个化学反应,不管是一步完成的还
是分几步完成的,其反应热是相同的。
二、盖斯定律的意义:间接计算某些反应的反应热
1.反应很慢的;2.不容易直接发生的;3.伴有副反应的。
三、应用盖斯定律计算ΔH的方法:“虚拟路径”法、加和法。
根据目标方程式
找出已知方程式
确定中间产物
调整已知方程式的方向和计量数
消去中间产物
将调整好的ΔH加和
模型应用
物质变化
能量变化
高二—人教版—化学—选择性必修1—第一章
第二节 反应热的计算
第2课时 反应热的计算
【学习目标】
1.通过例题的学习,学会利用热化学方程式直接求算。
2.通过例题的学习,学会运用盖斯定律进行相关判断或计算。
3.体会反应热在生产生活中的应用价值,形成运用盖斯定律进行相关判断或计算的思维模型。
通过前面的学习,我们知道可以用热化学方程式来表征化学反应中的物质变化和能量变化,这节课我们将要学习反应热的计算。
【前言】
问题1:为什么我们需要学习反应热的计算?
长征五号“身高”56.97米起飞重量为869t。近地轨道25t地球同步转移轨道14t。
它的助推器燃料采用的是液氧煤油,为了提供这么大的能量,我们需要加注多少t燃料呢?
任务一:利用热化学方程式直接求算
请翻到选择性必修1第15页阅读例题1,请问同学读完该题后,有什么解题思路呢?
任务一:利用热化学方程式直接求算
【例题1】(选择性必修1第15页例题1)黄铁矿(主要成分为FeS2)的燃烧是工业上制硫酸时得到SO2的途径之一,反应的化学方程式为:
4FeS2+11O2======2Fe2O3+8SO2
在25℃和101kPa时,1 mol FeS2(s)完全燃烧生成Fe2O3(s)和SO2(g)时放出853kJ的热量。这些热量(工业中叫做“废热”)在生产过程中得到了充分利用,大大降低了生产成本,对于节约资源、能源循环利用具有重要意义。
(1)请写出FeS2燃烧的热化学方程式。
(2)计算理论上1kg黄铁矿(FeS2的含量为90%)完全燃烧放出的热量。
高温
解题思路指引
任务一:利用热化学方程式直接求算
找出求算量
找出已知量
找出关联点
【例题1】 】(选择性必修1第15页例题1)黄铁矿(主要成分为FeS2)的燃烧是工业上制硫酸时得到SO2的途径之一,反应的化学方程式为:
4FeS2+11O2======2Fe2O3+8SO2
在25℃和101kPa时,1 mol FeS2(s)完全燃烧生成Fe2O3(s)和SO2(g)时放出853kJ的热量。这些热量(工业中叫做“废热”)在生产过程中得到了充分利用,大大降低了生产成本,对于节约资源、能源循环利用具有重要意义。
(1)请写出FeS2燃烧的热化学方程式
(2)计算理论上1kg黄铁矿(FeS2的含量为90%)完全燃烧放出的热量。
高温
求算量
已知量
任务一:利用热化学方程式直接求算
以黄铁矿为原料生产硫酸的工艺流程如下:
知识卡片-废热:人类在活动中因某种需要而生产制造的热能在利用结束后所排放的不再利用的热能就叫废热。
任务一:利用热化学方程式直接求算
【例题1】(选择性必修1第15页例题1)黄铁矿(主要成分为FeS2)的燃烧是工业上制硫酸时得到SO2的途径之一,反应的化学方程式为:
4FeS2+11O2======2Fe2O3+8SO2
在25℃和101kPa时,1 mol FeS2(s)完全燃烧生成Fe2O3(s)和SO2(g)时放出853kJ的热量。
(1)请写出FeS2燃烧的热化学方程式。
高温
任务一:利用热化学方程式直接求算
物质变化
能量变化
提示:热化学方程式与化学方程式书写不同
4FeS2 (s) +11O2 (g) 2Fe2O3 (s) +8SO2 (g)
高温
△H
FeS2 (s)+ O2 (g) Fe2O3 (s) +2SO2 (g)
高温
△H1=-853kJ/mol
11
4
1
2
4FeS2 (s) +11O2 (g) 2Fe2O3 (s) +8SO2 (g)
高温
△H2=-3412kJ/mol
解题思路指引
4FeS2+11O2======2Fe2O3+8SO2
高温
4FeS2(s) +11O2(g) ======2Fe2O3(s) +8SO2(g) △H=-3412kJ/mol
高温
请比较与课本第15页的数据有何不同?有什么启示?
FeS2(s) +11/4O2(g) ======1/2Fe2O3(s) +2SO2(g) △H=-853kJ/mol
高温
1 mol FeS2(s)参与反应对应的△H=-853kJ/mol
4 mol FeS2(s)参与反应对应的△H=-3412kJ/mol
△H必须与化学方程式一一对应
任务一:利用热化学方程式直接求算
写化学方程式
加上物质状态和△H
检查物质状态和△H的单位及数值
【例题1】(选择性必修1第15页例题1)黄铁矿(主要成分为FeS2)的燃烧是工业上制硫酸时得到SO2的途径之一,反应的化学方程式为:
4FeS2+11O2======2Fe2O3+8SO2
在25℃和101kPa时,1 mol FeS2(s)完全燃烧生成Fe2O3(s)和SO2(g)时放出853kJ的热量。
(2)计算理论上1kg黄铁矿(FeS2的含量为90%)完全燃烧放出的热量。
高温
任务一:利用热化学方程式直接求算
任务一:利用热化学方程式直接求算
物质变化
能量变化
1 mol FeS2(s)完全燃烧生成Fe2O3(s)和SO2(g)时放出853kJ的热量。
1kg黄铁矿(FeS2的含量为90%)
m=mⅹw%
1kg黄铁矿含FeS2的质量为:1000g×90%=900g
n=m/M
FeS2的摩尔质量为120g·mol-1
900gFeS2的物质的量为:900g / 120g·mol-1=7.5 mol
7.5mol ⅹ853kJ/mol
1kg黄铁矿完全燃烧放出的热量为: 6398kJ
方法1
(2)计算理论上1kg黄铁矿(FeS2的含量为90%)完全燃烧放出的热量。
FeS2的摩尔质量为120g·mol-1
1kg黄铁矿含FeS2的质量为:1000g×90%=900g
900gFeS2的物质的量为:900g / 120g·mol-1=7.5 mol
理论上1kg黄铁矿完全燃烧放出的热量为: 7.5mol × 853kJ/mol=6398kJ
答略
任务一:利用热化学方程式直接求算
解题思路指引
计算理论上1kg黄铁矿(FeS2的含量为90%)完全燃烧放出的热量。
FeS2(s) +11/4O2(g) ======1/2Fe2O3(s) +2SO2(g) △H=-853kJ/mol
高温
n=m/M
FeS2的摩尔质量为120g·mol-1
1kg黄铁矿含FeS2的质量为:1000g×90%=900g
方法2
任务一:利用热化学方程式直接求算
找出求算量
找出已知量
找出关联点
思维模型
热量?热化学方程式? △H?
n=m/M等相关公式
化学方程式?热化学方程式? △H?m
任务一:利用热化学方程式直接求算
找出求算量
找出已知量
找出关联点
【例题2】葡萄糖是人体所需能量的重要来源之一
任务一:利用热化学方程式直接求算
【例题2】葡萄糖是人体所需能量的重要来源之一:它在人体组织中完全氧化时的热化学方程式为:
C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H=-2800kJ/mol
计算100g葡萄糖在人体组织中完全氧化时产生的热量。
任务一:利用热化学方程式直接求算
请翻到书本第16页,阅读例题2,请问同学们读完该题后,有什么解题思路呢?
解题思路指引
任务一:利用热化学方程式直接求算
找出求算量
找出已知量
找出关联点
【例题2】(选择性必修1第16页例题2)葡萄糖是人体所需能量的重要来源之一:它在人体组织中完全氧化时的热化学方程式为:
C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H=-2800kJ/mol
计算100g葡萄糖在人体组织中完全氧化时产生的热量。
求算量
已知量
任务一:利用热化学方程式直接求算
思维模型应用
热量?热化学方程式? △H?
n=m/M等相关公式
化学方程式?热化学方程式? △H?m
任务一:利用热化学方程式直接求算
找出求算量
找出已知量
找出关联点
计算100g葡萄糖在人体组织中完全氧化时产生的热量。
C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)
△H=-2800kJ/mol
n=m/M
C6H12O6的摩尔质量为180 g·mol-1。
任务一:利用热化学方程式直接求算
找出求算量
找出已知量
找出关联点
【解】根据热化学方程式可知,1 mol C6H12O6在人体组织中完全氧化时产生的热量为2 800 kJ。
C6H12O6的摩尔质量为180 g·mol-1。
100 g C6H12O6的物质的量为:0.556 mol
C6H12O6完全氧化时产生的热量为:0.556 mol×2 800 kJ/mol=1557 kJ
答:100 g葡萄糖在人体组织中完全氧化时产生的热量为1557 kJ。
任务一:利用热化学方程式直接求算
任务二:运用盖斯定律进行相关判断或计算
【例题3】焦炭与水蒸气反应、甲烷与水蒸气反应均是工业上制取氢气的重要方法。这两个反应的热化学方程式分别为:
① C(s)+H2O(g)=CO (g)+H2 (g)△H1=+131.5kJ/mol
② CH4(g)+H2O(g)=CO(g)+3H2(g), △H2 =+205.9 kJ/mol
试计算CH4(g)=C(s)+2H2(g)的△H
请翻到书本第16页,阅读例题3,请问同学们读完该题后,有什么解题思路呢?
任务二:运用盖斯定律进行相关判断或计算
解题思路指引
找出求算量
找出已知量
找出关联点
【例题3】(选择性必修1第16页例题3)焦炭与水蒸气反应、甲烷与水蒸气反应均是工业上制取氢气的重要方法。这两个反应的热化学方程式分别为:
① C(s)+H2O(g)=CO (g)+H2 (g)△H1=+131.5kJ/mol
② CH4(g)+H2O(g)=CO(g)+3H2(g), △H2 =+205.9 kJ/mol
试计算CH4(g)=C(s)+2H2(g)的△H
已知量
求算量
任务二:运用盖斯定律进行相关判断或计算
解题思路指引
计算CH4(g)=C(s)+2H2(g)的△H
① C(s)+H2O(g)=CO (g)+H2 (g)△H1=+131.5kJ/mol
② CH4(g)+H2O(g)=CO(g)+3H2(g), △H2 =+205.9 kJ/mol
盖斯定律
ΔH=ΔH1+ΔH2
任务二:运用盖斯定律进行相关判断或计算
找出求算量
找出已知量
找出关联点
任务二:运用盖斯定律进行相关判断或计算
思维模型建构
根据目标方程式找出已知方程式
确定中间产物
调整已知方程式的方向和计量数,消去中间产物
将调整好的△H加和
物质变化
能量变化
利用盖斯定律间接求算反应热的解题步骤
根据目标方程式找出已知方程式
确定中间产物
调整已知方程式的方向和计量数
消去中间产物
将调整好的△H加和
任务二:运用盖斯定律进行相关判断或计算
△H = -△H1 + △H 2 =-131.5kJ/mol +205.9kJ/mol = +74.4kJ/mol
-①+② =目标方程式
①, ②
-①, ②
物质变化
能量变化
【解】分析各化学方程式的关系可以得出,将反应①的逆反应与反应②相加,得到反应:CH4(g) === C(s)+2H2(g)
即:
CO(g)+H2(g) === C(s)+H2O(g) Δ H3=-Δ H1=-131.5kJ/mol
+)CH4(g)+H2O(g) === CO(g)+3H2(g) Δ H2=+205.9kJ/mol
CH4(g) === C(s)+2H2(g) Δ H=?
任务二:运用盖斯定律进行相关判断或计算
根据盖斯定律:
Δ H=Δ H3+Δ H2=Δ H2-Δ H1
=+205.9kJ/mol-131.5kJ/mol
=+74.4kJ/mol
答:CH4(g) === C(s)+2H2(g)的ΔH=+74.4kJ/mol。
任务二:运用盖斯定律进行相关判断或计算
任务二:运用盖斯定律进行相关判断或计算
思维模型建构
根据目标方程式找出已知方程式
确定中间产物
调整已知方程式的方向和计量数,
消去中间产物
将调整好的△H加和
物质变化
能量变化
任务二:运用盖斯定律进行相关判断或计算
易错点
1.热化学方程式同乘以某个数值时,反应热的数值也必乘以该数。
2.热化学方程式相加减时,反应热的数值也相加减。
3.将一个化学方程式左右颠倒时, Δ H正负号必须随之改变,但数值不变。
确定目标方程式找出已知方程式,确定中间产物
调整已知方程式的方向和计量数,消去中间产物
将调整好的△H加和
解题步骤
物质变化
能量变化
工业上制取氢气时涉及的一个重要反应是: CO(g)+H2O(g)=CO2(g)+H2(g)
已知:
① C(s)+1/2O2(g)=CO (g)△H1=-110.5kJ/mol
② H2(g)+1/2O2(g)=H2O(g)△H2=-241.8kJ/mol
③ C(s)+O2(g)=CO2(g)△H3=-393.5kJ/mol
请写出一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式。
求算量
已知量
任务二:运用盖斯定律进行相关判断或计算
请翻到书本第17页,阅读练习与应用第6题,请问同学读完该题后,有什么解题思路呢?
任务二:运用盖斯定律进行相关判断或计算
思维模型应用
根据目标方程式找出已知方程式
确定中间产物
调整已知方程式的方向和计量数,消去中间产物
将调整好的△H加和
物质变化
能量变化
任务二:运用盖斯定律进行相关判断或计算
易错点
1.热化学方程式同乘以某个数值时,反应热的数值也必乘以该数。
2.热化学方程式相加减时,反应热的数值也相加减。
3.将一个化学方程式左右颠倒时, Δ H正负号必须随之改变,但数值不变。
确定目标方程式找出已知方程式,确定中间产物
调整已知方程式的方向和计量数,消去中间产物
将调整好的△H加和
解题步骤
物质变化
能量变化
CO (g) +H2O(g) =CO2(g) + H2(g) △H2=?
①,②,③
-①,-②,③
- △H1 - △H2 + △H3
CO (g) +H2O(g) =CO2(g) + H2(g) △H2=- △H1 - △H2 + △H3 =-41.2 kJ/mol
任务二:运用盖斯定律进行相关判断或计算
① C(s)+1/2O2(g)=CO (g) △H1=-110.5kJ/mol
② H2(g)+1/2O2(g)=H2O(g) △H2=-241.8kJ/mol
③ C(s)+O2(g)=CO2(g) △H3=-393.5kJ/mol
确定目标方程式找出已知方程式,确定中间产物
调整已知方程式的方向和计量数,消去中间产物
将调整好的△H加和
物质变化
能量变化
【总结】
反应热的计算
利用热化学方程式
运用盖斯定律
直接求算
间接求算
利用热化学方程式直接求算的解题模型
思维模型
热量?热化学方程式? △H?
n=m/M等相关公式
化学方程式?热化学方程式? △H?m
找出求算量
找出已知量
找出关联点
任务二:运用盖斯定律进行相关判断或计算
易错点
1.热化学方程式同乘以某个数值时,反应热的数值也必乘以该数。
2.热化学方程式相加减时,反应热的数值也相加减。
3.将一个化学方程式左右颠倒时, Δ H正负号必须随之改变,但数值不变。
确定目标方程式找出已知方程式,确定中间产物
调整已知方程式的方向和计量数,消去中间产物
将调整好的△H加和
解题步骤
物质变化
能量变化
家用液化气的成分之一是丁烷。当10kg丁烷完全燃烧生成二氧化碳和液态水时,放出5×105kJ的热量。
(1)写出丁烷燃烧的热化学方程式。
(2)已知1mol液态水变为水蒸气时需要吸收44kJ的热量,计算1mol丁烷完全燃烧生成二氧化碳和水蒸气时放出的热量。
任务三: 课内检测
请翻到书本第17页阅读练习与应用第3题,请问同学读完该题后,有什么解题思路呢?
写出丁烷燃烧的热化学方程式。
10kg丁烷完全燃烧生成二氧化碳和液态水时,放出5×105kJ的热量。
n=m/M
丁烷的摩尔质量为58 g·mol-1。
10kg丁烷的物质的量为:10000g/ 58 g·mol-1
(1)解题思路指引
答: (1)C4H10(g)+6.5O2(g) === 4CO2(g)+5H2O(l)
Δ H=-2 900 kJ/mol
任务三: 课内检测
找出求算量
找出已知量
找出关联点
计算1mol丁烷完全燃烧生成二氧化碳和水蒸气时放出的热量。
(2)解题思路指引
C4H10(g)+O2(g) === 4CO2(g)+5H2O(l) Δ H1=-2 900 kJ/mol
1mol液态水变为水蒸气时需要吸收44kJ的热量
H2O(l) === H2O(g) Δ H2= + 2 900 kJ/mol
C4H10(g)+O2(g) === 4CO2(g)+5H2O(g) Δ H=?
C4H10(g)+6.5O2(g) === 4CO2(g)+5H2O(g)
Δ H= Δ H1 + Δ H2 =-2 680 kJ/mol
答:(2)2 680 kJ
任务三: 课内检测
找出求算量
找出已知量
找出关联点
谢谢
第二节 反应热的计算
第1课时 盖斯定律
高二—人教版—化学—选择性必修1—第一章
学习目标
1.从化学史角度发现并认识盖斯定律;
2.通过生活经验、路径角度和化学计算模型理解盖斯定律的内涵本质,了解其意义;
3.通过实例,能运用盖斯定律计算反应热以及解决生产生活中的实际问题。
化学反应的热效应
测定
中和反应反应热的测定
表示
焓变(ΔH)、热化学方程式
【知识回顾】
CH4 (g) + 2O2 (g) = CO2 (g) + 2H2O(l) ΔH = 890.3kJ/mol
CH4 (g) + 3/2O2 (g) = CO (g) + 2H2O(l)
——图片来源于网络
【思考】能否定量比较天然气完全燃烧和不完全燃烧所释放的能量?
【问题】能通过实验直接测定得到甲烷不完全燃烧
的反应热吗?
ΔH = ?
CO(g) + 1/2O2(g) = CO2(g) ΔH < 0
1.有些反应的产品不纯(有副反应发生),
如甲烷的不完全燃烧,大多数有机反应;
这些都给测量反应热造成了困难,利用盖斯定律可以间接地把它们的反应热计算出来。
在众多的化学反应中:
2.有些反应进行得很慢,如煤炭,石油的形成;
3.有些反应不容易直接发生,如石墨和氢气生成甲烷的反应。
热化学研究的先驱
最早研究反应热的是法国化学家拉瓦锡和法国数学家、天文学家拉普拉斯,他们利用冰量热计(即以被熔化了的冰的质量来计算热量)测定了碳单质的燃烧热,测得的数值与现代精确测定值十分接近。
拉瓦锡
拉普拉斯
任务1 发现盖斯定律
化学家盖斯利用自己设计的量热计,测定了大量的反应热。并依据氨水、氢氧化钠、氢氧化钾、石灰分别与硫酸反应的反应热总结出了盖斯定律。1840年,他将这一重大发现公之于众,对反应热的研究做出重大贡献。
盖斯
热化学研究的先驱
任务1 发现盖斯定律
【问题】什么是盖斯定律?
一个化学反应,不管是一步完成的还是分几步完成的,其反应热都是相同的。
盖斯
任务2 理解盖斯定律
盖斯定律表明,在一定条件下,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
坐缆车
或步行
人的势能变化与上山的途径无关,只与起点和终点的海拔差有关。
任务2 理解盖斯定律
“三一定”
物质种类、物质状态、物质的量
任务2 理解盖斯定律
始态
终态
结论:反应热研究的是化学反应前后能量的变化,与途径无关。
例 已知在298K时:
① C(s) + O2(g) = CO2(g) ΔH1= 393.5kJ/mol
② CO(g) + 1/2O2(g) = CO2(g) ΔH2= 283.0kJ/mol
问题:要测出C(s) + 1/2O2(g) = CO(g) ΔH3=?
任务2 理解盖斯定律
【思考】以上热化学方程式中的物质变化有何联系
CO (g) + 1/2O2 (g)
② CO(g) + 1/2O2(g) = CO2(g) ΔH2= 283.0kJ/mol
任务2 理解盖斯定律
C(s) + O2(g)
CO2(g)
始态
终态
③ C(s) + 1/2O2(g) = CO(g) ΔH3=?
① C(s) + O2(g) = CO2(g) ΔH1= 393.5kJ/mol
分步进行
一步完成
物质变化
ΔH1 = ΔH2 + ΔH3
ΔH3 = ΔH1 – ΔH2
= –393.5kJ/mol – (–283.0kJ/mol)
= –110.5kJ/mol
任务2 理解盖斯定律
【问题】化学反应发生物质变化的同时,能量变化之间存在什么关系?
求从始态到终态的ΔH与ΔH1、ΔH2的关系?
ΔH = ΔH1 + ΔH2
任务2 理解盖斯定律
若一个反应体系的始态到终态可以一步完成(反应热ΔH)。分两步进行:先从始态到a(反应热为ΔH1),再从a到终态(反应热为ΔH2)。
路径法
【练习1】已知:
① H2 (g) + 1/2O2 (g) = H2O (l) ΔH1= 285.8kJ/mol
② H2O (l) = H2O (g) ΔH2= +44kJ/mol
③ H2 (g) + 1/2O2 (g) = H2O (g) ΔH3= 241.8kJ/mol
设计成如下转化路径,请填空:
H2 (g) + 1/2O2 (g)
H2O (g)
ΔH1
ΔH2
ΔH3
H2O (l)
ΔH1 =
ΔH3 ΔH2
例 已知在298K时:
① C(s) + O2(g) = CO2(g) ΔH1= 393.5kJ/mol
② CO(g) + 1/2O2(g) = CO2(g) ΔH2= 283.0kJ/mol
问题:要测出C(s) + 1/2O2(g) = CO(g) ΔH3=?
任务2 理解盖斯定律
请同学们仔细观察思考,除了利用路径法进行图解,还有其他计算方法吗?
C(s) + O2(g) = CO2(g) ΔH1= 393.5 kJ/mol
+)
ΔH3 = ΔH1 ΔH2
= 393.5 kJ/mol ( 283.0 kJ/mol)= 110.5 kJ/mol
C(s) + 1/2O2(g) = CO(g) ΔH3=?
CO(g) + 1/2O2(g) = CO2(g) ΔH2= 283.0 kJ/mol
C(s) + 1/2O2(g) = CO(g) ΔH3= 110.5 kJ/mol
结论:若一个化学方程式可由另外几个化学方程式相加减而得到,则该反应的焓变即为这几个化学反应焓变的代数和。
CO可以消去,视为中间产物。
【思考】如何利用盖斯定律书写热化学方程式
将调整好的ΔH加和,确定目标反应的焓变ΔH。
物质变化
根据目标热化学方程式中各物质找已知热化学方程式。
①比较目标方程式,确定中间产物。
能量变化
思维模型建构
②调整已知热化学方程式的方向和计量数并相加和,消去中间产物。
【练习2】如何计算甲烷不完全燃烧的反应热呢?
①CH4 (g) + 2O2 (g) = CO2 (g) + 2H2O(l)
ΔH1= 890.3 kJ/mol
ΔH2= ?
② CH4 (g) + 3/2O2 (g) = CO (g) + 2H2O(l)
任务3 应用盖斯定律
【思考】根据盖斯定律分析,本题还缺少哪个热化学方程式?
③ CO (g) + 1/2O2 (g) = CO2 (g) ΔH3= 283.0 kJ/mol
CO(g) + 2H2O(l) + 1/2O2(g)
CH4(g) + 2O2(g)
CO2(g) + 2H2O(l)
始态
终态
ΔH2
ΔH1
ΔH3
①CH4 (g) + 2O2 (g) = CO2 (g) + 2H2O(l)
ΔH1= 890.3 kJ/mol
ΔH2= ?
② CH4 (g) + 3/2O2 (g) = CO (g) + 2H2O(l)
【路径法】
物质变化
能量变化
【能量变化图】
③ CO (g) + 1/2O2 (g) = CO2 (g) ΔH3= 283.0 kJ/mol
① CH4 (g) + 2O2 (g) = CO2 (g) + 2H2O(l) Δ H1 = 890.3 kJ/mol
② CH4 (g) + 3/2O2 (g) = CO (g) + 2H2O(l) Δ H2 = ?
③ CO (g) + 1/2O2 (g) = CO2 (g) Δ H3= 283.0 kJ/mol
任务3 应用盖斯定律
根据目标方程式
找出已知方程式
确定中间产物
调整已知方程式的方向和计量数
消去中间产物
将调整好的ΔH加和
【练习2】计算甲烷不完全燃烧的反应热是多少?
模型应用
物质变化
能量变化
ΔH2 = ΔH1 ΔH3
= 890.3 kJ/mol ( 283.0kJ/mol)
= 607.3kJ/mol
① ③ = ②
任务3 应用盖斯定律
根据目标方程式
找出已知方程式
确定中间产物
调整已知方程式的方向和计量数
消去中间产物
将调整好的ΔH加和
①,③ ;CO2(g)
①, ③
ΔH2 = ?
CH4 (g) + 3/2O2 (g) = CO (g) + 2H2O(l)
CH4 (g) + 3/2O2 (g) = CO (g) + 2H2O(l) ΔH2= 607.3kJ/mol
① CH4 (g) + 2O2 (g) = CO2 (g) + 2H2O(l) Δ H1 = 890.3 kJ/mol
③ CO (g) + 1/2O2 (g) = CO2 (g) Δ H3= 283.0 kJ/mol
物质变化
能量变化
【练习3,课本17页第4题】火箭发射时可以用肼(N2H4,液态)作燃料,
NO2作氧化剂,二者反应生成N2和水蒸气。已知:
① N2(g) + 2O2(g) = 2NO2(g) ΔH1= +66.4kJ/mol
② N2H4(l) + O2(g) = N2(g) + 2H2O(g) ΔH2= 534kJ/mol
请写出N2H4(l)与NO2反应的热化学方程式。
根据目标方程式
找出已知方程式
确定中间产物
调整已知方程式的方向和计量数
消去中间产物
将调整好的ΔH加和
模型应用
物质变化
能量变化
任务3 应用盖斯定律
根据目标方程式
找出已知方程式
确定中间产物
调整已知方程式的方向和计量数
消去中间产物
将调整好的ΔH加和
2N2H4(l) + 2NO2(g) = 3N2(g) + 4H2O(g)
ΔH =?
① + 2②
①,②;O2(g)
① ,2②
2N2H4(l) + 2NO2(g) = 3N2(g) + 4H2O(g)
ΔH = 1134.4 kJ/mol
ΔH = ΔH1 + 2ΔH2
= 66.4kJ/mol + 2×( 534) kJ/mol
= 1134.4 kJ/mol
① N2(g) + 2O2(g) = 2NO2(g) ΔH1= +66.4kJ/mol
② N2H4(l) + O2(g) = N2(g) + 2H2O(g) ΔH2= 534kJ/mol
物质变化
能量变化
总结
一、盖斯定律的内容:一个化学反应,不管是一步完成的还
是分几步完成的,其反应热是相同的。
二、盖斯定律的意义:间接计算某些反应的反应热
1.反应很慢的;2.不容易直接发生的;3.伴有副反应的。
三、应用盖斯定律计算ΔH的方法:“虚拟路径”法、加和法。
根据目标方程式
找出已知方程式
确定中间产物
调整已知方程式的方向和计量数
消去中间产物
将调整好的ΔH加和
模型应用
物质变化
能量变化
高二—人教版—化学—选择性必修1—第一章
第二节 反应热的计算
第2课时 反应热的计算
【学习目标】
1.通过例题的学习,学会利用热化学方程式直接求算。
2.通过例题的学习,学会运用盖斯定律进行相关判断或计算。
3.体会反应热在生产生活中的应用价值,形成运用盖斯定律进行相关判断或计算的思维模型。
通过前面的学习,我们知道可以用热化学方程式来表征化学反应中的物质变化和能量变化,这节课我们将要学习反应热的计算。
【前言】
问题1:为什么我们需要学习反应热的计算?
长征五号“身高”56.97米起飞重量为869t。近地轨道25t地球同步转移轨道14t。
它的助推器燃料采用的是液氧煤油,为了提供这么大的能量,我们需要加注多少t燃料呢?
任务一:利用热化学方程式直接求算
请翻到选择性必修1第15页阅读例题1,请问同学读完该题后,有什么解题思路呢?
任务一:利用热化学方程式直接求算
【例题1】(选择性必修1第15页例题1)黄铁矿(主要成分为FeS2)的燃烧是工业上制硫酸时得到SO2的途径之一,反应的化学方程式为:
4FeS2+11O2======2Fe2O3+8SO2
在25℃和101kPa时,1 mol FeS2(s)完全燃烧生成Fe2O3(s)和SO2(g)时放出853kJ的热量。这些热量(工业中叫做“废热”)在生产过程中得到了充分利用,大大降低了生产成本,对于节约资源、能源循环利用具有重要意义。
(1)请写出FeS2燃烧的热化学方程式。
(2)计算理论上1kg黄铁矿(FeS2的含量为90%)完全燃烧放出的热量。
高温
解题思路指引
任务一:利用热化学方程式直接求算
找出求算量
找出已知量
找出关联点
【例题1】 】(选择性必修1第15页例题1)黄铁矿(主要成分为FeS2)的燃烧是工业上制硫酸时得到SO2的途径之一,反应的化学方程式为:
4FeS2+11O2======2Fe2O3+8SO2
在25℃和101kPa时,1 mol FeS2(s)完全燃烧生成Fe2O3(s)和SO2(g)时放出853kJ的热量。这些热量(工业中叫做“废热”)在生产过程中得到了充分利用,大大降低了生产成本,对于节约资源、能源循环利用具有重要意义。
(1)请写出FeS2燃烧的热化学方程式
(2)计算理论上1kg黄铁矿(FeS2的含量为90%)完全燃烧放出的热量。
高温
求算量
已知量
任务一:利用热化学方程式直接求算
以黄铁矿为原料生产硫酸的工艺流程如下:
知识卡片-废热:人类在活动中因某种需要而生产制造的热能在利用结束后所排放的不再利用的热能就叫废热。
任务一:利用热化学方程式直接求算
【例题1】(选择性必修1第15页例题1)黄铁矿(主要成分为FeS2)的燃烧是工业上制硫酸时得到SO2的途径之一,反应的化学方程式为:
4FeS2+11O2======2Fe2O3+8SO2
在25℃和101kPa时,1 mol FeS2(s)完全燃烧生成Fe2O3(s)和SO2(g)时放出853kJ的热量。
(1)请写出FeS2燃烧的热化学方程式。
高温
任务一:利用热化学方程式直接求算
物质变化
能量变化
提示:热化学方程式与化学方程式书写不同
4FeS2 (s) +11O2 (g) 2Fe2O3 (s) +8SO2 (g)
高温
△H
FeS2 (s)+ O2 (g) Fe2O3 (s) +2SO2 (g)
高温
△H1=-853kJ/mol
11
4
1
2
4FeS2 (s) +11O2 (g) 2Fe2O3 (s) +8SO2 (g)
高温
△H2=-3412kJ/mol
解题思路指引
4FeS2+11O2======2Fe2O3+8SO2
高温
4FeS2(s) +11O2(g) ======2Fe2O3(s) +8SO2(g) △H=-3412kJ/mol
高温
请比较与课本第15页的数据有何不同?有什么启示?
FeS2(s) +11/4O2(g) ======1/2Fe2O3(s) +2SO2(g) △H=-853kJ/mol
高温
1 mol FeS2(s)参与反应对应的△H=-853kJ/mol
4 mol FeS2(s)参与反应对应的△H=-3412kJ/mol
△H必须与化学方程式一一对应
任务一:利用热化学方程式直接求算
写化学方程式
加上物质状态和△H
检查物质状态和△H的单位及数值
【例题1】(选择性必修1第15页例题1)黄铁矿(主要成分为FeS2)的燃烧是工业上制硫酸时得到SO2的途径之一,反应的化学方程式为:
4FeS2+11O2======2Fe2O3+8SO2
在25℃和101kPa时,1 mol FeS2(s)完全燃烧生成Fe2O3(s)和SO2(g)时放出853kJ的热量。
(2)计算理论上1kg黄铁矿(FeS2的含量为90%)完全燃烧放出的热量。
高温
任务一:利用热化学方程式直接求算
任务一:利用热化学方程式直接求算
物质变化
能量变化
1 mol FeS2(s)完全燃烧生成Fe2O3(s)和SO2(g)时放出853kJ的热量。
1kg黄铁矿(FeS2的含量为90%)
m=mⅹw%
1kg黄铁矿含FeS2的质量为:1000g×90%=900g
n=m/M
FeS2的摩尔质量为120g·mol-1
900gFeS2的物质的量为:900g / 120g·mol-1=7.5 mol
7.5mol ⅹ853kJ/mol
1kg黄铁矿完全燃烧放出的热量为: 6398kJ
方法1
(2)计算理论上1kg黄铁矿(FeS2的含量为90%)完全燃烧放出的热量。
FeS2的摩尔质量为120g·mol-1
1kg黄铁矿含FeS2的质量为:1000g×90%=900g
900gFeS2的物质的量为:900g / 120g·mol-1=7.5 mol
理论上1kg黄铁矿完全燃烧放出的热量为: 7.5mol × 853kJ/mol=6398kJ
答略
任务一:利用热化学方程式直接求算
解题思路指引
计算理论上1kg黄铁矿(FeS2的含量为90%)完全燃烧放出的热量。
FeS2(s) +11/4O2(g) ======1/2Fe2O3(s) +2SO2(g) △H=-853kJ/mol
高温
n=m/M
FeS2的摩尔质量为120g·mol-1
1kg黄铁矿含FeS2的质量为:1000g×90%=900g
方法2
任务一:利用热化学方程式直接求算
找出求算量
找出已知量
找出关联点
思维模型
热量?热化学方程式? △H?
n=m/M等相关公式
化学方程式?热化学方程式? △H?m
任务一:利用热化学方程式直接求算
找出求算量
找出已知量
找出关联点
【例题2】葡萄糖是人体所需能量的重要来源之一
任务一:利用热化学方程式直接求算
【例题2】葡萄糖是人体所需能量的重要来源之一:它在人体组织中完全氧化时的热化学方程式为:
C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H=-2800kJ/mol
计算100g葡萄糖在人体组织中完全氧化时产生的热量。
任务一:利用热化学方程式直接求算
请翻到书本第16页,阅读例题2,请问同学们读完该题后,有什么解题思路呢?
解题思路指引
任务一:利用热化学方程式直接求算
找出求算量
找出已知量
找出关联点
【例题2】(选择性必修1第16页例题2)葡萄糖是人体所需能量的重要来源之一:它在人体组织中完全氧化时的热化学方程式为:
C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H=-2800kJ/mol
计算100g葡萄糖在人体组织中完全氧化时产生的热量。
求算量
已知量
任务一:利用热化学方程式直接求算
思维模型应用
热量?热化学方程式? △H?
n=m/M等相关公式
化学方程式?热化学方程式? △H?m
任务一:利用热化学方程式直接求算
找出求算量
找出已知量
找出关联点
计算100g葡萄糖在人体组织中完全氧化时产生的热量。
C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)
△H=-2800kJ/mol
n=m/M
C6H12O6的摩尔质量为180 g·mol-1。
任务一:利用热化学方程式直接求算
找出求算量
找出已知量
找出关联点
【解】根据热化学方程式可知,1 mol C6H12O6在人体组织中完全氧化时产生的热量为2 800 kJ。
C6H12O6的摩尔质量为180 g·mol-1。
100 g C6H12O6的物质的量为:0.556 mol
C6H12O6完全氧化时产生的热量为:0.556 mol×2 800 kJ/mol=1557 kJ
答:100 g葡萄糖在人体组织中完全氧化时产生的热量为1557 kJ。
任务一:利用热化学方程式直接求算
任务二:运用盖斯定律进行相关判断或计算
【例题3】焦炭与水蒸气反应、甲烷与水蒸气反应均是工业上制取氢气的重要方法。这两个反应的热化学方程式分别为:
① C(s)+H2O(g)=CO (g)+H2 (g)△H1=+131.5kJ/mol
② CH4(g)+H2O(g)=CO(g)+3H2(g), △H2 =+205.9 kJ/mol
试计算CH4(g)=C(s)+2H2(g)的△H
请翻到书本第16页,阅读例题3,请问同学们读完该题后,有什么解题思路呢?
任务二:运用盖斯定律进行相关判断或计算
解题思路指引
找出求算量
找出已知量
找出关联点
【例题3】(选择性必修1第16页例题3)焦炭与水蒸气反应、甲烷与水蒸气反应均是工业上制取氢气的重要方法。这两个反应的热化学方程式分别为:
① C(s)+H2O(g)=CO (g)+H2 (g)△H1=+131.5kJ/mol
② CH4(g)+H2O(g)=CO(g)+3H2(g), △H2 =+205.9 kJ/mol
试计算CH4(g)=C(s)+2H2(g)的△H
已知量
求算量
任务二:运用盖斯定律进行相关判断或计算
解题思路指引
计算CH4(g)=C(s)+2H2(g)的△H
① C(s)+H2O(g)=CO (g)+H2 (g)△H1=+131.5kJ/mol
② CH4(g)+H2O(g)=CO(g)+3H2(g), △H2 =+205.9 kJ/mol
盖斯定律
ΔH=ΔH1+ΔH2
任务二:运用盖斯定律进行相关判断或计算
找出求算量
找出已知量
找出关联点
任务二:运用盖斯定律进行相关判断或计算
思维模型建构
根据目标方程式找出已知方程式
确定中间产物
调整已知方程式的方向和计量数,消去中间产物
将调整好的△H加和
物质变化
能量变化
利用盖斯定律间接求算反应热的解题步骤
根据目标方程式找出已知方程式
确定中间产物
调整已知方程式的方向和计量数
消去中间产物
将调整好的△H加和
任务二:运用盖斯定律进行相关判断或计算
△H = -△H1 + △H 2 =-131.5kJ/mol +205.9kJ/mol = +74.4kJ/mol
-①+② =目标方程式
①, ②
-①, ②
物质变化
能量变化
【解】分析各化学方程式的关系可以得出,将反应①的逆反应与反应②相加,得到反应:CH4(g) === C(s)+2H2(g)
即:
CO(g)+H2(g) === C(s)+H2O(g) Δ H3=-Δ H1=-131.5kJ/mol
+)CH4(g)+H2O(g) === CO(g)+3H2(g) Δ H2=+205.9kJ/mol
CH4(g) === C(s)+2H2(g) Δ H=?
任务二:运用盖斯定律进行相关判断或计算
根据盖斯定律:
Δ H=Δ H3+Δ H2=Δ H2-Δ H1
=+205.9kJ/mol-131.5kJ/mol
=+74.4kJ/mol
答:CH4(g) === C(s)+2H2(g)的ΔH=+74.4kJ/mol。
任务二:运用盖斯定律进行相关判断或计算
任务二:运用盖斯定律进行相关判断或计算
思维模型建构
根据目标方程式找出已知方程式
确定中间产物
调整已知方程式的方向和计量数,
消去中间产物
将调整好的△H加和
物质变化
能量变化
任务二:运用盖斯定律进行相关判断或计算
易错点
1.热化学方程式同乘以某个数值时,反应热的数值也必乘以该数。
2.热化学方程式相加减时,反应热的数值也相加减。
3.将一个化学方程式左右颠倒时, Δ H正负号必须随之改变,但数值不变。
确定目标方程式找出已知方程式,确定中间产物
调整已知方程式的方向和计量数,消去中间产物
将调整好的△H加和
解题步骤
物质变化
能量变化
工业上制取氢气时涉及的一个重要反应是: CO(g)+H2O(g)=CO2(g)+H2(g)
已知:
① C(s)+1/2O2(g)=CO (g)△H1=-110.5kJ/mol
② H2(g)+1/2O2(g)=H2O(g)△H2=-241.8kJ/mol
③ C(s)+O2(g)=CO2(g)△H3=-393.5kJ/mol
请写出一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式。
求算量
已知量
任务二:运用盖斯定律进行相关判断或计算
请翻到书本第17页,阅读练习与应用第6题,请问同学读完该题后,有什么解题思路呢?
任务二:运用盖斯定律进行相关判断或计算
思维模型应用
根据目标方程式找出已知方程式
确定中间产物
调整已知方程式的方向和计量数,消去中间产物
将调整好的△H加和
物质变化
能量变化
任务二:运用盖斯定律进行相关判断或计算
易错点
1.热化学方程式同乘以某个数值时,反应热的数值也必乘以该数。
2.热化学方程式相加减时,反应热的数值也相加减。
3.将一个化学方程式左右颠倒时, Δ H正负号必须随之改变,但数值不变。
确定目标方程式找出已知方程式,确定中间产物
调整已知方程式的方向和计量数,消去中间产物
将调整好的△H加和
解题步骤
物质变化
能量变化
CO (g) +H2O(g) =CO2(g) + H2(g) △H2=?
①,②,③
-①,-②,③
- △H1 - △H2 + △H3
CO (g) +H2O(g) =CO2(g) + H2(g) △H2=- △H1 - △H2 + △H3 =-41.2 kJ/mol
任务二:运用盖斯定律进行相关判断或计算
① C(s)+1/2O2(g)=CO (g) △H1=-110.5kJ/mol
② H2(g)+1/2O2(g)=H2O(g) △H2=-241.8kJ/mol
③ C(s)+O2(g)=CO2(g) △H3=-393.5kJ/mol
确定目标方程式找出已知方程式,确定中间产物
调整已知方程式的方向和计量数,消去中间产物
将调整好的△H加和
物质变化
能量变化
【总结】
反应热的计算
利用热化学方程式
运用盖斯定律
直接求算
间接求算
利用热化学方程式直接求算的解题模型
思维模型
热量?热化学方程式? △H?
n=m/M等相关公式
化学方程式?热化学方程式? △H?m
找出求算量
找出已知量
找出关联点
任务二:运用盖斯定律进行相关判断或计算
易错点
1.热化学方程式同乘以某个数值时,反应热的数值也必乘以该数。
2.热化学方程式相加减时,反应热的数值也相加减。
3.将一个化学方程式左右颠倒时, Δ H正负号必须随之改变,但数值不变。
确定目标方程式找出已知方程式,确定中间产物
调整已知方程式的方向和计量数,消去中间产物
将调整好的△H加和
解题步骤
物质变化
能量变化
家用液化气的成分之一是丁烷。当10kg丁烷完全燃烧生成二氧化碳和液态水时,放出5×105kJ的热量。
(1)写出丁烷燃烧的热化学方程式。
(2)已知1mol液态水变为水蒸气时需要吸收44kJ的热量,计算1mol丁烷完全燃烧生成二氧化碳和水蒸气时放出的热量。
任务三: 课内检测
请翻到书本第17页阅读练习与应用第3题,请问同学读完该题后,有什么解题思路呢?
写出丁烷燃烧的热化学方程式。
10kg丁烷完全燃烧生成二氧化碳和液态水时,放出5×105kJ的热量。
n=m/M
丁烷的摩尔质量为58 g·mol-1。
10kg丁烷的物质的量为:10000g/ 58 g·mol-1
(1)解题思路指引
答: (1)C4H10(g)+6.5O2(g) === 4CO2(g)+5H2O(l)
Δ H=-2 900 kJ/mol
任务三: 课内检测
找出求算量
找出已知量
找出关联点
计算1mol丁烷完全燃烧生成二氧化碳和水蒸气时放出的热量。
(2)解题思路指引
C4H10(g)+O2(g) === 4CO2(g)+5H2O(l) Δ H1=-2 900 kJ/mol
1mol液态水变为水蒸气时需要吸收44kJ的热量
H2O(l) === H2O(g) Δ H2= + 2 900 kJ/mol
C4H10(g)+O2(g) === 4CO2(g)+5H2O(g) Δ H=?
C4H10(g)+6.5O2(g) === 4CO2(g)+5H2O(g)
Δ H= Δ H1 + Δ H2 =-2 680 kJ/mol
答:(2)2 680 kJ
任务三: 课内检测
找出求算量
找出已知量
找出关联点
谢谢
