实验活动6 酸、碱的化学性质(课件29页)-九年级化学下册(人教版)
文档属性
| 名称 | 实验活动6 酸、碱的化学性质(课件29页)-九年级化学下册(人教版) |

|
|
| 格式 | pptx | ||
| 文件大小 | 248.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-11 22:33:02 | ||
图片预览







文档简介
人教版 化学(初中)
实验活动6 酸、碱的化学性质
学习目标
重点、难点
通过实验探究,提高实验分析能力和设计实验的能力。
1.加深对指示剂遇酸、碱颜色变化的认识。
2.实验探究酸、碱的化学性质。
3.通过实验探究,提高实验分析能力和设计实验的能力。
新课讲解
【实验目的】
1.加深对酸和碱的主要性质的认识。
2.通过实验解释生活中的一些现象。
【实验用品】
试管、药匙、蒸发皿、酒精灯、玻璃棒。
稀盐酸、稀硫酸、氢氧化钠溶液、氢氧化钙溶液、硫酸铜溶液、
氢氧化钙粉末、石蕊溶液、酚酞溶液、pH试纸、生锈的铁钉。
新课讲解
新课讲解
注意
酸和碱有腐蚀 性,实验时应注意安全!
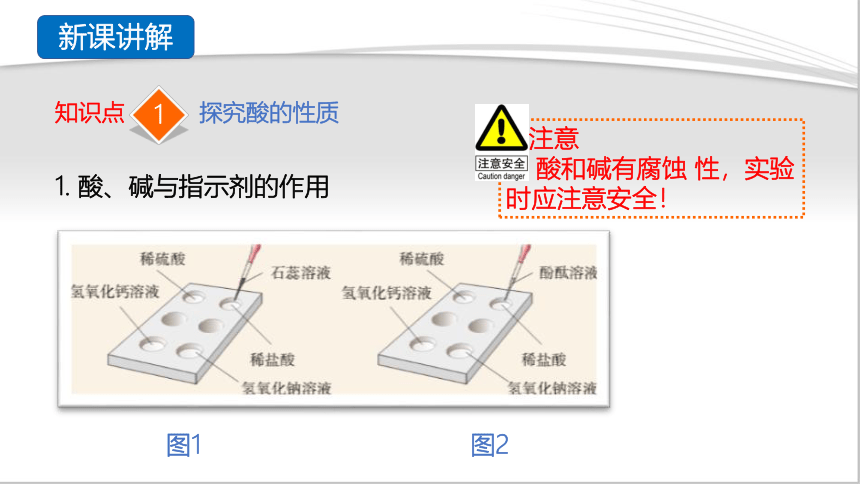
1. 酸、碱与指示剂的作用
1
知识点
探究酸的性质
图1 图2
新课讲解
【操作步骤】
(1)取两个点滴板分别滴有稀盐酸、稀硫酸、氢氧化钠 溶液、氢氧化钙溶液。
(2)向一个点滴板上的四种溶液中分别滴加紫色的石蕊溶液,观察颜色的变化(如图1)。
(3)向另一个点滴板上的四种溶液中分别滴加无色的酚酞溶液,观察颜色的变化(如图2)。
新课讲解
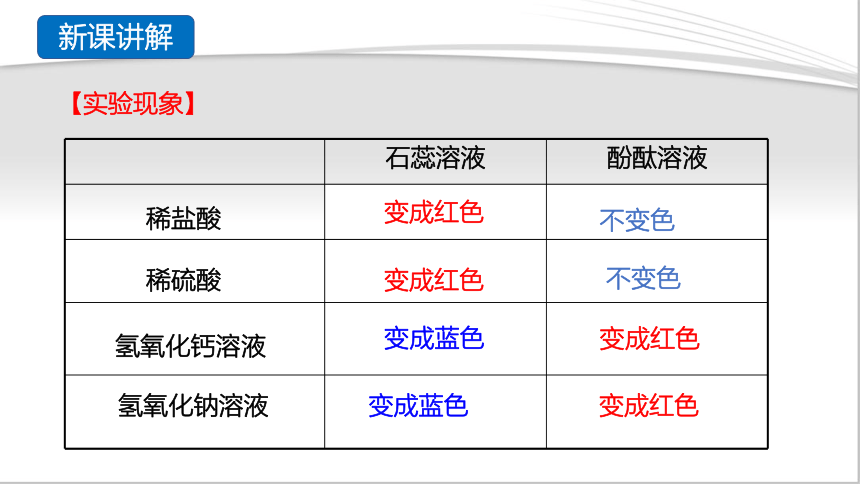
石蕊溶液
酚酞溶液
变成蓝色
变成红色
【实验现象】
不变色
不变色
变成红色
稀硫酸
变成红色
变成蓝色
氢氧化钙溶液
氢氧化钠溶液
稀盐酸
变成红色
新课讲解
实验结论
酸溶液能使紫色石蕊溶液变成红色,酸溶液不能使无色酚酞溶液变色;碱溶液能使紫色石蕊溶液变成蓝色,能使无色酚酞溶液变成红色
【实验结论】
新课讲解
2.酸与金属氧化物、金属反应
【操作步骤】
(1)取两个生锈的铁钉放入两支试管中,然后加入约2 mL稀盐酸,观察现象。
(2)当观察到铁钉表面的锈去掉变得光亮时,将其中一支试管中的铁钉取出洗净。继续观察另一支试管中的现象。
(3)过一段时间将铁钉取出,洗净。比较两支铁钉。
酸与金属氧化物的反应
新课讲解
新课讲解
【实验现象及结论】
?
反应现象
结论(化学方程式)
稀盐酸和生锈铁钉的反应
光亮的铁钉继续与酸作用
铁锈消失,铁钉变得光亮,溶液由无色变成黄色
光亮的铁钉表面有气泡冒出,溶液由黄色变成浅绿色
Fe2O3+6HCl=2FeCl3+3H2O
Fe + 2HCl=FeCl2+H2↑
新课讲解
1.将铁钉放入试管时应如何操作?
2.生活中除去菜刀上的铁锈可以选择厨房中的 。
食醋
3.用盐酸除铁锈时,能否将铁钉长时间浸没在稀盐酸中?
不能,因为稀盐酸能够与铁钉反应。
一横二放三慢竖,不能把铁钉直接投入试管中,防止打破试管。
新课讲解
2
知识点
探究碱的性质
在试管中加入约2mL硫酸铜溶液,然后滴 入几滴氢氧化钠溶液,
观察现象。然后再向试管中加入稀盐酸,观察现象。
1.碱与盐的反应
【操作步骤】
新课讲解
【实验现象及结论】
? 实验操作
反应现象
结论(化学方程式)
向盛有CuSO4溶液的试管中加入几滴NaOH溶液
再向上述试管中加入稀盐酸
有蓝色沉
淀生成
蓝色沉
淀消失
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
Cu(OH)2+2HCl=CuCl2+2H2O
新课讲解
2.中和反应
在试管中加入约1mL氢氧化钠溶液,滴入几滴酚酞溶液。然后边用滴管慢慢滴入稀盐酸,边不断振荡试管,至溶液颜色恰好变成无色为止。取该无色溶液约1mL置于蒸发皿中加热,使液体蒸干,观察现象。
【操作步骤】
新课讲解
【实验现象及结论】
?
反应现象
结论(化学方程式)
向1 mL氢氧化钠溶液中加入几滴酚酞溶液,再慢慢地滴加稀盐酸
取上述无色的溶液1 mL置于蒸发皿中加热蒸干
?
溶液由无色变
成红色,然后
溶液由红色变
成无色
蒸发皿上出
现白色固体
NaOH+HCl=NaCl+H2O
新课讲解
(1)向两支试管中各加入相同量的氢氧化钙粉末(用药匙的柄把一端挑一点),然后各加入1mL水,振荡。
(2)向两支试管中各滴入1~2滴酚酞,观察现象。
(3)继续向其中一支试管中加入约1mL水,振荡;向另一支试管中加入约1mL稀盐酸,振荡。
(4)比较两支试管中的现象。
3. 氢氧化钙的性质
【实验步骤】
①
②
③
④
新课讲解
新课讲解
【实验现象及结论】
?
反应现象
结论(化学方程式)
向少量的氢氧化钙粉末中加入1 mL水,振荡,再滴入1~2滴酚酞溶液,再加入1 mL水振荡
向同质量的氢氧化钙粉末中加入1 mL水,振荡,再滴入1~2滴酚酞溶液,再加入1 mL稀盐酸振荡
固体部分溶解,
溶液由无色变
为红色
固体部分溶解,溶
液由无色变为红色,
加入盐酸后,固体
全部溶解,溶液由
红色变为无色
氢氧化钙微溶
于水,水溶液
显碱性
Ca(OH)2+2HCl
=CaCl2+2H2O
新课讲解
通过实验步骤5,可以验证氢氧化钙的哪些性质?
①氢氧化钙微溶于水。
②氢氧化钙溶液显碱性。
③氢氧化钙溶液与盐酸反应。
交流讨论
指示剂
活泼金属
金属氧化物
H+ + OH- = H2O
中和反应
碱
酸
非金属氧化物
某些盐
酸、碱的化学性质
归纳小结
典例精讲
例1.(2022·山东烟台一模)不同的酸具有相似化学性质的本质原因是( )
A.它们都含有酸根
B.它们都含有氢元素
C.它们溶于水后都能解离出氢离子
D.它们都能与指示剂作用
典例精讲
【答案】C
【解析】A、具有酸根的物质还有盐,因此不是酸具有相似化学性质的本质原因,选项错误;B、含有氢元素的物质有很多如氢气,水以及碱类物质等因此不是酸具有相似化学性质的本质原因,选项错误;C、酸溶于水后都能解离出氢离子,因此不同的酸具有相似化学性质,选项正确;D、与指示剂作用的还有碱性溶液,因此不是酸具有相似化学性质的本质原因,选项错误;故选:C。
典例精讲
例2(2022·四川达州·一模)硫酸是一种经常用到的酸。下列有关硫酸的说法正确的是( )
A.构成:硫酸溶液中H+和SO42-的数目相等
B.性质:能与CO2等非金属物质反应
C.用途:用于生产化肥、农药、炸药、染料等
D.生产:含硫酸的工业废水,用CaCl2处理后直接排放
典例精讲
【答案】C
【解析】A、根据硫酸的化学式H2SO4可知,硫酸溶液中H+和SO42-的数目比为2:1,错误;B、硫酸不能与CO2等非金属物质反应,错误;C、用于生产化肥、农药、炸药、染料等,正确;D、CaCl2与硫酸不反应,含硫酸的工业废水,用氢氧化钙处理后排放,错误。故选C。
典例讲解
例3.(2022年云南省中考)天宫课堂中,宇航员通过实验呈现了“奥运五环”,实验中使用了指示剂一一溴百里酚蓝,溴百里酚蓝溶液在不同环境中的显色情况如下:
溶液
中性溶液
碱性溶液
酸性溶液
颜色
绿色
蓝色
黄色
下列溶液能使绿色溴百里酚蓝溶液变为黄色的是( )
A.氯化钠溶液 B.醋酸溶液
C.氢氧化钾溶液 D.碳酸钠溶液
典例讲解
【答案】B
【解析】A、氯化钠溶液呈中性,遇到溴百里酚蓝溶液显绿色,故A不符合题意;B、醋酸溶液呈酸性,遇到溴百里酚蓝溶液显黄色,故B符合题意;C、氢氧化钾溶液呈碱性,遇到溴百里酚蓝溶液显蓝色,故C不符合题意;D、碳酸钠溶液呈碱性,遇到溴百里酚蓝溶液显蓝色,故D不符合题意;故选B。
1.完成配套练习册;
2.完成检测卷。
作业布置
实验活动6 酸、碱的化学性质
学习目标
重点、难点
通过实验探究,提高实验分析能力和设计实验的能力。
1.加深对指示剂遇酸、碱颜色变化的认识。
2.实验探究酸、碱的化学性质。
3.通过实验探究,提高实验分析能力和设计实验的能力。
新课讲解
【实验目的】
1.加深对酸和碱的主要性质的认识。
2.通过实验解释生活中的一些现象。
【实验用品】
试管、药匙、蒸发皿、酒精灯、玻璃棒。
稀盐酸、稀硫酸、氢氧化钠溶液、氢氧化钙溶液、硫酸铜溶液、
氢氧化钙粉末、石蕊溶液、酚酞溶液、pH试纸、生锈的铁钉。
新课讲解
新课讲解
注意
酸和碱有腐蚀 性,实验时应注意安全!
1. 酸、碱与指示剂的作用
1
知识点
探究酸的性质
图1 图2
新课讲解
【操作步骤】
(1)取两个点滴板分别滴有稀盐酸、稀硫酸、氢氧化钠 溶液、氢氧化钙溶液。
(2)向一个点滴板上的四种溶液中分别滴加紫色的石蕊溶液,观察颜色的变化(如图1)。
(3)向另一个点滴板上的四种溶液中分别滴加无色的酚酞溶液,观察颜色的变化(如图2)。
新课讲解
石蕊溶液
酚酞溶液
变成蓝色
变成红色
【实验现象】
不变色
不变色
变成红色
稀硫酸
变成红色
变成蓝色
氢氧化钙溶液
氢氧化钠溶液
稀盐酸
变成红色
新课讲解
实验结论
酸溶液能使紫色石蕊溶液变成红色,酸溶液不能使无色酚酞溶液变色;碱溶液能使紫色石蕊溶液变成蓝色,能使无色酚酞溶液变成红色
【实验结论】
新课讲解
2.酸与金属氧化物、金属反应
【操作步骤】
(1)取两个生锈的铁钉放入两支试管中,然后加入约2 mL稀盐酸,观察现象。
(2)当观察到铁钉表面的锈去掉变得光亮时,将其中一支试管中的铁钉取出洗净。继续观察另一支试管中的现象。
(3)过一段时间将铁钉取出,洗净。比较两支铁钉。
酸与金属氧化物的反应
新课讲解
新课讲解
【实验现象及结论】
?
反应现象
结论(化学方程式)
稀盐酸和生锈铁钉的反应
光亮的铁钉继续与酸作用
铁锈消失,铁钉变得光亮,溶液由无色变成黄色
光亮的铁钉表面有气泡冒出,溶液由黄色变成浅绿色
Fe2O3+6HCl=2FeCl3+3H2O
Fe + 2HCl=FeCl2+H2↑
新课讲解
1.将铁钉放入试管时应如何操作?
2.生活中除去菜刀上的铁锈可以选择厨房中的 。
食醋
3.用盐酸除铁锈时,能否将铁钉长时间浸没在稀盐酸中?
不能,因为稀盐酸能够与铁钉反应。
一横二放三慢竖,不能把铁钉直接投入试管中,防止打破试管。
新课讲解
2
知识点
探究碱的性质
在试管中加入约2mL硫酸铜溶液,然后滴 入几滴氢氧化钠溶液,
观察现象。然后再向试管中加入稀盐酸,观察现象。
1.碱与盐的反应
【操作步骤】
新课讲解
【实验现象及结论】
? 实验操作
反应现象
结论(化学方程式)
向盛有CuSO4溶液的试管中加入几滴NaOH溶液
再向上述试管中加入稀盐酸
有蓝色沉
淀生成
蓝色沉
淀消失
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
Cu(OH)2+2HCl=CuCl2+2H2O
新课讲解
2.中和反应
在试管中加入约1mL氢氧化钠溶液,滴入几滴酚酞溶液。然后边用滴管慢慢滴入稀盐酸,边不断振荡试管,至溶液颜色恰好变成无色为止。取该无色溶液约1mL置于蒸发皿中加热,使液体蒸干,观察现象。
【操作步骤】
新课讲解
【实验现象及结论】
?
反应现象
结论(化学方程式)
向1 mL氢氧化钠溶液中加入几滴酚酞溶液,再慢慢地滴加稀盐酸
取上述无色的溶液1 mL置于蒸发皿中加热蒸干
?
溶液由无色变
成红色,然后
溶液由红色变
成无色
蒸发皿上出
现白色固体
NaOH+HCl=NaCl+H2O
新课讲解
(1)向两支试管中各加入相同量的氢氧化钙粉末(用药匙的柄把一端挑一点),然后各加入1mL水,振荡。
(2)向两支试管中各滴入1~2滴酚酞,观察现象。
(3)继续向其中一支试管中加入约1mL水,振荡;向另一支试管中加入约1mL稀盐酸,振荡。
(4)比较两支试管中的现象。
3. 氢氧化钙的性质
【实验步骤】
①
②
③
④
新课讲解
新课讲解
【实验现象及结论】
?
反应现象
结论(化学方程式)
向少量的氢氧化钙粉末中加入1 mL水,振荡,再滴入1~2滴酚酞溶液,再加入1 mL水振荡
向同质量的氢氧化钙粉末中加入1 mL水,振荡,再滴入1~2滴酚酞溶液,再加入1 mL稀盐酸振荡
固体部分溶解,
溶液由无色变
为红色
固体部分溶解,溶
液由无色变为红色,
加入盐酸后,固体
全部溶解,溶液由
红色变为无色
氢氧化钙微溶
于水,水溶液
显碱性
Ca(OH)2+2HCl
=CaCl2+2H2O
新课讲解
通过实验步骤5,可以验证氢氧化钙的哪些性质?
①氢氧化钙微溶于水。
②氢氧化钙溶液显碱性。
③氢氧化钙溶液与盐酸反应。
交流讨论
指示剂
活泼金属
金属氧化物
H+ + OH- = H2O
中和反应
碱
酸
非金属氧化物
某些盐
酸、碱的化学性质
归纳小结
典例精讲
例1.(2022·山东烟台一模)不同的酸具有相似化学性质的本质原因是( )
A.它们都含有酸根
B.它们都含有氢元素
C.它们溶于水后都能解离出氢离子
D.它们都能与指示剂作用
典例精讲
【答案】C
【解析】A、具有酸根的物质还有盐,因此不是酸具有相似化学性质的本质原因,选项错误;B、含有氢元素的物质有很多如氢气,水以及碱类物质等因此不是酸具有相似化学性质的本质原因,选项错误;C、酸溶于水后都能解离出氢离子,因此不同的酸具有相似化学性质,选项正确;D、与指示剂作用的还有碱性溶液,因此不是酸具有相似化学性质的本质原因,选项错误;故选:C。
典例精讲
例2(2022·四川达州·一模)硫酸是一种经常用到的酸。下列有关硫酸的说法正确的是( )
A.构成:硫酸溶液中H+和SO42-的数目相等
B.性质:能与CO2等非金属物质反应
C.用途:用于生产化肥、农药、炸药、染料等
D.生产:含硫酸的工业废水,用CaCl2处理后直接排放
典例精讲
【答案】C
【解析】A、根据硫酸的化学式H2SO4可知,硫酸溶液中H+和SO42-的数目比为2:1,错误;B、硫酸不能与CO2等非金属物质反应,错误;C、用于生产化肥、农药、炸药、染料等,正确;D、CaCl2与硫酸不反应,含硫酸的工业废水,用氢氧化钙处理后排放,错误。故选C。
典例讲解
例3.(2022年云南省中考)天宫课堂中,宇航员通过实验呈现了“奥运五环”,实验中使用了指示剂一一溴百里酚蓝,溴百里酚蓝溶液在不同环境中的显色情况如下:
溶液
中性溶液
碱性溶液
酸性溶液
颜色
绿色
蓝色
黄色
下列溶液能使绿色溴百里酚蓝溶液变为黄色的是( )
A.氯化钠溶液 B.醋酸溶液
C.氢氧化钾溶液 D.碳酸钠溶液
典例讲解
【答案】B
【解析】A、氯化钠溶液呈中性,遇到溴百里酚蓝溶液显绿色,故A不符合题意;B、醋酸溶液呈酸性,遇到溴百里酚蓝溶液显黄色,故B符合题意;C、氢氧化钾溶液呈碱性,遇到溴百里酚蓝溶液显蓝色,故C不符合题意;D、碳酸钠溶液呈碱性,遇到溴百里酚蓝溶液显蓝色,故D不符合题意;故选B。
1.完成配套练习册;
2.完成检测卷。
作业布置
同课章节目录
