2022-2023学年人教版九年级化学下册 9.3溶液的浓度(第一课时) 导学案(含答案)
文档属性
| 名称 | 2022-2023学年人教版九年级化学下册 9.3溶液的浓度(第一课时) 导学案(含答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 148.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-11 00:00:00 | ||
图片预览


文档简介
9.3溶液的浓度(第一课时)
【课时目标】
1.认识溶质的质量分数的含义。
2.通过溶质的质量分数的简单计算,使学生掌握基本的解题方法,提高学生的解题能力。
3.让学生在练习计算的过程中,了解溶液与生产、生活的广泛联系,了解学习化学的最终目标是为社会服务。
重点:溶液的浓度的概念。
难点:有关溶质质量分数的简单计算。
【学习活动】
任务一 溶质质量分数及简单计算
1.溶液中溶质的质量分数是指_________与_________之比,计算公式为:溶质的质量分数=×100%,其中溶液质量包括_________质量和_________质量。
2.关于100 g 5%的氯化钠溶液,下列叙述正确的是( )
A.100 g水中溶有5 g氯化钠
B.将5 g氯化钠溶于95 g水中,可制得该溶液
C溶液中氯化钠与水的质量比为1:20
D.105 g该溶液中溶有5 g氯化钠
3.某溶液中溶质的质量分数为20%,则下列质量比关系不正确的是( )
A.溶质:溶剂=1:4 B.溶质:溶剂=1:5
C.溶剂:溶液=4:5 D.溶质:溶液=1:5
4.在实验室中,配制溶质质量分数为10%的氯化钠溶液45 g,需要氯化钠固体的质量是______g。将45 g 10%的氯化钠溶液配成含氯化钠为0.9%的溶液,得到氯化钠溶液的质量是______g。
5.用4g酚酞与酒精配制溶质质量分数为4%的酚酞溶液,需要酒精的质量是_________g,这些酒精的体积为_________mL(酒精的密度为0.8g/mL)。
【变式1】将某温度下热的硝酸钾饱和溶液逐渐冷却至室温,下列有关量随时间变化趋势的图像不正确的是( )
任务二 溶质质量分数与溶解度的关系
6.在一定温度下的饱和溶液中,溶质的质量分数=×100%,物质溶解度越大,其饱和溶液的溶质质量分数_________。
7.已知20℃硝酸钾的溶解度为31.6g。在该温度下将20g硝酸钾放入50g水中,充分搅拌,则所得溶液中溶质的质量分数约为( )
A.24.0% B.28.6% C.31.6% D.40.0%
8.25℃时,硝酸钾饱和溶液中溶质的质量分数为30%,则25℃时,硝酸钾的溶解度为( )
A.30g B.42.9g C.23g D.无法计算
9.某温度下,在100g质量分数为20%的KNO3不饱和溶液甲中加入10gKNO3固体,恰好得到饱和溶液乙,下列说法正确的是( )
A.该温度下,KNO3的溶解度为30g
B.乙溶液的质量分数为30%
C.降低温度,可以使甲溶液变成饱和溶液
D.升高温度,甲、乙两溶液的质量分数都增大
10.甲、乙、丙三种固体物质溶解度曲线如下图所示。下列说法错误的是( )
A.t1℃时,甲、乙的溶解度都是25g
B.t1℃时,将三种物质的饱和溶液均升温到t2℃,能析出晶体的是丙
C.将甲的饱和溶液从t1℃升高到t2℃,溶液中溶质的质量分数变为28.6%
D.t3℃时,将20g乙加入到50g水中充分搅拌后剩余5g乙未溶解
11.20℃时、向50g水中加入20g氯化钠,充分溶解后,得到溶液的质量为68g,则20℃时氯化钠的溶解度为_________g,所得溶液溶质的质量分数为_________(结果保留一位小数)。
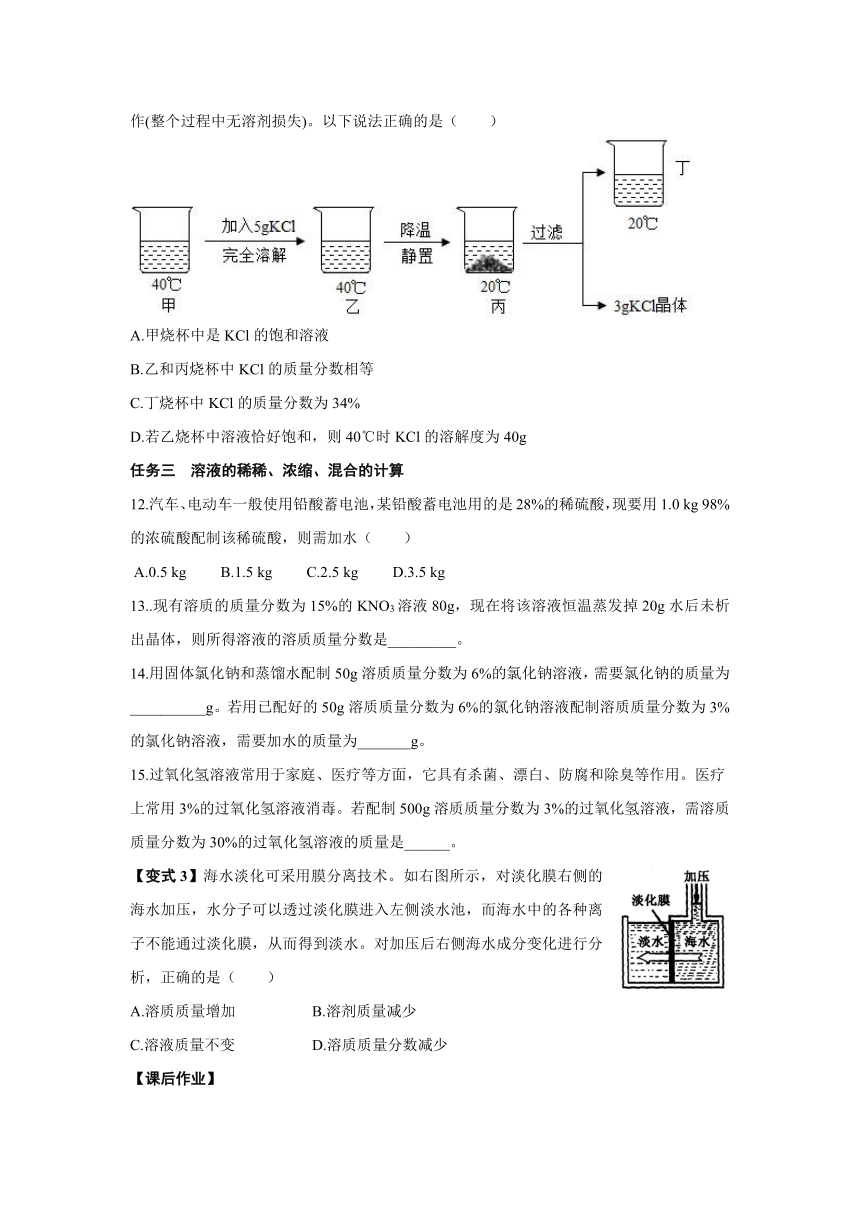
【变式2】20℃时KCl的溶解度是34g。取65gKCl溶液放入甲烧杯中,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是( )
A.甲烧杯中是KCl的饱和溶液
B.乙和丙烧杯中KCl的质量分数相等
C.丁烧杯中KCl的质量分数为34%
D.若乙烧杯中溶液恰好饱和,则40℃时KCl的溶解度为40g
任务三 溶液的稀稀、浓缩、混合的计算
12.汽车、电动车一般使用铅酸蓄电池,某铅酸蓄电池用的是28%的稀硫酸,现要用1.0 kg 98%的浓硫酸配制该稀硫酸,则需加水( )
A.0.5 kg B.1.5 kg C.2.5 kg D.3.5 kg
13..现有溶质的质量分数为15%的KNO3溶液80g,现在将该溶液恒温蒸发掉20g水后未析出晶体,则所得溶液的溶质质量分数是_________。
14.用固体氯化钠和蒸馏水配制50g溶质质量分数为6%的氯化钠溶液,需要氯化钠的质量为__________g。若用已配好的50g溶质质量分数为6%的氯化钠溶液配制溶质质量分数为3%的氯化钠溶液,需要加水的质量为_______g。
15.过氧化氢溶液常用于家庭、医疗等方面,它具有杀菌、漂白、防腐和除臭等作用。医疗上常用3%的过氧化氢溶液消毒。若配制500g溶质质量分数为3%的过氧化氢溶液,需溶质质量分数为30%的过氧化氢溶液的质量是______。
【变式3】海水淡化可采用膜分离技术。如右图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各种离子不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化进行分析,正确的是( )
A.溶质质量增加 B.溶剂质量减少
C.溶液质量不变 D.溶质质量分数减少
【课后作业】
1.按下列方法配制的溶液,其溶质质量分数为5%的是( )
A.称取5.0g氯化钾,溶解在95mL水中,充分搅拌
B.称取5.0g生石灰,放入95mL水中,充分搅拌
C.量取5.0mL浓盐酸,倒入95mL水中,充分搅拌
D.称取5.0g二氧化锰,放入95mL水中,充分搅拌
2.下列条件中的氢氧化钙溶液,溶质质量分数最大的是( )
A.30℃的饱和溶液
B.30℃的不饱和溶液
C.90℃的不饱和溶液
D.90℃的饱和溶液
3.20℃时,取四份一定质量的饱和硝酸钾溶液进行如下实验后,所得结论正确的是( )
A.保持温度不变,减少10g溶剂后,溶液中溶质的质量分数增大
B.保持温度不变,加入10g溶质后,溶液中溶质的质量分数增大
C.保持温度不变,加入10g溶剂后,溶质的溶解度减小
D.降温至10℃后,溶质的溶解度减小
4. A、B、C三种固体物质的溶解度曲线如图所示,下列说法正确的是( )
A.阴影区域中,A、C均处于不饱和状态
B.除去B固体中含有的少量A杂质,可采用配成热饱和溶液,降温结晶、过滤、洗涤、干燥的方法提纯B
C.将A和B的饱和溶液从t2℃降到t1℃时,析出晶体的质量关系为A>B
D.t1℃时,将50g固体A加入到200g水中,所得溶液溶质的质量分数约为16.7%
5.在80g质量分数为15%硝酸钠溶液里加入20g水或再溶解20g硝酸钠,则两种溶液中溶质质量分数分别为_______和_______。
6.25gKNO3完全溶于100g水中,所得溶液分为五等份。
(1)每一份溶液中溶质的质量分数为_______。
(2)向第一份溶液中加入15g水后,溶液中KNO3的质量分数为_______。
(3)向第二份溶液中加15 g KNO3并全部溶解,所得溶液中KNO3的质量分数为_______。
(4)若将第三份溶液变为10%的溶液,可采取的措施是_______。
(5)若将第四份溶液变为40%的溶液,可加热蒸发_______水。(无KNO3晶体析出)
7.下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
温度/℃ 0 20 40 60 80 100
溶解度/g Ca(OH)2 0.19 0.17 0.14 0.12 0.09 0.08
NaOH 31 91 111 129 313 336
(1)依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,下图中能表示NaOH溶解度曲线的是 (填A或B)。
(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
①加入氢氧化钙,②升高温度,③降低温度,④加入水,⑤蒸发水后再恢复到原温度,⑥加入生石灰。
其中措施正确的是 。
(3)20℃时,191g 饱和NaOH溶液,蒸发10g水后,再降温到20℃,可析出NaOH晶体的质量为 。
(4)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液中溶质的质量分数 乙 甲(填“>”、“<”或“=”)。
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是 。
8.常温下,将20g质量分数为14%的KNO3溶液与30g质量分数为24%的KNO3溶液混合,得到混合溶液。求:
(1)混合后溶液的溶质质量。
(2)混合后溶液的溶质质量分数。
【评价与反思】___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
参考答案
【学习活动】1.溶质质量 溶液质量 溶质 溶剂 2.B 3.B 4.4.5 500 5.(1)96 (2)120 【变式1】D 6.溶解度 越大 7.A 8.B 9.C 10.C 11.36 26.5% 【变式2】D 12.C 13.20% 14.3g 50g 15.50g 【变式3】B
【课后作业】1.A 2.A 3.D 4.D 5.12% 32% 6.(1)20% (2)12.5% (3)50% (4)加入25g水(合理即可) (5)12.5g 7.(1)A(2)①②⑤⑥ (3)9.1g(4)=(5)升高温度后,进行过滤 8.(1)10g (2)20%
【课时目标】
1.认识溶质的质量分数的含义。
2.通过溶质的质量分数的简单计算,使学生掌握基本的解题方法,提高学生的解题能力。
3.让学生在练习计算的过程中,了解溶液与生产、生活的广泛联系,了解学习化学的最终目标是为社会服务。
重点:溶液的浓度的概念。
难点:有关溶质质量分数的简单计算。
【学习活动】
任务一 溶质质量分数及简单计算
1.溶液中溶质的质量分数是指_________与_________之比,计算公式为:溶质的质量分数=×100%,其中溶液质量包括_________质量和_________质量。
2.关于100 g 5%的氯化钠溶液,下列叙述正确的是( )
A.100 g水中溶有5 g氯化钠
B.将5 g氯化钠溶于95 g水中,可制得该溶液
C溶液中氯化钠与水的质量比为1:20
D.105 g该溶液中溶有5 g氯化钠
3.某溶液中溶质的质量分数为20%,则下列质量比关系不正确的是( )
A.溶质:溶剂=1:4 B.溶质:溶剂=1:5
C.溶剂:溶液=4:5 D.溶质:溶液=1:5
4.在实验室中,配制溶质质量分数为10%的氯化钠溶液45 g,需要氯化钠固体的质量是______g。将45 g 10%的氯化钠溶液配成含氯化钠为0.9%的溶液,得到氯化钠溶液的质量是______g。
5.用4g酚酞与酒精配制溶质质量分数为4%的酚酞溶液,需要酒精的质量是_________g,这些酒精的体积为_________mL(酒精的密度为0.8g/mL)。
【变式1】将某温度下热的硝酸钾饱和溶液逐渐冷却至室温,下列有关量随时间变化趋势的图像不正确的是( )
任务二 溶质质量分数与溶解度的关系
6.在一定温度下的饱和溶液中,溶质的质量分数=×100%,物质溶解度越大,其饱和溶液的溶质质量分数_________。
7.已知20℃硝酸钾的溶解度为31.6g。在该温度下将20g硝酸钾放入50g水中,充分搅拌,则所得溶液中溶质的质量分数约为( )
A.24.0% B.28.6% C.31.6% D.40.0%
8.25℃时,硝酸钾饱和溶液中溶质的质量分数为30%,则25℃时,硝酸钾的溶解度为( )
A.30g B.42.9g C.23g D.无法计算
9.某温度下,在100g质量分数为20%的KNO3不饱和溶液甲中加入10gKNO3固体,恰好得到饱和溶液乙,下列说法正确的是( )
A.该温度下,KNO3的溶解度为30g
B.乙溶液的质量分数为30%
C.降低温度,可以使甲溶液变成饱和溶液
D.升高温度,甲、乙两溶液的质量分数都增大
10.甲、乙、丙三种固体物质溶解度曲线如下图所示。下列说法错误的是( )
A.t1℃时,甲、乙的溶解度都是25g
B.t1℃时,将三种物质的饱和溶液均升温到t2℃,能析出晶体的是丙
C.将甲的饱和溶液从t1℃升高到t2℃,溶液中溶质的质量分数变为28.6%
D.t3℃时,将20g乙加入到50g水中充分搅拌后剩余5g乙未溶解
11.20℃时、向50g水中加入20g氯化钠,充分溶解后,得到溶液的质量为68g,则20℃时氯化钠的溶解度为_________g,所得溶液溶质的质量分数为_________(结果保留一位小数)。
【变式2】20℃时KCl的溶解度是34g。取65gKCl溶液放入甲烧杯中,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是( )
A.甲烧杯中是KCl的饱和溶液
B.乙和丙烧杯中KCl的质量分数相等
C.丁烧杯中KCl的质量分数为34%
D.若乙烧杯中溶液恰好饱和,则40℃时KCl的溶解度为40g
任务三 溶液的稀稀、浓缩、混合的计算
12.汽车、电动车一般使用铅酸蓄电池,某铅酸蓄电池用的是28%的稀硫酸,现要用1.0 kg 98%的浓硫酸配制该稀硫酸,则需加水( )
A.0.5 kg B.1.5 kg C.2.5 kg D.3.5 kg
13..现有溶质的质量分数为15%的KNO3溶液80g,现在将该溶液恒温蒸发掉20g水后未析出晶体,则所得溶液的溶质质量分数是_________。
14.用固体氯化钠和蒸馏水配制50g溶质质量分数为6%的氯化钠溶液,需要氯化钠的质量为__________g。若用已配好的50g溶质质量分数为6%的氯化钠溶液配制溶质质量分数为3%的氯化钠溶液,需要加水的质量为_______g。
15.过氧化氢溶液常用于家庭、医疗等方面,它具有杀菌、漂白、防腐和除臭等作用。医疗上常用3%的过氧化氢溶液消毒。若配制500g溶质质量分数为3%的过氧化氢溶液,需溶质质量分数为30%的过氧化氢溶液的质量是______。
【变式3】海水淡化可采用膜分离技术。如右图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各种离子不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化进行分析,正确的是( )
A.溶质质量增加 B.溶剂质量减少
C.溶液质量不变 D.溶质质量分数减少
【课后作业】
1.按下列方法配制的溶液,其溶质质量分数为5%的是( )
A.称取5.0g氯化钾,溶解在95mL水中,充分搅拌
B.称取5.0g生石灰,放入95mL水中,充分搅拌
C.量取5.0mL浓盐酸,倒入95mL水中,充分搅拌
D.称取5.0g二氧化锰,放入95mL水中,充分搅拌
2.下列条件中的氢氧化钙溶液,溶质质量分数最大的是( )
A.30℃的饱和溶液
B.30℃的不饱和溶液
C.90℃的不饱和溶液
D.90℃的饱和溶液
3.20℃时,取四份一定质量的饱和硝酸钾溶液进行如下实验后,所得结论正确的是( )
A.保持温度不变,减少10g溶剂后,溶液中溶质的质量分数增大
B.保持温度不变,加入10g溶质后,溶液中溶质的质量分数增大
C.保持温度不变,加入10g溶剂后,溶质的溶解度减小
D.降温至10℃后,溶质的溶解度减小
4. A、B、C三种固体物质的溶解度曲线如图所示,下列说法正确的是( )
A.阴影区域中,A、C均处于不饱和状态
B.除去B固体中含有的少量A杂质,可采用配成热饱和溶液,降温结晶、过滤、洗涤、干燥的方法提纯B
C.将A和B的饱和溶液从t2℃降到t1℃时,析出晶体的质量关系为A>B
D.t1℃时,将50g固体A加入到200g水中,所得溶液溶质的质量分数约为16.7%
5.在80g质量分数为15%硝酸钠溶液里加入20g水或再溶解20g硝酸钠,则两种溶液中溶质质量分数分别为_______和_______。
6.25gKNO3完全溶于100g水中,所得溶液分为五等份。
(1)每一份溶液中溶质的质量分数为_______。
(2)向第一份溶液中加入15g水后,溶液中KNO3的质量分数为_______。
(3)向第二份溶液中加15 g KNO3并全部溶解,所得溶液中KNO3的质量分数为_______。
(4)若将第三份溶液变为10%的溶液,可采取的措施是_______。
(5)若将第四份溶液变为40%的溶液,可加热蒸发_______水。(无KNO3晶体析出)
7.下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
温度/℃ 0 20 40 60 80 100
溶解度/g Ca(OH)2 0.19 0.17 0.14 0.12 0.09 0.08
NaOH 31 91 111 129 313 336
(1)依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,下图中能表示NaOH溶解度曲线的是 (填A或B)。
(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
①加入氢氧化钙,②升高温度,③降低温度,④加入水,⑤蒸发水后再恢复到原温度,⑥加入生石灰。
其中措施正确的是 。
(3)20℃时,191g 饱和NaOH溶液,蒸发10g水后,再降温到20℃,可析出NaOH晶体的质量为 。
(4)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液中溶质的质量分数 乙 甲(填“>”、“<”或“=”)。
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是 。
8.常温下,将20g质量分数为14%的KNO3溶液与30g质量分数为24%的KNO3溶液混合,得到混合溶液。求:
(1)混合后溶液的溶质质量。
(2)混合后溶液的溶质质量分数。
【评价与反思】___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
参考答案
【学习活动】1.溶质质量 溶液质量 溶质 溶剂 2.B 3.B 4.4.5 500 5.(1)96 (2)120 【变式1】D 6.溶解度 越大 7.A 8.B 9.C 10.C 11.36 26.5% 【变式2】D 12.C 13.20% 14.3g 50g 15.50g 【变式3】B
【课后作业】1.A 2.A 3.D 4.D 5.12% 32% 6.(1)20% (2)12.5% (3)50% (4)加入25g水(合理即可) (5)12.5g 7.(1)A(2)①②⑤⑥ (3)9.1g(4)=(5)升高温度后,进行过滤 8.(1)10g (2)20%
同课章节目录
