3.1 物质的聚集状态与晶体常识 第2课时 课件(23张PPT)-2022-2023学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.1 物质的聚集状态与晶体常识 第2课时 课件(23张PPT)-2022-2023学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-12 21:46:28 | ||
图片预览



文档简介
(共23张PPT)
第2课时 物质的聚集状态与晶体的常识
第三章 晶体结构与性质 第一节 物质的聚集状态与晶体的常识
温故知新
1. 通过上节课的学习,晶体最本质的特征是什么?
晶体最本质的特征是微观结上原子在三维空间里呈周期性有序排列。
2. 对于有周期性变化研究对象,我们一般怎样去简化模型,方便进一步研究它?提示:回忆数学中研究sin x和cos x的方法。
对于周期性变化的研究对象,我们可以先找到它的最小重复单位,研究它在一个周期内性质,再结合周期性将这个性质拓展到全空间。
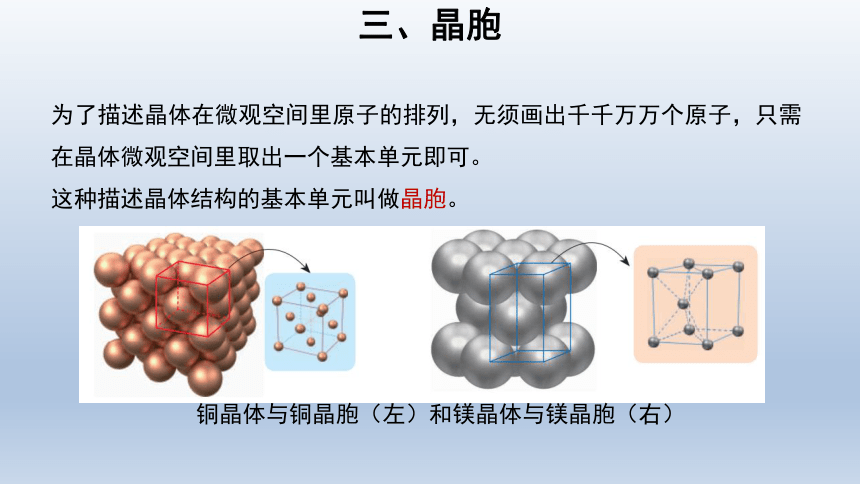
三、晶胞
为了描述晶体在微观空间里原子的排列,无须画出千千万万个原子,只需在晶体微观空间里取出一个基本单元即可。
这种描述晶体结构的基本单元叫做晶胞。
铜晶体与铜晶胞(左)和镁晶体与镁晶胞(右)
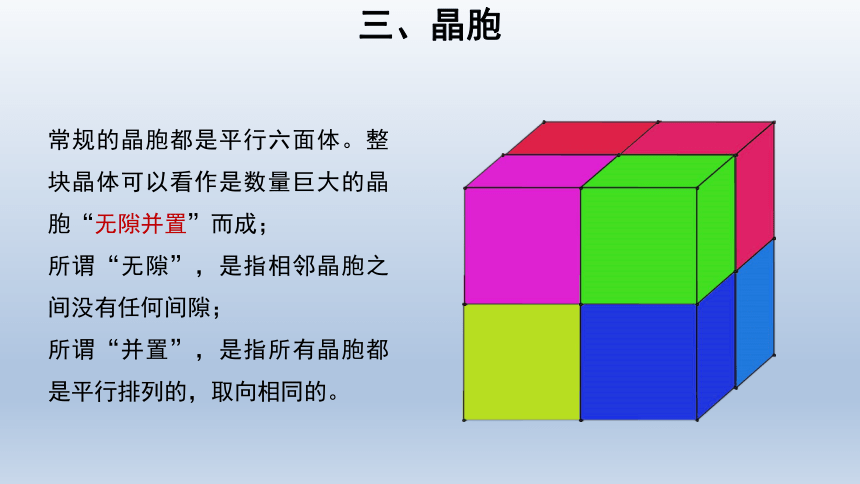
三、晶胞
常规的晶胞都是平行六面体。整块晶体可以看作是数量巨大的晶胞“无隙并置”而成;
所谓“无隙”,是指相邻晶胞之间没有任何间隙;
所谓“并置”,是指所有晶胞都是平行排列的,取向相同的。
三、晶胞
(1)依照晶胞的定义和其“无隙并置”的特征,你认为晶胞有几套平行的棱?有几套平行面?顶点应满足怎样的条件?
【思考讨论】
晶胞有三套平行棱,三套平行面,八个顶角必须完全相同。
右侧示意图中,红、黄、蓝分别表示的为三套平行的棱,每套4条棱;
上面下面、左面右面、前面后面分别为三套平行的面。
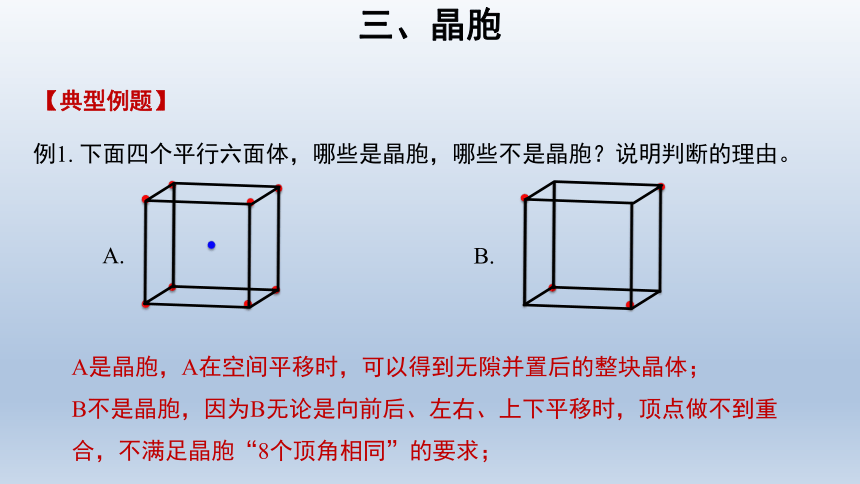
三、晶胞
例1. 下面四个平行六面体,哪些是晶胞,哪些不是晶胞?说明判断的理由。
【典型例题】
A是晶胞,A在空间平移时,可以得到无隙并置后的整块晶体;
B不是晶胞,因为B无论是向前后、左右、上下平移时,顶点做不到重合,不满足晶胞“8个顶角相同”的要求;
A.
B.
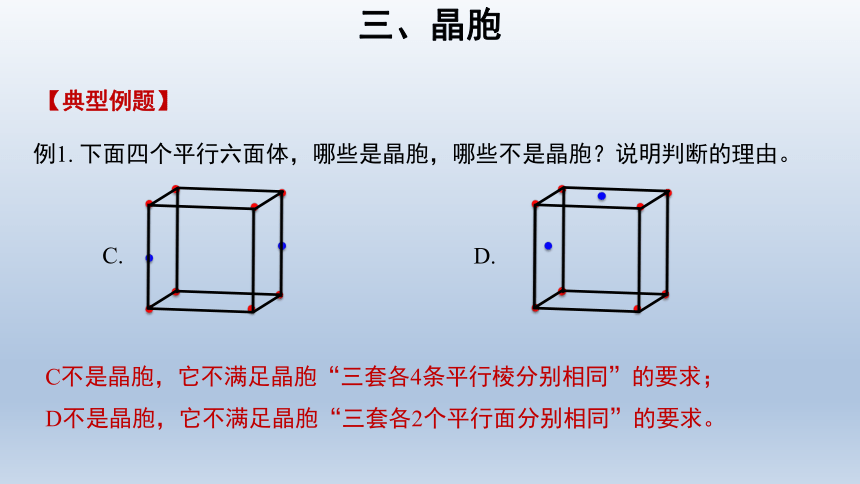
三、晶胞
例1. 下面四个平行六面体,哪些是晶胞,哪些不是晶胞?说明判断的理由。
【典型例题】
C不是晶胞,它不满足晶胞“三套各4条平行棱分别相同”的要求;
D不是晶胞,它不满足晶胞“三套各2个平行面分别相同”的要求。
C.
D.
三、晶胞
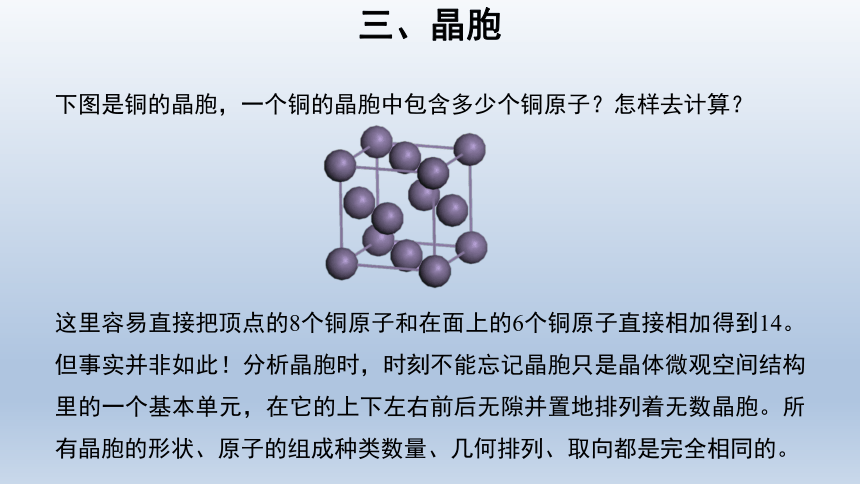
下图是铜的晶胞,一个铜的晶胞中包含多少个铜原子?怎样去计算?
这里容易直接把顶点的8个铜原子和在面上的6个铜原子直接相加得到14。但事实并非如此!分析晶胞时,时刻不能忘记晶胞只是晶体微观空间结构里的一个基本单元,在它的上下左右前后无隙并置地排列着无数晶胞。所有晶胞的形状、原子的组成种类数量、几何排列、取向都是完全相同的。
三、晶胞
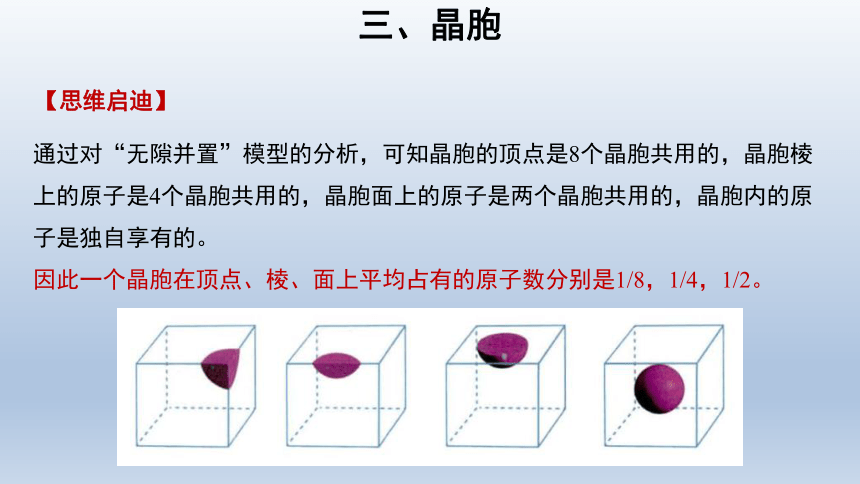
通过对“无隙并置”模型的分析,可知晶胞的顶点是8个晶胞共用的,晶胞棱上的原子是4个晶胞共用的,晶胞面上的原子是两个晶胞共用的,晶胞内的原子是独自享有的。
因此一个晶胞在顶点、棱、面上平均占有的原子数分别是1/8,1/4,1/2。
【思维启迪】
三、晶胞
综合上述分析,一个铜晶胞实际包含的原子如下图所示:
因此一个铜晶胞包含的原子数 = 8×1/8 + 6 × 1/2 = 4
三、晶胞
例2. 下图是NaCl的晶胞,它含有几个钠原子和氯离子?顶点和面心是氯原子,棱心和体心是钠原子。
【典型例题】
Na的个数 = 12 × 1/4 + 1 = 4 个;
Cl 的个数 = 8×1/8 + 6 × 1/2 = 4个。
三、晶胞
(2)下面依次是金属钠,金属锌,碘,金刚石晶胞的示意图,每个晶胞中平均含几个原子?
【思考讨论】
Na的原子数 = 8 × 1/8 + 1 = 2 个; Zn的原子数 = 8 × 1/8 + 1 = 2 个;
I 的原子数 = (8×1/8 + 6 × 1/2)× 2 = 8个。
C的原子数 = 8×1/8 + 6 × 1/2 + 4 = 8个。
四、晶体结构的测定
晶体结构是如何测定的呢?
测定晶体结构最常用的仪器是X射线衍射仪。
四、晶体结构的测定
在晶体的X射线衍射实验中,当单一波长的X射线通过晶体时,X射线和晶体中的电子相互作用,会在记录仪上产生分立的斑点或明锐的衍射峰。
单晶衍射图
四、晶体结构的测定
而在同一条件下摄取的非晶体图谱中却看不到分立的斑点或明锐的衍射峰。
例如,石英玻璃(非晶态二氧化硅)和水晶(晶态的二氧化硅)研成粉末摄取的X射线衍射图谱是不同的。
四、晶体结构的测定
通过晶体的X射线衍射实验获得衍射图后,经过计算可从衍射图形获得晶体结构的有关信息,包括晶胞形状和大小,分子或原子在微观空间有序排列呈现的对称类型、原子在晶胞里的数目和位置等,以及结合晶体化学组成的信息推出原子之间的相互关系。
例如,通过晶体X射线衍射实验,对乙酸晶体进行测定,可以得出乙酸晶胞中含有4个乙酸分子。
四、晶体结构的测定
乙酸晶体和乙酸晶胞
四、晶体结构的测定
测定晶胞中各个原子的位置(坐标),根据原子坐标,可以计算原子间的距离,判断出晶体中哪些原子之间存在化学键,确定键长和键角,从而得出分子的空间结构。
从不同角度观察的乙酸分子的空间结构
课堂小结
1. 晶胞是描述晶体结构的基本重复单元。将晶胞在空间上无隙并置即可得到整块晶体。
2. 晶胞是8个顶点相同、三套各4条平行棱分别相同、三套各两个平行面分别相同的最小平行六面体。
3. 一个晶胞平均占有的原子数 = 晶胞顶点的原子数 × 1/8 + 晶胞棱上的原子数 × 1/4 + 晶胞面上的原子数 × 1/2 + 晶胞体内的原子数 × 1。
4. 分子是有空间结构的,分子的空间结构是可以通过实验测定的,测定晶体结构最常用的仪器是X射线衍射仪。晶体和非晶体的衍射图谱是不同的。
课堂练习
1. 下列有关晶胞的叙述中不正确的是( )
A. 晶胞是晶体最小的结构重复单元
B. 不同的晶体中晶胞的大小和形状都相同
C. 晶胞中的粒子可能不完全属于该晶胞
D. 已知晶胞的组成就可推知晶体的组成
B
解析 B项,不同的晶体其组成粒子可以不同、粒子数量、粒子大小、排列方式、取向等等也都可以彼此不同,故不同晶体的晶胞大小不相同。
晶胞的形状都是平行六面体,这一点是相同的。
课堂练习
2.某种含 B 和 N 两种元素的功能陶瓷,其原子在晶胞中所处的位置如图所示。请计算每个晶胞中包含的 B 原子的个数,并确定该功能陶瓷的化学式。
2个B原子,化学式BN
解析 一个晶胞中B原子数 = 8 × 1/8 + 1 = 2 个
N原子数= 4 × 1/4 + 1 = 2 个
该晶胞无隙并置下去,则得到由2n个B和2n个N组成的陶瓷晶体,B和N的个数比为1:1,故化学式为BN。
课堂练习
3. 只含有镁、镍、碳三种元素的晶体具有超导性,因这三种元素都是常见元素,从引起广泛关注。该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为( )
A. Mg2CNi3 B. MgCNi3
C. MgCNi2 D. MgC2Ni
B
解析 晶胞中Mg原子数 = 8 × 1/8 = 1;Ni原子数 = 6 × 1/2 = 3;
C原子数 = 1 ,故化学式为MgCNi3。
再 见
第2课时 物质的聚集状态与晶体的常识
第三章 晶体结构与性质 第一节 物质的聚集状态与晶体的常识
温故知新
1. 通过上节课的学习,晶体最本质的特征是什么?
晶体最本质的特征是微观结上原子在三维空间里呈周期性有序排列。
2. 对于有周期性变化研究对象,我们一般怎样去简化模型,方便进一步研究它?提示:回忆数学中研究sin x和cos x的方法。
对于周期性变化的研究对象,我们可以先找到它的最小重复单位,研究它在一个周期内性质,再结合周期性将这个性质拓展到全空间。
三、晶胞
为了描述晶体在微观空间里原子的排列,无须画出千千万万个原子,只需在晶体微观空间里取出一个基本单元即可。
这种描述晶体结构的基本单元叫做晶胞。
铜晶体与铜晶胞(左)和镁晶体与镁晶胞(右)
三、晶胞
常规的晶胞都是平行六面体。整块晶体可以看作是数量巨大的晶胞“无隙并置”而成;
所谓“无隙”,是指相邻晶胞之间没有任何间隙;
所谓“并置”,是指所有晶胞都是平行排列的,取向相同的。
三、晶胞
(1)依照晶胞的定义和其“无隙并置”的特征,你认为晶胞有几套平行的棱?有几套平行面?顶点应满足怎样的条件?
【思考讨论】
晶胞有三套平行棱,三套平行面,八个顶角必须完全相同。
右侧示意图中,红、黄、蓝分别表示的为三套平行的棱,每套4条棱;
上面下面、左面右面、前面后面分别为三套平行的面。
三、晶胞
例1. 下面四个平行六面体,哪些是晶胞,哪些不是晶胞?说明判断的理由。
【典型例题】
A是晶胞,A在空间平移时,可以得到无隙并置后的整块晶体;
B不是晶胞,因为B无论是向前后、左右、上下平移时,顶点做不到重合,不满足晶胞“8个顶角相同”的要求;
A.
B.
三、晶胞
例1. 下面四个平行六面体,哪些是晶胞,哪些不是晶胞?说明判断的理由。
【典型例题】
C不是晶胞,它不满足晶胞“三套各4条平行棱分别相同”的要求;
D不是晶胞,它不满足晶胞“三套各2个平行面分别相同”的要求。
C.
D.
三、晶胞
下图是铜的晶胞,一个铜的晶胞中包含多少个铜原子?怎样去计算?
这里容易直接把顶点的8个铜原子和在面上的6个铜原子直接相加得到14。但事实并非如此!分析晶胞时,时刻不能忘记晶胞只是晶体微观空间结构里的一个基本单元,在它的上下左右前后无隙并置地排列着无数晶胞。所有晶胞的形状、原子的组成种类数量、几何排列、取向都是完全相同的。
三、晶胞
通过对“无隙并置”模型的分析,可知晶胞的顶点是8个晶胞共用的,晶胞棱上的原子是4个晶胞共用的,晶胞面上的原子是两个晶胞共用的,晶胞内的原子是独自享有的。
因此一个晶胞在顶点、棱、面上平均占有的原子数分别是1/8,1/4,1/2。
【思维启迪】
三、晶胞
综合上述分析,一个铜晶胞实际包含的原子如下图所示:
因此一个铜晶胞包含的原子数 = 8×1/8 + 6 × 1/2 = 4
三、晶胞
例2. 下图是NaCl的晶胞,它含有几个钠原子和氯离子?顶点和面心是氯原子,棱心和体心是钠原子。
【典型例题】
Na的个数 = 12 × 1/4 + 1 = 4 个;
Cl 的个数 = 8×1/8 + 6 × 1/2 = 4个。
三、晶胞
(2)下面依次是金属钠,金属锌,碘,金刚石晶胞的示意图,每个晶胞中平均含几个原子?
【思考讨论】
Na的原子数 = 8 × 1/8 + 1 = 2 个; Zn的原子数 = 8 × 1/8 + 1 = 2 个;
I 的原子数 = (8×1/8 + 6 × 1/2)× 2 = 8个。
C的原子数 = 8×1/8 + 6 × 1/2 + 4 = 8个。
四、晶体结构的测定
晶体结构是如何测定的呢?
测定晶体结构最常用的仪器是X射线衍射仪。
四、晶体结构的测定
在晶体的X射线衍射实验中,当单一波长的X射线通过晶体时,X射线和晶体中的电子相互作用,会在记录仪上产生分立的斑点或明锐的衍射峰。
单晶衍射图
四、晶体结构的测定
而在同一条件下摄取的非晶体图谱中却看不到分立的斑点或明锐的衍射峰。
例如,石英玻璃(非晶态二氧化硅)和水晶(晶态的二氧化硅)研成粉末摄取的X射线衍射图谱是不同的。
四、晶体结构的测定
通过晶体的X射线衍射实验获得衍射图后,经过计算可从衍射图形获得晶体结构的有关信息,包括晶胞形状和大小,分子或原子在微观空间有序排列呈现的对称类型、原子在晶胞里的数目和位置等,以及结合晶体化学组成的信息推出原子之间的相互关系。
例如,通过晶体X射线衍射实验,对乙酸晶体进行测定,可以得出乙酸晶胞中含有4个乙酸分子。
四、晶体结构的测定
乙酸晶体和乙酸晶胞
四、晶体结构的测定
测定晶胞中各个原子的位置(坐标),根据原子坐标,可以计算原子间的距离,判断出晶体中哪些原子之间存在化学键,确定键长和键角,从而得出分子的空间结构。
从不同角度观察的乙酸分子的空间结构
课堂小结
1. 晶胞是描述晶体结构的基本重复单元。将晶胞在空间上无隙并置即可得到整块晶体。
2. 晶胞是8个顶点相同、三套各4条平行棱分别相同、三套各两个平行面分别相同的最小平行六面体。
3. 一个晶胞平均占有的原子数 = 晶胞顶点的原子数 × 1/8 + 晶胞棱上的原子数 × 1/4 + 晶胞面上的原子数 × 1/2 + 晶胞体内的原子数 × 1。
4. 分子是有空间结构的,分子的空间结构是可以通过实验测定的,测定晶体结构最常用的仪器是X射线衍射仪。晶体和非晶体的衍射图谱是不同的。
课堂练习
1. 下列有关晶胞的叙述中不正确的是( )
A. 晶胞是晶体最小的结构重复单元
B. 不同的晶体中晶胞的大小和形状都相同
C. 晶胞中的粒子可能不完全属于该晶胞
D. 已知晶胞的组成就可推知晶体的组成
B
解析 B项,不同的晶体其组成粒子可以不同、粒子数量、粒子大小、排列方式、取向等等也都可以彼此不同,故不同晶体的晶胞大小不相同。
晶胞的形状都是平行六面体,这一点是相同的。
课堂练习
2.某种含 B 和 N 两种元素的功能陶瓷,其原子在晶胞中所处的位置如图所示。请计算每个晶胞中包含的 B 原子的个数,并确定该功能陶瓷的化学式。
2个B原子,化学式BN
解析 一个晶胞中B原子数 = 8 × 1/8 + 1 = 2 个
N原子数= 4 × 1/4 + 1 = 2 个
该晶胞无隙并置下去,则得到由2n个B和2n个N组成的陶瓷晶体,B和N的个数比为1:1,故化学式为BN。
课堂练习
3. 只含有镁、镍、碳三种元素的晶体具有超导性,因这三种元素都是常见元素,从引起广泛关注。该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为( )
A. Mg2CNi3 B. MgCNi3
C. MgCNi2 D. MgC2Ni
B
解析 晶胞中Mg原子数 = 8 × 1/8 = 1;Ni原子数 = 6 × 1/2 = 3;
C原子数 = 1 ,故化学式为MgCNi3。
再 见
