2022-2023学年高二上学期化学人教版(2019)选择性必修1第二章 第3节 化学反应的方向课件(28张PPT)
文档属性
| 名称 | 2022-2023学年高二上学期化学人教版(2019)选择性必修1第二章 第3节 化学反应的方向课件(28张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 32.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-12 21:42:36 | ||
图片预览







文档简介
(共28张PPT)
化学反应的方向
第二章 第3节
2019新人教版
选择性必修1·化学反应原理
海南中 HNM
瀑布流下
钢铁生锈
冰融为水
都是自然而然进行的
自发过程
自发过程:在一定条件下不需要外力作用就能进行的过程叫做自发过程。
思考
如何理解“自发”?是否意味着自发过程一定会发生?
“自发”应该理解为在给定的条件下,无需外界帮助,一经引发即能自动进行。
过程的自发性只决定该过程是否“能够”自发,但并不代表该过程“将会”发生。
思考
化学反应中是否也具有自发性呢?
Zn(s)+H2SO4(aq)==ZnSO4(aq)+H2(g)
CaCO3(s)+CO2(g)+H2O(l)==Ca(HCO3)2(aq)
自发反应:在给定的条件下,无需外界帮助,一经引发即能自动进行的反应,称为自发反应。
观察
什么样的化学反应是自发反应?
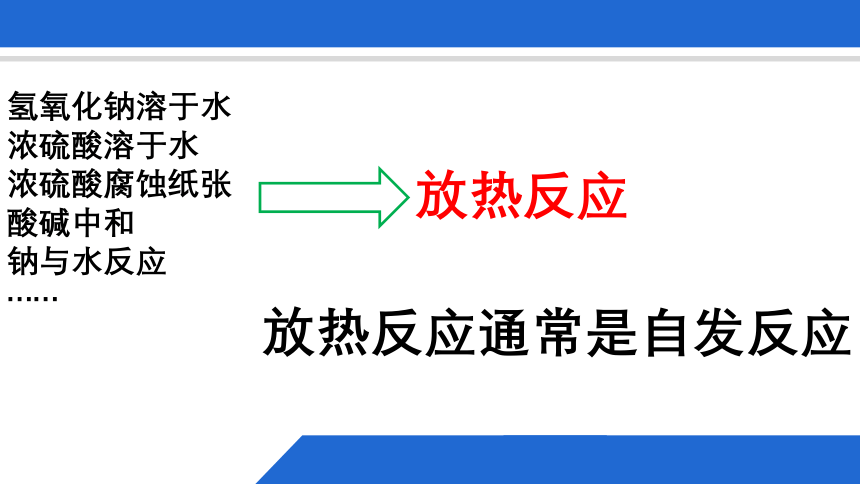
氢氧化钠溶于水
浓硫酸溶于水
浓硫酸腐蚀纸张
酸碱中和
钠与水反应
……
放热反应
放热反应通常是自发反应
思考
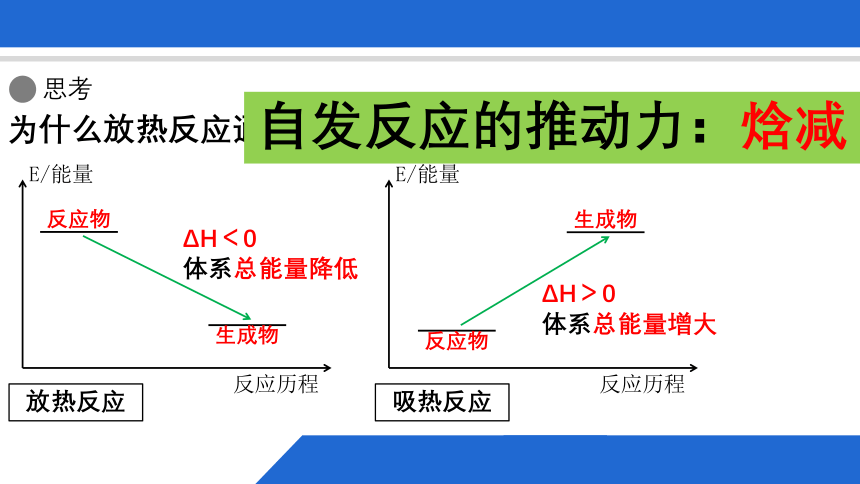
为什么放热反应通常是自发反应?
E/能量
反应历程
反应物
生成物
放热反应
ΔH<0
体系总能量降低
E/能量
反应历程
生成物
反应物
吸热反应
ΔH>0
体系总能量增大
自发反应的推动力:焓减
回忆
我们是否学过ΔH>0的自发反应?
Ba(OH)2·8H2O(s)+2NH4Cl(s)==BaCl2(s)+2NH3(g)+10H2O(s)
NaHCO3(s)+HCl(aq)==NaCl(aq)+H2O(l)+CO2(g)
思考
为什么ΔH>0的反应也可以自发进行?
探究
0.1molNa2CO3滴加过量盐酸
0.1molNaHCO3滴加过量盐酸
放出气泡,放热
放出气泡,吸热
探究
CO32-(aq)+H+(aq)==HCO3-(aq) ΔH1
HCO3-(aq)+H+(aq)==H2CO3(aq) ΔH2
H2CO3(aq)==H2O(l)+CO2(g) ΔH3
<0
<0
>0
动手
绘制Na2CO3和盐酸反应的能量-反应历程图
E/能量
反应历程
CO32-(aq)+H+(aq)
HCO3+(aq)+H+(aq)
H2CO3(aq)
H2O(l)+CO2(g)
ΔH1
ΔH2
ΔH3
探究
CO32-(aq)+H+(aq)==HCO3-(aq) ΔH1
HCO3-(aq)+H+(aq)==H2CO3(aq) ΔH2
H2CO3(aq)==H2O(l)+CO2(g) ΔH3
=-24.9KJ/mol
=-7.65KJ/mol
=+20.35KJ/mol
探究
气态物质中微粒的自由度最大,体系的无序程度最大
熵:状态函数。描述体系的无序程度。符号为S。单位
为J·mol-1·K-1
熵的变化用ΔS表示
熵值越大,无序程度越大。
自发反应的推动力:熵增
思考
熵有什么规律呢?
探究
物质 H2O Br2 Na I2
SmΘ 188.8(g) 70.0(l) 245.5(g) 152.2(l) 57.9(l) 51.3(s) 260.7(g)
116.1(s)
同一物质,气态时熵值最大,液态时次之,固态时熵值最小。
探究
对于有气体参加的反应,若反应后气体分子数增加,该反应的ΔS >0;若反应后气体分子数减少,该反应的ΔS<0;若反应前后气体分子数不变,该反应的ΔS变化很小。
①CaO(s)+SO3(g)==CaSO4(s) ΔS=-188J·mol-1·K-1
②2Fe2O3(s)+3C(s)==4Fe(s)+3CO2(g) ΔS=+559J·mol-1·K-1
③Fe2O3(s)+3CO(g)==2Fe(s)+3CO2(g) ΔS=+16J·mol-1·K-1
④N2(g)+O2(g)==2NO(g) ΔS=+25J·mol-1·K-1
探究
熵增是自然界的普遍规律
探究
4个气体分子在A、B两个容器中的分布情况。
1mol气体分子全部在
迁移
4个气体分子全部在A容器的概率多大?
A容器的概率多大?
孤立体系有自发倾向于混乱度增加(即熵增)的趋势
应用
工业上利用焦炭还原石英砂制粗硅
SiO2(s)+C(s)==Si(s)+CO2(g)
高温
SiO2(s)+2C(s)==Si(s)+2CO(g)
高温
应用
单质铝的制取
2Al2O3+6Cl2==4AlCl3+3O2 ΔH>0
高温
2C+O2==2CO ΔS>0
高温
Al2O3
Cl2
AlCl3
Na
Al
Al2O3+3Cl2+3C==2AlCl3+3CO
高温
探究
T>0℃
T<0℃
谁是自发的?
结冰
ΔH<0
ΔS<0
融化
ΔH>0
ΔS>0
谁在影响它自发?
探究
如何讨论一个反应的自发性?
将焓变与熵变结合起来
吉布斯(Gibbs)自由能:G=H-TS
ΔG=ΔH-TΔS
<0
>0
自发
>0
<0
不自发
<0
>0
>0
>0
<0
<0
高温有利
低温有利
=0
平衡态
实例
CaCO3(s)==CaO(s)+CO2(g) ΔH>0 ΔS>0
HCl(g)+NH3(g)==NH4Cl(s) ΔH<0 ΔS<0
高温分解,低温化合
高温分解,低温化合
应用
工业上制取钾单质
Na+KCl==NaCl+K
Na(l)+KCl(l)==NaCl(l)+K(g)
资料卡片
bp(Na)882.9℃
bp(K)759℃
应用
工业上由辉铜矿制铜单质
Cu2S(s)==2Cu(s)+S(s) ΔG=+86.2KJ/mol
S(s)+O2(g)==SO2(g) ΔG=-300.4KJ/mol
Cu2S+O2(g)==2Cu(s)+SO2(g) ΔG=
+86.2KJ/mol-300.4KJ/mol
=-214.2KJ/mol
总结
自发反应的推动力:焓减、熵增、自由能降低
ΔH
ΔS
ΔH>0
ΔS>0
高温有利
ΔH<0
ΔS>0
所有T下都自发
ΔH<0
ΔS<0
低温有利
ΔH>0
ΔS<0
所有T下都不自发
例题
(2021.浙江)
实验室可用铜与浓硫酸反应制备少量SO2:
Cu(s)+2H2SO4(l)==CuSO4(s)+SO2(g)+2H2O(l) ΔH=-11.9KJ/mol
判断该反应的自发性并说明理由_______。
不同温度下都能自发,因为ΔH<0,ΔS>0
思考
汽车尾气中的主要污染物是一氧化氮和一氧化碳,它们是现代化城市中的重要大气污染物。为了减轻大气污染,人们提出通过以下反应来处理汽车尾气的想法:
2NO(g)+2CO(g)==N(g)+2CO2(g)
请判断该想法是否可行,并说明理论依据。
化学反应的方向
第二章 第3节
2019新人教版
选择性必修1·化学反应原理
海南中 HNM
瀑布流下
钢铁生锈
冰融为水
都是自然而然进行的
自发过程
自发过程:在一定条件下不需要外力作用就能进行的过程叫做自发过程。
思考
如何理解“自发”?是否意味着自发过程一定会发生?
“自发”应该理解为在给定的条件下,无需外界帮助,一经引发即能自动进行。
过程的自发性只决定该过程是否“能够”自发,但并不代表该过程“将会”发生。
思考
化学反应中是否也具有自发性呢?
Zn(s)+H2SO4(aq)==ZnSO4(aq)+H2(g)
CaCO3(s)+CO2(g)+H2O(l)==Ca(HCO3)2(aq)
自发反应:在给定的条件下,无需外界帮助,一经引发即能自动进行的反应,称为自发反应。
观察
什么样的化学反应是自发反应?
氢氧化钠溶于水
浓硫酸溶于水
浓硫酸腐蚀纸张
酸碱中和
钠与水反应
……
放热反应
放热反应通常是自发反应
思考
为什么放热反应通常是自发反应?
E/能量
反应历程
反应物
生成物
放热反应
ΔH<0
体系总能量降低
E/能量
反应历程
生成物
反应物
吸热反应
ΔH>0
体系总能量增大
自发反应的推动力:焓减
回忆
我们是否学过ΔH>0的自发反应?
Ba(OH)2·8H2O(s)+2NH4Cl(s)==BaCl2(s)+2NH3(g)+10H2O(s)
NaHCO3(s)+HCl(aq)==NaCl(aq)+H2O(l)+CO2(g)
思考
为什么ΔH>0的反应也可以自发进行?
探究
0.1molNa2CO3滴加过量盐酸
0.1molNaHCO3滴加过量盐酸
放出气泡,放热
放出气泡,吸热
探究
CO32-(aq)+H+(aq)==HCO3-(aq) ΔH1
HCO3-(aq)+H+(aq)==H2CO3(aq) ΔH2
H2CO3(aq)==H2O(l)+CO2(g) ΔH3
<0
<0
>0
动手
绘制Na2CO3和盐酸反应的能量-反应历程图
E/能量
反应历程
CO32-(aq)+H+(aq)
HCO3+(aq)+H+(aq)
H2CO3(aq)
H2O(l)+CO2(g)
ΔH1
ΔH2
ΔH3
探究
CO32-(aq)+H+(aq)==HCO3-(aq) ΔH1
HCO3-(aq)+H+(aq)==H2CO3(aq) ΔH2
H2CO3(aq)==H2O(l)+CO2(g) ΔH3
=-24.9KJ/mol
=-7.65KJ/mol
=+20.35KJ/mol
探究
气态物质中微粒的自由度最大,体系的无序程度最大
熵:状态函数。描述体系的无序程度。符号为S。单位
为J·mol-1·K-1
熵的变化用ΔS表示
熵值越大,无序程度越大。
自发反应的推动力:熵增
思考
熵有什么规律呢?
探究
物质 H2O Br2 Na I2
SmΘ 188.8(g) 70.0(l) 245.5(g) 152.2(l) 57.9(l) 51.3(s) 260.7(g)
116.1(s)
同一物质,气态时熵值最大,液态时次之,固态时熵值最小。
探究
对于有气体参加的反应,若反应后气体分子数增加,该反应的ΔS >0;若反应后气体分子数减少,该反应的ΔS<0;若反应前后气体分子数不变,该反应的ΔS变化很小。
①CaO(s)+SO3(g)==CaSO4(s) ΔS=-188J·mol-1·K-1
②2Fe2O3(s)+3C(s)==4Fe(s)+3CO2(g) ΔS=+559J·mol-1·K-1
③Fe2O3(s)+3CO(g)==2Fe(s)+3CO2(g) ΔS=+16J·mol-1·K-1
④N2(g)+O2(g)==2NO(g) ΔS=+25J·mol-1·K-1
探究
熵增是自然界的普遍规律
探究
4个气体分子在A、B两个容器中的分布情况。
1mol气体分子全部在
迁移
4个气体分子全部在A容器的概率多大?
A容器的概率多大?
孤立体系有自发倾向于混乱度增加(即熵增)的趋势
应用
工业上利用焦炭还原石英砂制粗硅
SiO2(s)+C(s)==Si(s)+CO2(g)
高温
SiO2(s)+2C(s)==Si(s)+2CO(g)
高温
应用
单质铝的制取
2Al2O3+6Cl2==4AlCl3+3O2 ΔH>0
高温
2C+O2==2CO ΔS>0
高温
Al2O3
Cl2
AlCl3
Na
Al
Al2O3+3Cl2+3C==2AlCl3+3CO
高温
探究
T>0℃
T<0℃
谁是自发的?
结冰
ΔH<0
ΔS<0
融化
ΔH>0
ΔS>0
谁在影响它自发?
探究
如何讨论一个反应的自发性?
将焓变与熵变结合起来
吉布斯(Gibbs)自由能:G=H-TS
ΔG=ΔH-TΔS
<0
>0
自发
>0
<0
不自发
<0
>0
>0
>0
<0
<0
高温有利
低温有利
=0
平衡态
实例
CaCO3(s)==CaO(s)+CO2(g) ΔH>0 ΔS>0
HCl(g)+NH3(g)==NH4Cl(s) ΔH<0 ΔS<0
高温分解,低温化合
高温分解,低温化合
应用
工业上制取钾单质
Na+KCl==NaCl+K
Na(l)+KCl(l)==NaCl(l)+K(g)
资料卡片
bp(Na)882.9℃
bp(K)759℃
应用
工业上由辉铜矿制铜单质
Cu2S(s)==2Cu(s)+S(s) ΔG=+86.2KJ/mol
S(s)+O2(g)==SO2(g) ΔG=-300.4KJ/mol
Cu2S+O2(g)==2Cu(s)+SO2(g) ΔG=
+86.2KJ/mol-300.4KJ/mol
=-214.2KJ/mol
总结
自发反应的推动力:焓减、熵增、自由能降低
ΔH
ΔS
ΔH>0
ΔS>0
高温有利
ΔH<0
ΔS>0
所有T下都自发
ΔH<0
ΔS<0
低温有利
ΔH>0
ΔS<0
所有T下都不自发
例题
(2021.浙江)
实验室可用铜与浓硫酸反应制备少量SO2:
Cu(s)+2H2SO4(l)==CuSO4(s)+SO2(g)+2H2O(l) ΔH=-11.9KJ/mol
判断该反应的自发性并说明理由_______。
不同温度下都能自发,因为ΔH<0,ΔS>0
思考
汽车尾气中的主要污染物是一氧化氮和一氧化碳,它们是现代化城市中的重要大气污染物。为了减轻大气污染,人们提出通过以下反应来处理汽车尾气的想法:
2NO(g)+2CO(g)==N(g)+2CO2(g)
请判断该想法是否可行,并说明理论依据。
