第二节 金属的化学性质-九年级化学下册同步精品课堂(课件31页)(鲁教版)
文档属性
| 名称 | 第二节 金属的化学性质-九年级化学下册同步精品课堂(课件31页)(鲁教版) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-11 22:44:01 | ||
图片预览











文档简介
(共31张PPT)
第二节 金属的化学性质
第九单元 金属
PART
01
PART
02
知道镁、铝、铁、铜等常见金属与氧气的反应
认识常见金属与盐酸、硫酸及盐溶液的置换反应,并能解释日常生活中的一些现象
学习目标
PART
03
能说出常见金属的活动性顺序,了解金属活动性顺序的意义
金属元素的原子最外层电子数一般小于4个,越少越容易失去;最外层电子离原子核越远,电子受到的约束力就越小,越容易失去电子,也就越容易发生化学反应,金属的化学性质就越活泼。
【回顾思考1】镁条在空气中点燃有什么现象?
镁条燃烧,发出耀眼的白光,放出大量的热,生成白色固体。
2Mg+O2===2MgO
点燃
温故知新
一、金属与氧气的反应
铁丝在氧气中燃烧
3Fe + 2O2 === Fe3O4
点燃
铁在氧气中剧烈燃烧,火星四射,放出热量,生成黑色固体。
在加热时铜也可以和氧气反应
2Cu + O2 === 2CuO
△
【回顾思考2】铁丝在氧气中燃烧有什么现象?
【活动天地】用滤纸卷上少量铝粉,在酒精灯上点燃,迅速插入盛有氧气的集气瓶中观察有什么现象?
铝粉能在氧气中剧烈燃烧,发出白光,生成白色固体。
4Al+3O2 === 2Al2O3
点燃
【思考讨论1】俗话说“真金不怕火炼”,这说明了什么事实?
在高温条件下金不能和氧气反应。
Au + O2≠
高 温 炼 金
(1)4Al+3O2====2Al2O3
(2)2Cu+O2 2CuO
(3)2Mg+O2 ==== 2MgO
(4)Au + O2 →不反应
(5)3Fe+2O2 ==== Fe3O4
点燃
【思考讨论2】从以下方程式你能得到哪些信息?
点燃
===
△
点燃
实验表明,大多数金属都能与氧气发生反应,生成相应的金属氧化物,但反应的难易和剧烈程度是不相同的。
1.常温下易与氧气反应: 以 、 为代表。
2.加热时能与氧气反应:以 、 为代表。
3.高温下也不能与氧气反应:以 为代表。
Mg
Al
Fe
Cu
Au
【结论】金属活动性顺序:
Mg、Al>Fe、Cu>Au
【活动与探究1】探究镁、铝、铁、铜的活动性顺序
很多金属不仅能与氧气反应,而且还能与盐酸或稀硫酸反应。金属与盐酸或稀硫酸能否反应以及反应的剧烈程度,也可反映出金属的活泼程度。
A组:把镁、铝、铁、铜分别放入稀盐酸中。
B组:把镁、铝、铁、铜分别放入稀硫酸中。
二、金属与酸的反应
金属活动性顺序
Mg+HCl
Al+HCl
Fe+HCl
Cu+HCl
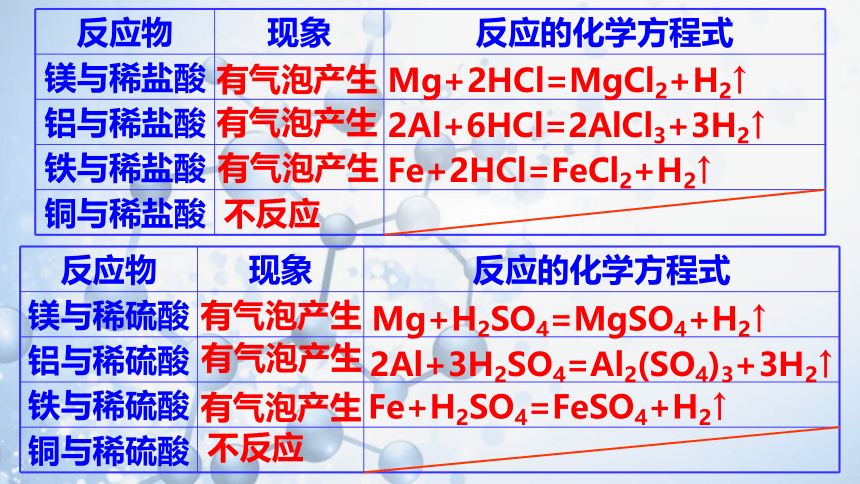
反应物 现象 反应的化学方程式
镁与稀盐酸
铝与稀盐酸
铁与稀盐酸
铜与稀盐酸
反应物 现象 反应的化学方程式
镁与稀硫酸
铝与稀硫酸
铁与稀硫酸
铜与稀硫酸
Mg+2HCl=MgCl2+H2↑
2Al+6HCl=2AlCl3+3H2↑
Fe+2HCl=FeCl2+H2↑
不反应
有气泡产生
有气泡产生
有气泡产生
不反应
有气泡产生
有气泡产生
有气泡产生
Mg+H2SO4=MgSO4+H2↑
2Al+3H2SO4=Al2(SO4)3+3H2↑
Fe+H2SO4=FeSO4+H2↑
金属与酸反应的剧烈程度
【实验现象】
铜与酸:不反应
铁与酸: 缓慢
铝与酸: 迅速
镁与酸: 剧烈
【探究结论】
1.并不是所有的金属都能与酸反应,而且反应的剧烈程度也不相同。
2.金属活动性顺序: 。
Mg> Al> Fe> Cu
挑战自我
【问题1】下列化学反应能发生吗?
Cu + HCl —— CuCl2 + H2↑
Mg + HCl —— MgCl2 + H2↑
Al + HCl —— AlCl3 + H2↑
【问题2】下列化学反应正确吗?
(1)铁 + 盐酸 —— 氯化铁 + 氢气
(2)锌 + 硝酸 —— 硝酸锌 + 氢气
×
应生成氯化亚铁
硝酸具有氧化性,与金属反应不生成氢气。
√
√
×
×
【活动天地】完成下列反应的化学方程式
Fe + HCl
Fe + H2SO4
Al + HCl
Al + H2SO4
2
6
FeCl2 + H2↑
2
FeSO4 + H2 ↑
2AlCl3 + 3H2↑
Al2(SO4)3 + 3H2 ↑
2
3
观察上述反应的化学方程式,分析这些反应有什么共同特点?
单质
化合物
单质
化合物
置换反应
A+BC=B+AC
【针对练习】判断下列反应的基本反应类型
1.2Mg+O2====2MgO
2.C+O2====CO2
3.2KClO3 ==== 2KCl+3O2 ↑
4.Fe+CuSO4 ==== FeSO4+Cu
5.2H2+O2 ==== 2H2O
6.H2+CuO ==== Cu+H2O
7.CuO+H2SO4====CuSO4+H2O
点燃
加热
点燃
点燃
化合反应
化合反应
化合反应
分解反应
置换反应
置换反应
复分解反应
加热
【提出问题】除了金属与盐酸或稀硫酸能否反应以及反
应的剧烈程度可比较金属的活动性以外,还有其他方法
吗
三、金属与盐溶液的反应
活动性较强的金属能与酸溶液中的氢离子发生置换反应,NaCl、CaCl2、CuSO4、AgNO3这些盐的溶液中都含有金属离子,这些离子能否与金属发生置换反应呢?
通过盐与金属是否发生置换反应我们也可以比较金属的活动性强弱。
【活动与探究】
探究钠、锌、铁、铜、银的活动性顺序
实验方案 现象 活动性 有关化学方程式
锌片浸入硫酸铜溶液中
锌片浸入硝酸银溶液中
锌片浸入氯化钠溶液中
锌片表面有紫红色物质析出
锌片表面有银白色物质析出
不反应
Zn>Cu
Zn>Ag
Na>Zn
Zn+CuSO4= ZnSO4 + Cu
Zn+2AgNO3= Zn(NO3)2+2Ag
实验方案 现象 活动性 有关化学方程式
铁丝浸入硫酸铜溶液中
铁丝浸入硝酸银溶液中
铁丝浸入氯化钠溶液中
铁丝表面有紫红色物质析出
铁丝表面有银白色物质析出
不反应
Fe>Cu
Fe>Ag
Fe+CuSO4
=FeSO4+Cu
Fe+2AgNO3=
Fe(NO3)2+2Ag
Na>Fe
实验方案 现象 活动性 有关化学方程式
铜丝浸入硝酸银溶液中
铜丝浸入氯化钠溶液中
铜丝表面有银白色物质析出
不反应
Cu>Ag
Cu+2AgNO3=
Cu(NO3)2+2Ag
Na>Cu
符号 :
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
名称:
金 属 活 动 性 由 强 逐 渐 减 弱
钾 钙 钠 镁 铝 锌 铁 锡 铅 (氢) 铜 汞 银 铂 金
(1)在金属活动性顺序里,金属的位置越靠前,它的活动性就越强;
(2)在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢 ;
(3)在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来。
(K、Ca、Na除外!)
(1)金属活动性是指金属原子在水溶液中失去电子的能力,金属的位置越靠前,金属在水溶液中就越容易失去电子变成离子,它的活动性就越强。
(2)排在氢前面的金属能置换出酸中的氢,这里的酸指盐酸和稀硫酸,而与浓硫酸和硝酸反应则不放出氢气。
金属活动性顺序规律注意事项:
(3)K、Ca、Na太活泼,与水反应,不能把排在后面的金属从它们的盐溶液中置换出来。
(4)Fe若参与反应,一定生成二价亚铁离子(Fe2+)。
(5)在金属活动顺序中距离远的优先置换(如将铁放在硝酸铜和硝酸银混合溶液中,铁先置换出银)。
典型例题
知识点一:金属的化学性质
【典例1】(2022包头)某同学绘制了含铁元素的部分物质转化关系图(图中“→”表示一种物质可以转化为另一种物质,部分反应物、生成物及反应条件已略去),下列说法正确的是( )
A.铁丝能在空气中剧烈燃烧实现转化①
B.转化②可通过Fe3O4与CO发生置换反应实现
C.氧气和水同时存在是实现转化③的主要条件
D.通过Fe与ZnSO4溶液反应可实现转化④
C
知识点二:金属的活动性顺序
【典例2】(2022湖北)实验课上,某同学将一定质量的镁粉加入到硫酸亚铁溶液中,待反应结束后,过滤,得到滤液和滤渣,下列判断正确的是( )
A.滤液中一定含有硫酸镁,可能含有硫酸亚铁
B.若滤液为浅绿色,则滤渣中一定含有镁和铁
C.向滤渣中加入稀盐酸,有气泡产生,则滤渣中一定含有镁
D.所得滤液的质量一定比原溶液的质量大
A
课堂达标
1. (2022新疆)下列金属活动性最强的是( )
A.铝 B.镁 C.铁 D.铜
2. (2022鸡西)现有X、Y、Z三种金属。如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应。如果Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化。根据以上实验事实,金属活泼性由强到弱( )
A.X>Y>Z B.Z>X>Y C.X>Z>Y D.Y>X>Z
B
A
3. (2022重庆)学会识图能发展科学思维。一小块未打磨的铝片和一定质量的稀盐酸反应,产生气泡的快慢和反应时间的关系如图。下列猜想正确的有( )
①0~t1阶段,可能是铝表面有层氧化膜
②t1~t2阶段,可能是铝和稀盐酸反应放出热量
③t3时刻,可能是稀盐酸过量
④t3时刻,可能是稀盐酸不足
A.1项 B.2项 C.3项 D.4项
D
4. (2022宜昌)向装有一定量硝酸铜和硝酸银混合溶液的试管中,缓慢加入细铁粉,充分反应。下列关于试管中物质的变化关系图错误的是( )
A. B.
C. D.
D
5. (2022重庆)钛合金、铝合金广泛应用于航空工业。
(1)下列矿石主要成分含相同金属元素的是 (填序号)。
A.磁铁矿 B.铝土矿 C.菱铁矿
(2)钛与盐酸反应:2Ti+6HCl═2X+3H2↑,则X化学式为 。若把钛放入硝酸银溶液中 (填“有”或“没有”)单质银析出。
(3)工业制铝原理为电解熔融的Al2O3,生成铝和一种可供呼吸的气体。该反应的化学方程式为 。
AC
TiCl3
2Al2O3 通电4Al+3O2↑
有
6.(2022陕西)白铜是铜、镍(Ni)合金,某学习小组同学欲利用废弃的白铜回收铜、镍两种金属。
(1)先向盛有等量镍粉和锌粉的两支试管中分别加入溶质质量分数相同的稀硫酸,观察到都有气泡产生,且锌粉与稀硫酸反应更剧烈,镍粉与稀硫酸反应后的溶液为绿色,说明镍的金属活动性比锌 (填“强”或“弱”)。查阅资料可知,镍与稀硫酸反应的化学方程式为:Ni+H2SO4═NiSO4+H2↑。
(2)接下来,同学们设计了如下
实验流程回收铜和镍。
如图中,固体A是 ,②
中反应的化学方程式是 (只写一个)。
(3)要验证Ni、Zn、Cu的金属活动性顺序,用下列各组药品进行实验,不能达到目的的是 (填字母)。
A.Ni、Zn、Cu、稀盐酸 B.Ni、Cu、ZnSO4溶液
C.Zn、Cu、NiSO4溶液 D.Ni、ZnSO4溶液、CuSO4溶液
弱
Cu
Zn+H2SO4═ZnSO4+H2↑
B
课堂小结
1.金属的化学性质:
(1)能与氧气反应 (化合反应)
(2)位于氢前面的金属能与酸反应 (置换反应)
(3)能与某些金属的盐溶液反应 (置换反应)
2.金属活动性顺序
3.置换反应:单质+化合物 新单质+新化合物
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
第二节 金属的化学性质
第九单元 金属
PART
01
PART
02
知道镁、铝、铁、铜等常见金属与氧气的反应
认识常见金属与盐酸、硫酸及盐溶液的置换反应,并能解释日常生活中的一些现象
学习目标
PART
03
能说出常见金属的活动性顺序,了解金属活动性顺序的意义
金属元素的原子最外层电子数一般小于4个,越少越容易失去;最外层电子离原子核越远,电子受到的约束力就越小,越容易失去电子,也就越容易发生化学反应,金属的化学性质就越活泼。
【回顾思考1】镁条在空气中点燃有什么现象?
镁条燃烧,发出耀眼的白光,放出大量的热,生成白色固体。
2Mg+O2===2MgO
点燃
温故知新
一、金属与氧气的反应
铁丝在氧气中燃烧
3Fe + 2O2 === Fe3O4
点燃
铁在氧气中剧烈燃烧,火星四射,放出热量,生成黑色固体。
在加热时铜也可以和氧气反应
2Cu + O2 === 2CuO
△
【回顾思考2】铁丝在氧气中燃烧有什么现象?
【活动天地】用滤纸卷上少量铝粉,在酒精灯上点燃,迅速插入盛有氧气的集气瓶中观察有什么现象?
铝粉能在氧气中剧烈燃烧,发出白光,生成白色固体。
4Al+3O2 === 2Al2O3
点燃
【思考讨论1】俗话说“真金不怕火炼”,这说明了什么事实?
在高温条件下金不能和氧气反应。
Au + O2≠
高 温 炼 金
(1)4Al+3O2====2Al2O3
(2)2Cu+O2 2CuO
(3)2Mg+O2 ==== 2MgO
(4)Au + O2 →不反应
(5)3Fe+2O2 ==== Fe3O4
点燃
【思考讨论2】从以下方程式你能得到哪些信息?
点燃
===
△
点燃
实验表明,大多数金属都能与氧气发生反应,生成相应的金属氧化物,但反应的难易和剧烈程度是不相同的。
1.常温下易与氧气反应: 以 、 为代表。
2.加热时能与氧气反应:以 、 为代表。
3.高温下也不能与氧气反应:以 为代表。
Mg
Al
Fe
Cu
Au
【结论】金属活动性顺序:
Mg、Al>Fe、Cu>Au
【活动与探究1】探究镁、铝、铁、铜的活动性顺序
很多金属不仅能与氧气反应,而且还能与盐酸或稀硫酸反应。金属与盐酸或稀硫酸能否反应以及反应的剧烈程度,也可反映出金属的活泼程度。
A组:把镁、铝、铁、铜分别放入稀盐酸中。
B组:把镁、铝、铁、铜分别放入稀硫酸中。
二、金属与酸的反应
金属活动性顺序
Mg+HCl
Al+HCl
Fe+HCl
Cu+HCl
反应物 现象 反应的化学方程式
镁与稀盐酸
铝与稀盐酸
铁与稀盐酸
铜与稀盐酸
反应物 现象 反应的化学方程式
镁与稀硫酸
铝与稀硫酸
铁与稀硫酸
铜与稀硫酸
Mg+2HCl=MgCl2+H2↑
2Al+6HCl=2AlCl3+3H2↑
Fe+2HCl=FeCl2+H2↑
不反应
有气泡产生
有气泡产生
有气泡产生
不反应
有气泡产生
有气泡产生
有气泡产生
Mg+H2SO4=MgSO4+H2↑
2Al+3H2SO4=Al2(SO4)3+3H2↑
Fe+H2SO4=FeSO4+H2↑
金属与酸反应的剧烈程度
【实验现象】
铜与酸:不反应
铁与酸: 缓慢
铝与酸: 迅速
镁与酸: 剧烈
【探究结论】
1.并不是所有的金属都能与酸反应,而且反应的剧烈程度也不相同。
2.金属活动性顺序: 。
Mg> Al> Fe> Cu
挑战自我
【问题1】下列化学反应能发生吗?
Cu + HCl —— CuCl2 + H2↑
Mg + HCl —— MgCl2 + H2↑
Al + HCl —— AlCl3 + H2↑
【问题2】下列化学反应正确吗?
(1)铁 + 盐酸 —— 氯化铁 + 氢气
(2)锌 + 硝酸 —— 硝酸锌 + 氢气
×
应生成氯化亚铁
硝酸具有氧化性,与金属反应不生成氢气。
√
√
×
×
【活动天地】完成下列反应的化学方程式
Fe + HCl
Fe + H2SO4
Al + HCl
Al + H2SO4
2
6
FeCl2 + H2↑
2
FeSO4 + H2 ↑
2AlCl3 + 3H2↑
Al2(SO4)3 + 3H2 ↑
2
3
观察上述反应的化学方程式,分析这些反应有什么共同特点?
单质
化合物
单质
化合物
置换反应
A+BC=B+AC
【针对练习】判断下列反应的基本反应类型
1.2Mg+O2====2MgO
2.C+O2====CO2
3.2KClO3 ==== 2KCl+3O2 ↑
4.Fe+CuSO4 ==== FeSO4+Cu
5.2H2+O2 ==== 2H2O
6.H2+CuO ==== Cu+H2O
7.CuO+H2SO4====CuSO4+H2O
点燃
加热
点燃
点燃
化合反应
化合反应
化合反应
分解反应
置换反应
置换反应
复分解反应
加热
【提出问题】除了金属与盐酸或稀硫酸能否反应以及反
应的剧烈程度可比较金属的活动性以外,还有其他方法
吗
三、金属与盐溶液的反应
活动性较强的金属能与酸溶液中的氢离子发生置换反应,NaCl、CaCl2、CuSO4、AgNO3这些盐的溶液中都含有金属离子,这些离子能否与金属发生置换反应呢?
通过盐与金属是否发生置换反应我们也可以比较金属的活动性强弱。
【活动与探究】
探究钠、锌、铁、铜、银的活动性顺序
实验方案 现象 活动性 有关化学方程式
锌片浸入硫酸铜溶液中
锌片浸入硝酸银溶液中
锌片浸入氯化钠溶液中
锌片表面有紫红色物质析出
锌片表面有银白色物质析出
不反应
Zn>Cu
Zn>Ag
Na>Zn
Zn+CuSO4= ZnSO4 + Cu
Zn+2AgNO3= Zn(NO3)2+2Ag
实验方案 现象 活动性 有关化学方程式
铁丝浸入硫酸铜溶液中
铁丝浸入硝酸银溶液中
铁丝浸入氯化钠溶液中
铁丝表面有紫红色物质析出
铁丝表面有银白色物质析出
不反应
Fe>Cu
Fe>Ag
Fe+CuSO4
=FeSO4+Cu
Fe+2AgNO3=
Fe(NO3)2+2Ag
Na>Fe
实验方案 现象 活动性 有关化学方程式
铜丝浸入硝酸银溶液中
铜丝浸入氯化钠溶液中
铜丝表面有银白色物质析出
不反应
Cu>Ag
Cu+2AgNO3=
Cu(NO3)2+2Ag
Na>Cu
符号 :
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
名称:
金 属 活 动 性 由 强 逐 渐 减 弱
钾 钙 钠 镁 铝 锌 铁 锡 铅 (氢) 铜 汞 银 铂 金
(1)在金属活动性顺序里,金属的位置越靠前,它的活动性就越强;
(2)在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢 ;
(3)在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来。
(K、Ca、Na除外!)
(1)金属活动性是指金属原子在水溶液中失去电子的能力,金属的位置越靠前,金属在水溶液中就越容易失去电子变成离子,它的活动性就越强。
(2)排在氢前面的金属能置换出酸中的氢,这里的酸指盐酸和稀硫酸,而与浓硫酸和硝酸反应则不放出氢气。
金属活动性顺序规律注意事项:
(3)K、Ca、Na太活泼,与水反应,不能把排在后面的金属从它们的盐溶液中置换出来。
(4)Fe若参与反应,一定生成二价亚铁离子(Fe2+)。
(5)在金属活动顺序中距离远的优先置换(如将铁放在硝酸铜和硝酸银混合溶液中,铁先置换出银)。
典型例题
知识点一:金属的化学性质
【典例1】(2022包头)某同学绘制了含铁元素的部分物质转化关系图(图中“→”表示一种物质可以转化为另一种物质,部分反应物、生成物及反应条件已略去),下列说法正确的是( )
A.铁丝能在空气中剧烈燃烧实现转化①
B.转化②可通过Fe3O4与CO发生置换反应实现
C.氧气和水同时存在是实现转化③的主要条件
D.通过Fe与ZnSO4溶液反应可实现转化④
C
知识点二:金属的活动性顺序
【典例2】(2022湖北)实验课上,某同学将一定质量的镁粉加入到硫酸亚铁溶液中,待反应结束后,过滤,得到滤液和滤渣,下列判断正确的是( )
A.滤液中一定含有硫酸镁,可能含有硫酸亚铁
B.若滤液为浅绿色,则滤渣中一定含有镁和铁
C.向滤渣中加入稀盐酸,有气泡产生,则滤渣中一定含有镁
D.所得滤液的质量一定比原溶液的质量大
A
课堂达标
1. (2022新疆)下列金属活动性最强的是( )
A.铝 B.镁 C.铁 D.铜
2. (2022鸡西)现有X、Y、Z三种金属。如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应。如果Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化。根据以上实验事实,金属活泼性由强到弱( )
A.X>Y>Z B.Z>X>Y C.X>Z>Y D.Y>X>Z
B
A
3. (2022重庆)学会识图能发展科学思维。一小块未打磨的铝片和一定质量的稀盐酸反应,产生气泡的快慢和反应时间的关系如图。下列猜想正确的有( )
①0~t1阶段,可能是铝表面有层氧化膜
②t1~t2阶段,可能是铝和稀盐酸反应放出热量
③t3时刻,可能是稀盐酸过量
④t3时刻,可能是稀盐酸不足
A.1项 B.2项 C.3项 D.4项
D
4. (2022宜昌)向装有一定量硝酸铜和硝酸银混合溶液的试管中,缓慢加入细铁粉,充分反应。下列关于试管中物质的变化关系图错误的是( )
A. B.
C. D.
D
5. (2022重庆)钛合金、铝合金广泛应用于航空工业。
(1)下列矿石主要成分含相同金属元素的是 (填序号)。
A.磁铁矿 B.铝土矿 C.菱铁矿
(2)钛与盐酸反应:2Ti+6HCl═2X+3H2↑,则X化学式为 。若把钛放入硝酸银溶液中 (填“有”或“没有”)单质银析出。
(3)工业制铝原理为电解熔融的Al2O3,生成铝和一种可供呼吸的气体。该反应的化学方程式为 。
AC
TiCl3
2Al2O3 通电4Al+3O2↑
有
6.(2022陕西)白铜是铜、镍(Ni)合金,某学习小组同学欲利用废弃的白铜回收铜、镍两种金属。
(1)先向盛有等量镍粉和锌粉的两支试管中分别加入溶质质量分数相同的稀硫酸,观察到都有气泡产生,且锌粉与稀硫酸反应更剧烈,镍粉与稀硫酸反应后的溶液为绿色,说明镍的金属活动性比锌 (填“强”或“弱”)。查阅资料可知,镍与稀硫酸反应的化学方程式为:Ni+H2SO4═NiSO4+H2↑。
(2)接下来,同学们设计了如下
实验流程回收铜和镍。
如图中,固体A是 ,②
中反应的化学方程式是 (只写一个)。
(3)要验证Ni、Zn、Cu的金属活动性顺序,用下列各组药品进行实验,不能达到目的的是 (填字母)。
A.Ni、Zn、Cu、稀盐酸 B.Ni、Cu、ZnSO4溶液
C.Zn、Cu、NiSO4溶液 D.Ni、ZnSO4溶液、CuSO4溶液
弱
Cu
Zn+H2SO4═ZnSO4+H2↑
B
课堂小结
1.金属的化学性质:
(1)能与氧气反应 (化合反应)
(2)位于氢前面的金属能与酸反应 (置换反应)
(3)能与某些金属的盐溶液反应 (置换反应)
2.金属活动性顺序
3.置换反应:单质+化合物 新单质+新化合物
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
