第六章第二节 化学反应的速率与限度第2课时 化学反应的限度 化学反应条件的控制 课件(共100张PPT)
文档属性
| 名称 | 第六章第二节 化学反应的速率与限度第2课时 化学反应的限度 化学反应条件的控制 课件(共100张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-12 11:21:28 | ||
图片预览










文档简介
(共100张PPT)
第二节 化学反应的速
率与限度
第2课时 化学反应的限度
化学反应条件的控制
第6章 化学反应与能量
【课程标准要求】
1.了解可逆反应及特点。
2.理解化学平衡状态的特征及标志,知道改变条件化学平衡会发生移动。
3.了解控制反应条件在生产、生活和科学研究中的作用。
新知自主预习
课堂互动探究
课时训练
目
录
CONTENTS
///////
///////
///////
课堂小结·即时达标
///////
微专题
///////
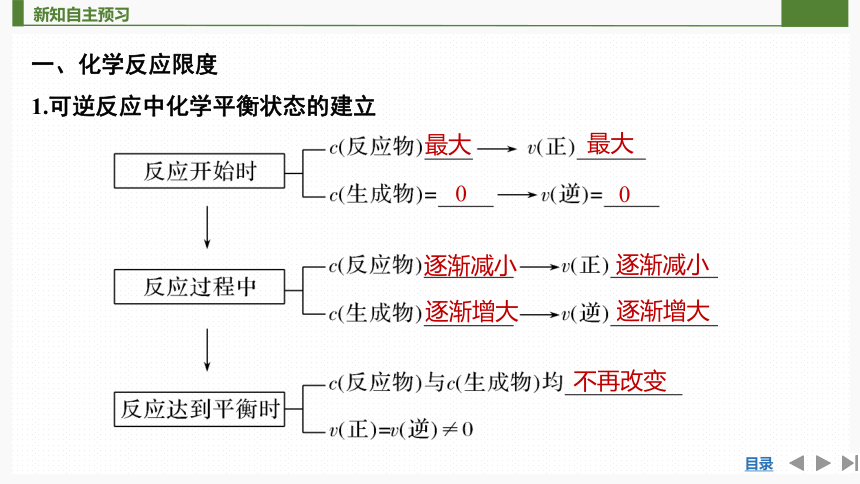
一、化学反应限度
1.可逆反应中化学平衡状态的建立
最大
最大
0
0
逐渐减小
逐渐减小
逐渐增大
逐渐增大
不再改变
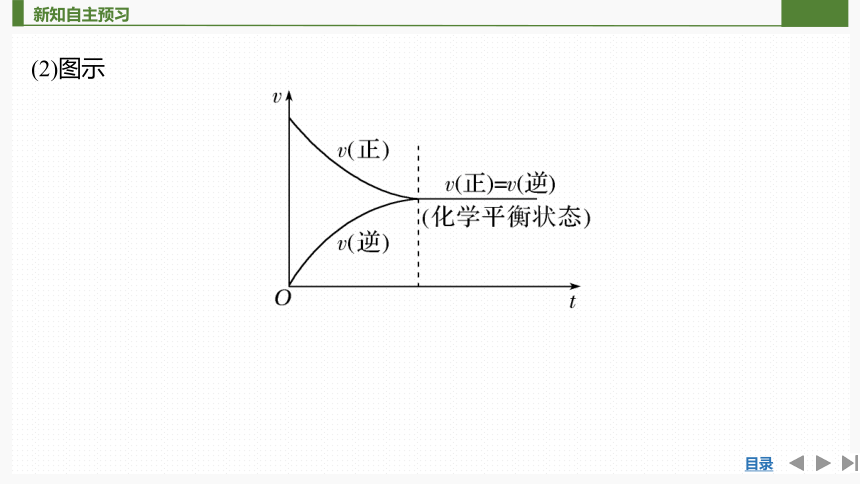
(2)图示
2.化学平衡状态
(1)概念
如果外界条件(温度、浓度、压强等)不发生改变,当可逆反应进行到一定程度时,________________与________________相等,反应物的浓度与生成物的浓度都____________,达到一种表面静止的状态,称为化学平衡状态,简称化学平衡。
正反应速率
逆反应速率
不再改变
(2)特征
可逆反应
相等
不再改变
3.化学反应的限度
(1)化学平衡状态是可逆反应在一定条件下所能达到或完成的____________,即该反应进行的限度。
(2)化学反应的限度决定了反应物在一定条件下的最大____________。
(3)同一可逆反应,不同条件下,化学反应的限度不同,即改变条件可以在一定程度上改变一个化学反应的________。
最大程度
转化率
限度
【微自测】
1.下列描述中正确的打“√”,错误的打“×”。
(1)1 mol N2和3 mol H2在一定条件下可完全生成2 mol NH3( )
(2)在一定条件下,一个可逆反应达到的平衡状态就是该反应所能达到的最大限度( )
(3)化学反应在一定条件下建立平衡状态时,化学反应将会停止( )
(4)一定条件,可以通过延长化学反应的时间来改变反应物的最大转化率( )
×
√
×
×
(5)可逆反应达到平衡状态时,各反应物、生成物的浓度相等( )
(6)化学反应达到化学平衡状态时正、逆反应速率相等,是指同一物质的消耗速率和生成速率相等,若用不同物质表示时,反应速率不一定相等( )
×
√
二、化工生产中化学反应条件的控制
速率
程度
小
高
大
高
加快
【微自测】
2.下列措施可以提高燃料燃烧效率的是( )
①提高燃料的着火点 ②降低燃料的着火点 ③将固体燃料粉碎 ④将液体燃料雾化 ⑤将煤气化处理 ⑥通入足量的空气
A.①③④⑤ B.②③⑤⑥
C.③④⑤⑥ D.①②③④
解析 燃料的着火点不可改变且与燃烧效率无关。
C
二、化学平衡状态的判断
一、可逆反应
一、可逆反应
———————【活动探究】———————
高炉炼铁的工业生产中,炼制生铁所需焦炭的实际用量,远高于按照化学方程式计算所需的量,而且从高炉炉顶出来的气体中含有没有利用的CO气体。开始时,炼铁工程师们认为是CO与铁矿石接触不充分之故,于是设法增加高炉的高度。然而,令人吃惊的是,高炉增高后,高炉尾气中的比例竟然没有改变。这成了炼铁技术中的科学悬念——“炼铁高炉尾气之谜”。
1.高炉炼铁的工业生产中,为什么高炉炉顶出来的气体中含有没有利用的CO气体?
提示:CO与Fe2O3的反应是一个可逆反应,反应物与生成物同时存在,反应物转化率小于100%。
提示:不是,可逆反应的特点是正反应和逆反应在同一条件下同时进行。铅酸二次电池的放电和充电过程不是同一条件下同时进行的反应。
3.在一定条件下,把1 mol N2和3 mol H2充入一密闭容器中,在一定条件下发生反应,能生成2 mol NH3吗?
提示:不能,N2和 H2反应生成NH3的反应为可逆反应,反应物转化率小于100%。
“极端假设法”确定可逆反应各物质的浓度范围
———————【核心归纳】———————
A.只存在于O2中 B.只存在于O2和SO3中
C.只存在于O2和SO2中 D.存在于SO2、O2和SO3中
解析 该反应为可逆反应,加入18O2后,它与SO2反应生成SO3,因此SO3中会有18O原子,含有18O原子的SO3会部分分解为SO2和O2,18O原子可能进入O2中,也可能进入SO2中,因此最后SO2、O2和SO3中都会有18O原子。
———————【实践应用】———————
D
2.500 ℃时,将2 mol N2和2.25 mol H2充入体积为10 L的恒容密闭容器中,反应达到平衡时,NH3的浓度不可能是( )
A.0.1 mol·L-1 B.0.12 mol·L-1 C.0.05 mol·L-1 D.0.16 mol·L-1
D
二、化学平衡状态的判断
素材1:
任何可逆反应在给定条件下的进程都有一定的限度,只是不同反应的限度不同。改变反应条件可以在一定程度上改变一个化学反应的限度,亦即改变该反应的化学平衡状态。
———————【活动探究】———————
一定条件下的可逆反应中,正反应速率和逆反应速率随时间变化的示意图
合成氨反应中有关物质的浓度随时间变化示意图
如图(a)所示,N2与H2发生反应。随着反应进行,体系中NH3的浓度逐渐增大,而N2与H2的浓度逐渐减小。从某一时刻开始,它们的浓度均不再改变。
如图(b)所示,NH3发生分解反应。随着反应进行,体系中N2与H2的浓度逐渐增大,而NH3的浓度逐渐减小。从某一时刻开始,它们的浓度均不再改变。
1.化学平衡状态建立后,反应停止,反应速率为0,这句话对吗?为什么?
提示:不对。由图可知,化学平衡建立后,v(正)=v(逆)≠0,说明反应并没有停止。
提示:不对,对同一物质v(正)=v(逆),对不同物质两向速率之比等于化学计量数之比即v正(N2)∶v逆(NH3)=1∶2。
1.化学平衡状态的判断依据
———————【核心归纳】———————
速率必须一个是正反应速率,一个是逆反应速率,且经过换算后同一物质的消耗速率和生成速率相等
2.不能判断反应达到平衡状态的几种情况
(1)反应中各组分的物质的量的变化量之比(或分子个数比)等于化学方程式中相应物质的化学计量数之比的状态。
(2)恒温恒容下Δn=0(反应前后气体物质的量不变)的反应,体系的压强、总物质的量不随时间改变而改变的状态。
(3)全是气体参加且Δn=0(反应前后气体物质的量不变)的反应,体系的平均相对分子质量不随时间的改变而改变的状态。
(4)全是气体参加的反应,恒容条件下体系的密度保持不变的状态。
①单位时间内生成n mol O2的同时,生成2n mol NO2
②单位时间内生成n mol O2的同时,生成2n mol NO
③用NO2、NO和O2的物质的量浓度变化表示的反应速率之比为2∶2∶1
④混合气体的颜色不再改变 ⑤混合气体的密度不再改变
⑥混合气体的压强不再改变 ⑦混合气体的平均相对分子质量不再改变
可说明该反应达到化学平衡状态的是( )
A.①④⑥⑦ B.②③④⑥ C.①④⑤⑦ D.①②⑥⑦
———————【实践应用】———————
A
解析 ①生成O2为正反应,生成NO2为逆反应,单位时间内生成n mol O2的同时,生成2n mol NO2,即正逆反应速率相等,反应达平衡②,生成O2和生成NO均为正反应。③中无论反应是否达到化学平衡状态,各物质表示的化学反应速率之比都等于相应物质的化学计量数之比。④有色气体的颜色不再改变,则表示体系中各物质的物质的量浓度不再变化,说明反应已达到化学平衡状态。⑤体积固定,气体的质量反应前后不变,无论是否达到化学平衡状态,气体的密度始终不变。⑥反应前后气体的物质的量不相等,当压强不变时,意味着各物质的含量不再变化,说明反应已达到化学平衡状态。⑦由于反应前后气体的质量不变,气体的平均相对分子质量不变时,说明气体中各物质的物质的量不变,反应达到化学平衡状态。故选A。
①t时刻及其前后H2O(g)、CO(g)、H2(g)的浓度;
②t时刻,H2O(g)、CO(g)、H2(g)的浓度;
③t时刻,消耗H2O(g)的速率与生成CO(g)的速率;
④t时刻,生成CO(g)的速率与消耗H2(g)的速率。
A.①③ B.①④ C.②③ D.②④
B
解析 t时刻及其前后各种气体的浓度不变时,该反应正、逆反应速率相等,反应达到平衡状态,故①可以判断t时刻反应是否达到平衡状态;t时刻,各种气体的浓度只是一个数值,无法判断平衡状态,故②无法判断;无论反应是否达到平衡状态都存在消耗H2O(g)的速率与生成CO(g)的速率相等,所以不能据此判断平衡状态,故③无法判断;t时刻生成CO(g)的速率是正反应,消耗H2(g)的速率是逆反应,若v(正)=v(逆)可以判断已达到平衡状态,故④可以判断t时刻反应是否达到平衡状态。
核心体系建构
1.下列反应不属于可逆反应的是( )
C
A.SO2与O2在一定条件下生成SO3,同时SO3又分解为SO2和O2
B.N2与H2在一定条件下生成NH3,同时NH3又分解为N2和H2
C.电解水生成H2和O2,氢气在氧气中燃烧生成H2O
D.SO2溶于水生成H2SO3,同时H2SO3又分解为SO2和H2O
解析 可逆反应指在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应。电解水生成氢气和氧气,氢气和氧气点燃生成水,两者反应条件不同,不是可逆反应。
A.反应器内的压强不随时间的变化而变化
B.反应器内P、Q、R、S四种气体共存
C.生成P的速率与生成S的速率相等
D.生成1 mol P必有1 mol Q生成
解析 对于该反应,反应前后气体的物质的量不变,无论是否达到平衡状态,压强一直保持不变,而且生成1 mol P必有1 mol Q生成;反应可逆,反应一旦开始,反应器内P、Q、R、S四种气体始终共存。
C
A.容器内的温度不再变化
B.容器内的压强不再变化
C.相同时间内,断开H—H键的数目和生成N—H键的数目相等
D.容器内气体的浓度c(N2)∶c(H2)∶c(NH3)=1∶3∶2
A
解析 A.绝热容器,温度不再改变,说明正逆反应速率相等,该反应达到平衡状态,故A正确;B.该反应在恒压条件下进行,压强始终不变,不能根据压强判断平衡状态,故B错误;C.相同时间内,断开H-H键的数目和生成N-H键的数目相等,表示的都是正反应,且不满足计量数关系,无法判断是否达到平衡状态,故C错误;D.容器内气体的浓度c(N2)∶c(H2)∶c(NH3)=1∶3∶2,不表示各物质浓度不再发生变化,则无法判断平衡状态,故D错误。
A.能够节约原料和能源
B.能够提高产品的产量
C.能够提高经济效益
D.能够提高化学反应速率
解析 提高化学反应的限度能够节约原料和能源、提高产品的产量、提高经济效益,但是和化学反应速率的快慢无关,故选D。
D
4.化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,如果设法提高化学反应的限度,下面的说法错误的是( )
(1)该反应的化学方程式可表示为________________。
(2)反应起始至t min(设t=5),X的平均反应速率是
___________________________________________。
(3)在t min时,该反应达到了________状态,下列可
判断反应已达到该状态的是________(填字母,下同)。
A.X、Y、Z的反应速率相等 B.X、Y的反应速率比为2∶3
C.混合气体的密度不变 D.生成1 mol Z的同时生成2 mol X
5.某温度下,在2 L密闭容器中X、Y、Z三种物质(均为气态)间进行反应,其物质的量随时间的变化曲线如图。据图回答:
(4)一定能使该反应的反应速率增大的措施有________。
A.其他条件不变,及时分离出产物
B.适当降低温度
C.其他条件不变,增大X的浓度
D.保持温度不变,将容器体积压缩为1 L
B
A.反应开始时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,最后为零
C.随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大
D.随着反应的进行,逆反应速率逐渐增大,最后与正反应速率相等
解析 反应开始时,反应物浓度最大,正反应速率最大,生成物浓度为零,逆反应速率为零,A正确;随着反应的进行,反应物浓度逐渐减小,正反应速率逐渐减小,生成物浓度逐渐增大,逆反应速率逐渐增大,达到平衡状态时正、逆反应速率相等,但不为零,B错误,C、D正确。
2.在一定温度下,某容器内的某一反应中,X、Y的物质的量随反应时间的变化曲线如图所示,下列表述正确的是( )
A
D
A.c(Z)=0.75 mol/L B.c(Z)=1.2 mol/L
C.c(W)=0.8 mol/L D.c(W)=1 mol/L
解析 可逆反应不能进行到底,即反应物均有剩余,所以消耗Y的物质的量必小于 1 mol,而生成 Z 的物质的量必小于 1.5 mol, 生成 W 的物质的量必小于1 mol,所以D错。
D
选项 正反应速率 逆反应速率
A vA=2 mol ·L-1·min-1 vB=2 mol ·L-1·min-1
B vA=2 mol ·L-1·min-1 vC=2 mol ·L-1·min-1
C vA=1 mol ·L-1·min-1 vB=2 mol ·L-1·min-1
D vA=1 mol ·L-1·min-1 vC=1.5 mol ·L-1·min-1
5.将煤块粉碎、进行脱硫处理、在适当过量的空气中燃烧,这样处理的目的分别是( )
A
①使煤充分燃烧,提高煤的利用率 ②减少SO2的产生,避免造成“酸雨” ③减少有毒的CO产生,避免污染空气 ④减少CO2的产生,避免“温室效应”
A.①②③ B.②③④
C.①③④ D.①②③④
解析 将煤块粉碎是为了提高煤的利用率;脱硫是为了减少SO2的产生;通入适当过量的空气是为了减少CO的产生。
A
A.混合气体的压强 B.混合气体的密度
C.混合气体的平均相对分子质量 D.固体A的质量
解析 该气体为气体体积不变的反应,在定容条件下,气体的压强始终不变,A不能表明反应已达平衡;反应向正反应方向进行时,气体质量增大,密度增大,密度不变说明反应达到平衡;反应向正反应方向进行时,气体质量增大,气体物质的量不变,气体的平均相对分子质量增大,不变时说明反应达到平衡;反应向正反应方向进行时,A的质量减小,质量不变说明反应达到平衡。
7.下列描述的化学反应状态,不一定是平衡状态的是( )
D
解析 A项,颜色的深浅与浓度有关,恒温、恒容下,反应体系中气体的颜色保持不变,说明溴分子的浓度不再发生变化,反应达到平衡状态,正确;B项,正反应是体积减小的,则恒温、恒容下,反应体系中气体的压强保持不变可以说明反应达到平衡状态,正确;C项,密度是气体的质量与容器容积的比值,气体质量是变化的,则恒温、恒容下,反应体系中气体的密度保持不变可以说明反应达到平衡状态,正确;D项,反应体系中H2与N2的物质的量之比保持3∶1不能说明是否平衡,因为初始量未知,错误。
C
A.SO2、O2、SO3的物质的量浓度之比为2∶1∶2
B.消耗SO2的速率与生成SO3的速率相等
C.SO2、O2、SO3的物质的量浓度不再改变
D.生成O2的速率与生成SO3的速率相等
B
A.达到化学平衡状态时,反应放出0.1a kJ 热量
B.达到化学平衡状态时,v(NH3)∶v(N2)=2∶1
C.使用催化剂能够提高原料平衡转化率
D.缩小容器体积,用氮气表示的反应速率:正反应速率增大,逆反应速率减少
温度/K 压强/(105Pa) 1.01 5.07 10.1 25.3 50.7
673 99.2 99.6 99.7 99.8 99.9
723 97.5 98.9 99.2 99.5 99.6
773 93.5 96.9 97.8 98.6 99.0
A.一定压强下降低温度,SO2 的转化率增大
B.在不同温度、压强下,转化相同物质的量的SO2 所需要的时间相等
C.使用催化剂可以缩短反应达到平衡所需的时间
D.工业生产通常不采取加压措施是因为常压下SO2 的转化率已相当高
答案 B
解析 A.由表格中数据可知,针对放热反应,一定压强下降低温度,反应物SO2的转化率增大,A项正确;B.由于在不同温度、压强下,化学反应速率不一定相等,故转化相同物质的量的SO2所需要的时间不一定相等,B项错误;C.催化剂可以同等程度改变正、逆反应速率不能改变化学平衡状态,但可以缩短到达平衡所需的时间,C项正确;D.由图中数据可知,不同温度下,1.01×105Pa(常压)下SO2的转化率分别为99.2%、97.5%、93.5%,已经相当高了,且加压后转化率升高并不明显,所以没有必要通过加压提高转化率,D项正确。
C
A. v逆(N2)=3v正(H2)
B.v正(HCl)=4v正(SiCl4)
C.混合气体密度保持不变
D.c(N2)∶c(H2)∶c(HCl)=1∶3∶6
解析 A.在任何时刻都存在3v正(N2)=v正(H2),若3v逆(N2)=v正(H2),则v正(N2)= v逆(N2),反应达到平衡状态,A不符合题意;B.在任何时刻都存在v正(HCl)=4v正(SiCl4),表示的都是正反应速率,不能据此判断反应是否达到平衡状态,B不符合题意;C.该反应在恒容密闭容器中进行,前后气体质量发生改变,当气体质量不变时,此时气体的密度不变,反应达到平衡状态,故C符合题意;D.反应体系中c(N2)∶c(H2)∶c(HCl)=1∶3∶6时,反应可能处于平衡状态,也可能未处于平衡状态,这与反应条件以及反应开始时加入反应物的多少有关,因此不能据此判断反应是否达到平衡状态,D不符合题意。
D
A.消耗1 mol SO2的同时消耗1 mol NO
B.混合气体的颜色(透光率)不再改变
C.混合气体的压强不再改变
D.混合气体的密度不再改变
解析 A.消耗1 mol SO2的同时产生1 mol NO,正、逆反应速率相等,故A正确;B.混合气体中只有NO2为有色气体,混合气体的颜色(透光率)不再改变,表明各组分的浓度不再变化,该反应达到平衡状态,故B正确;C.该反应前后气体体积不变,则反应中气体的总物质的量为定值,由于在绝热的恒容容器中反应,温度为变量,由pV=nRT可知,压强p也为变量,当混合气体的压强不再改变时,表明正、逆反应速率相等,达到平衡状态,故C正确;D.该反应中均为气体,且容器容积为定值,则混合气体的密度始终不变,不能根据混合气体密度判断平衡状态,故D错误。
(1)反应刚开始时,由于c(H2)=________,c(I2)=________,而c(HI)=________,所以化学反应速率________(填“v正”或“v逆”,下同)最大而________最小(为零)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)________,c(I2)________,而c(HI)________,从而化学反应速率v正________,而v逆________(填“增大”、“减小”或“不变”)。
解析 在化学平衡建立的过程中,开始时,c(H2)和c(I2)为最大值,正反应速率最大,由于此时没有HI,逆反应速率最小为0,随反应进行c(H2)和c(I2)逐渐减小,正反应速率逐渐减小,逆反应速率逐渐增大,直到平衡时v正=v逆,反应体系中各组分的浓度不变,百分含量也不变,由于反应前后气体的物质的量不变,故平衡时总压强不变。(4)化学反应速率之比等于各物质的化学计量数之比,H2(g)的消耗速率与HI(g)的生成速率比为1∶2,a不正确。化学平衡是动态平衡,化学平衡时,反应仍在进行,b不正确。在化学平衡之前,正、逆反应速率不断变化,所以c不正确。正、逆反应速率相等是化学反应达到平衡的标志,d正确。
时间/s 0 1 2 3 4 5
n(NO)/mol 0.020 0.010 0.008 0.007 0.007 0.007
(1)上图中,A点处v正________v逆(填“大于”“小于”或“等于”)。
(2)图中表示NO2变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。
(3)下列能说明该反应已经达到平衡状态的是________(填字母,下同)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
(4)下列能使该反应的反应速率增大的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
答案 (1)大于 (2)b 1.5×10-3 mol·L-1·s-1 (3)bc (4)bcd
(1)经测定前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为________________________________________________________________。
1.列出一个模型——“三段式”思维模型
微专题4 “三段式”思维模型及应用
———————【核心归纳】———————
2.掌握四个公式——“三段式”应用
———————【迁移应用】———————
B
2.在容积可变的密闭容器中,2 mol N2和8 mol H2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时氮气的体积分数接近于( )
A.5% B.10% C.15% D.20%
C
A.在5 min内该反应用C的浓度变化表示的反应速率为0.02 mol·L-1·min-1
B.5 min时,容器内D的浓度为0.2 mol·L-1
C.该可逆反应随反应的进行容器内压强不变
D.5 min时容器内气体总的物质的量为2.5 mol
C
A.用物质A表示2 s末的反应速率为0.6 mol/(L·s)
B.反应后的压强是开始时候的0.9倍
C.2 s时物质A的转化率为70%
D.C的产率为40%
B
A.反应达到平衡状态时A的转化率为60%
B.x=4
C.若混合气体的密度不再变化,则该可逆反应达到化学平衡状态
D.反应达到平衡状态时,相同条件下容器内气体的压强与起始时压强比为6∶5
D
6.往2 L密闭容器中充入1 mol N2和3 mol H2,在一定条件下发生合成氨反应,2 min时达平衡。测得平衡混合气体中NH3的体积分数为25%,则:
(1)0~2 min内,v(NH3)=________。
(2)H2在平衡混合气中的体积分数=________。
(3)平衡时容器的压强与起始时的压强之比为________。
答案 (1)0.2 mol/(L·min) (2)56.25% (3)4∶5
Thanks!
本课时内容结束
第二节 化学反应的速
率与限度
第2课时 化学反应的限度
化学反应条件的控制
第6章 化学反应与能量
【课程标准要求】
1.了解可逆反应及特点。
2.理解化学平衡状态的特征及标志,知道改变条件化学平衡会发生移动。
3.了解控制反应条件在生产、生活和科学研究中的作用。
新知自主预习
课堂互动探究
课时训练
目
录
CONTENTS
///////
///////
///////
课堂小结·即时达标
///////
微专题
///////
一、化学反应限度
1.可逆反应中化学平衡状态的建立
最大
最大
0
0
逐渐减小
逐渐减小
逐渐增大
逐渐增大
不再改变
(2)图示
2.化学平衡状态
(1)概念
如果外界条件(温度、浓度、压强等)不发生改变,当可逆反应进行到一定程度时,________________与________________相等,反应物的浓度与生成物的浓度都____________,达到一种表面静止的状态,称为化学平衡状态,简称化学平衡。
正反应速率
逆反应速率
不再改变
(2)特征
可逆反应
相等
不再改变
3.化学反应的限度
(1)化学平衡状态是可逆反应在一定条件下所能达到或完成的____________,即该反应进行的限度。
(2)化学反应的限度决定了反应物在一定条件下的最大____________。
(3)同一可逆反应,不同条件下,化学反应的限度不同,即改变条件可以在一定程度上改变一个化学反应的________。
最大程度
转化率
限度
【微自测】
1.下列描述中正确的打“√”,错误的打“×”。
(1)1 mol N2和3 mol H2在一定条件下可完全生成2 mol NH3( )
(2)在一定条件下,一个可逆反应达到的平衡状态就是该反应所能达到的最大限度( )
(3)化学反应在一定条件下建立平衡状态时,化学反应将会停止( )
(4)一定条件,可以通过延长化学反应的时间来改变反应物的最大转化率( )
×
√
×
×
(5)可逆反应达到平衡状态时,各反应物、生成物的浓度相等( )
(6)化学反应达到化学平衡状态时正、逆反应速率相等,是指同一物质的消耗速率和生成速率相等,若用不同物质表示时,反应速率不一定相等( )
×
√
二、化工生产中化学反应条件的控制
速率
程度
小
高
大
高
加快
【微自测】
2.下列措施可以提高燃料燃烧效率的是( )
①提高燃料的着火点 ②降低燃料的着火点 ③将固体燃料粉碎 ④将液体燃料雾化 ⑤将煤气化处理 ⑥通入足量的空气
A.①③④⑤ B.②③⑤⑥
C.③④⑤⑥ D.①②③④
解析 燃料的着火点不可改变且与燃烧效率无关。
C
二、化学平衡状态的判断
一、可逆反应
一、可逆反应
———————【活动探究】———————
高炉炼铁的工业生产中,炼制生铁所需焦炭的实际用量,远高于按照化学方程式计算所需的量,而且从高炉炉顶出来的气体中含有没有利用的CO气体。开始时,炼铁工程师们认为是CO与铁矿石接触不充分之故,于是设法增加高炉的高度。然而,令人吃惊的是,高炉增高后,高炉尾气中的比例竟然没有改变。这成了炼铁技术中的科学悬念——“炼铁高炉尾气之谜”。
1.高炉炼铁的工业生产中,为什么高炉炉顶出来的气体中含有没有利用的CO气体?
提示:CO与Fe2O3的反应是一个可逆反应,反应物与生成物同时存在,反应物转化率小于100%。
提示:不是,可逆反应的特点是正反应和逆反应在同一条件下同时进行。铅酸二次电池的放电和充电过程不是同一条件下同时进行的反应。
3.在一定条件下,把1 mol N2和3 mol H2充入一密闭容器中,在一定条件下发生反应,能生成2 mol NH3吗?
提示:不能,N2和 H2反应生成NH3的反应为可逆反应,反应物转化率小于100%。
“极端假设法”确定可逆反应各物质的浓度范围
———————【核心归纳】———————
A.只存在于O2中 B.只存在于O2和SO3中
C.只存在于O2和SO2中 D.存在于SO2、O2和SO3中
解析 该反应为可逆反应,加入18O2后,它与SO2反应生成SO3,因此SO3中会有18O原子,含有18O原子的SO3会部分分解为SO2和O2,18O原子可能进入O2中,也可能进入SO2中,因此最后SO2、O2和SO3中都会有18O原子。
———————【实践应用】———————
D
2.500 ℃时,将2 mol N2和2.25 mol H2充入体积为10 L的恒容密闭容器中,反应达到平衡时,NH3的浓度不可能是( )
A.0.1 mol·L-1 B.0.12 mol·L-1 C.0.05 mol·L-1 D.0.16 mol·L-1
D
二、化学平衡状态的判断
素材1:
任何可逆反应在给定条件下的进程都有一定的限度,只是不同反应的限度不同。改变反应条件可以在一定程度上改变一个化学反应的限度,亦即改变该反应的化学平衡状态。
———————【活动探究】———————
一定条件下的可逆反应中,正反应速率和逆反应速率随时间变化的示意图
合成氨反应中有关物质的浓度随时间变化示意图
如图(a)所示,N2与H2发生反应。随着反应进行,体系中NH3的浓度逐渐增大,而N2与H2的浓度逐渐减小。从某一时刻开始,它们的浓度均不再改变。
如图(b)所示,NH3发生分解反应。随着反应进行,体系中N2与H2的浓度逐渐增大,而NH3的浓度逐渐减小。从某一时刻开始,它们的浓度均不再改变。
1.化学平衡状态建立后,反应停止,反应速率为0,这句话对吗?为什么?
提示:不对。由图可知,化学平衡建立后,v(正)=v(逆)≠0,说明反应并没有停止。
提示:不对,对同一物质v(正)=v(逆),对不同物质两向速率之比等于化学计量数之比即v正(N2)∶v逆(NH3)=1∶2。
1.化学平衡状态的判断依据
———————【核心归纳】———————
速率必须一个是正反应速率,一个是逆反应速率,且经过换算后同一物质的消耗速率和生成速率相等
2.不能判断反应达到平衡状态的几种情况
(1)反应中各组分的物质的量的变化量之比(或分子个数比)等于化学方程式中相应物质的化学计量数之比的状态。
(2)恒温恒容下Δn=0(反应前后气体物质的量不变)的反应,体系的压强、总物质的量不随时间改变而改变的状态。
(3)全是气体参加且Δn=0(反应前后气体物质的量不变)的反应,体系的平均相对分子质量不随时间的改变而改变的状态。
(4)全是气体参加的反应,恒容条件下体系的密度保持不变的状态。
①单位时间内生成n mol O2的同时,生成2n mol NO2
②单位时间内生成n mol O2的同时,生成2n mol NO
③用NO2、NO和O2的物质的量浓度变化表示的反应速率之比为2∶2∶1
④混合气体的颜色不再改变 ⑤混合气体的密度不再改变
⑥混合气体的压强不再改变 ⑦混合气体的平均相对分子质量不再改变
可说明该反应达到化学平衡状态的是( )
A.①④⑥⑦ B.②③④⑥ C.①④⑤⑦ D.①②⑥⑦
———————【实践应用】———————
A
解析 ①生成O2为正反应,生成NO2为逆反应,单位时间内生成n mol O2的同时,生成2n mol NO2,即正逆反应速率相等,反应达平衡②,生成O2和生成NO均为正反应。③中无论反应是否达到化学平衡状态,各物质表示的化学反应速率之比都等于相应物质的化学计量数之比。④有色气体的颜色不再改变,则表示体系中各物质的物质的量浓度不再变化,说明反应已达到化学平衡状态。⑤体积固定,气体的质量反应前后不变,无论是否达到化学平衡状态,气体的密度始终不变。⑥反应前后气体的物质的量不相等,当压强不变时,意味着各物质的含量不再变化,说明反应已达到化学平衡状态。⑦由于反应前后气体的质量不变,气体的平均相对分子质量不变时,说明气体中各物质的物质的量不变,反应达到化学平衡状态。故选A。
①t时刻及其前后H2O(g)、CO(g)、H2(g)的浓度;
②t时刻,H2O(g)、CO(g)、H2(g)的浓度;
③t时刻,消耗H2O(g)的速率与生成CO(g)的速率;
④t时刻,生成CO(g)的速率与消耗H2(g)的速率。
A.①③ B.①④ C.②③ D.②④
B
解析 t时刻及其前后各种气体的浓度不变时,该反应正、逆反应速率相等,反应达到平衡状态,故①可以判断t时刻反应是否达到平衡状态;t时刻,各种气体的浓度只是一个数值,无法判断平衡状态,故②无法判断;无论反应是否达到平衡状态都存在消耗H2O(g)的速率与生成CO(g)的速率相等,所以不能据此判断平衡状态,故③无法判断;t时刻生成CO(g)的速率是正反应,消耗H2(g)的速率是逆反应,若v(正)=v(逆)可以判断已达到平衡状态,故④可以判断t时刻反应是否达到平衡状态。
核心体系建构
1.下列反应不属于可逆反应的是( )
C
A.SO2与O2在一定条件下生成SO3,同时SO3又分解为SO2和O2
B.N2与H2在一定条件下生成NH3,同时NH3又分解为N2和H2
C.电解水生成H2和O2,氢气在氧气中燃烧生成H2O
D.SO2溶于水生成H2SO3,同时H2SO3又分解为SO2和H2O
解析 可逆反应指在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应。电解水生成氢气和氧气,氢气和氧气点燃生成水,两者反应条件不同,不是可逆反应。
A.反应器内的压强不随时间的变化而变化
B.反应器内P、Q、R、S四种气体共存
C.生成P的速率与生成S的速率相等
D.生成1 mol P必有1 mol Q生成
解析 对于该反应,反应前后气体的物质的量不变,无论是否达到平衡状态,压强一直保持不变,而且生成1 mol P必有1 mol Q生成;反应可逆,反应一旦开始,反应器内P、Q、R、S四种气体始终共存。
C
A.容器内的温度不再变化
B.容器内的压强不再变化
C.相同时间内,断开H—H键的数目和生成N—H键的数目相等
D.容器内气体的浓度c(N2)∶c(H2)∶c(NH3)=1∶3∶2
A
解析 A.绝热容器,温度不再改变,说明正逆反应速率相等,该反应达到平衡状态,故A正确;B.该反应在恒压条件下进行,压强始终不变,不能根据压强判断平衡状态,故B错误;C.相同时间内,断开H-H键的数目和生成N-H键的数目相等,表示的都是正反应,且不满足计量数关系,无法判断是否达到平衡状态,故C错误;D.容器内气体的浓度c(N2)∶c(H2)∶c(NH3)=1∶3∶2,不表示各物质浓度不再发生变化,则无法判断平衡状态,故D错误。
A.能够节约原料和能源
B.能够提高产品的产量
C.能够提高经济效益
D.能够提高化学反应速率
解析 提高化学反应的限度能够节约原料和能源、提高产品的产量、提高经济效益,但是和化学反应速率的快慢无关,故选D。
D
4.化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,如果设法提高化学反应的限度,下面的说法错误的是( )
(1)该反应的化学方程式可表示为________________。
(2)反应起始至t min(设t=5),X的平均反应速率是
___________________________________________。
(3)在t min时,该反应达到了________状态,下列可
判断反应已达到该状态的是________(填字母,下同)。
A.X、Y、Z的反应速率相等 B.X、Y的反应速率比为2∶3
C.混合气体的密度不变 D.生成1 mol Z的同时生成2 mol X
5.某温度下,在2 L密闭容器中X、Y、Z三种物质(均为气态)间进行反应,其物质的量随时间的变化曲线如图。据图回答:
(4)一定能使该反应的反应速率增大的措施有________。
A.其他条件不变,及时分离出产物
B.适当降低温度
C.其他条件不变,增大X的浓度
D.保持温度不变,将容器体积压缩为1 L
B
A.反应开始时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,最后为零
C.随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大
D.随着反应的进行,逆反应速率逐渐增大,最后与正反应速率相等
解析 反应开始时,反应物浓度最大,正反应速率最大,生成物浓度为零,逆反应速率为零,A正确;随着反应的进行,反应物浓度逐渐减小,正反应速率逐渐减小,生成物浓度逐渐增大,逆反应速率逐渐增大,达到平衡状态时正、逆反应速率相等,但不为零,B错误,C、D正确。
2.在一定温度下,某容器内的某一反应中,X、Y的物质的量随反应时间的变化曲线如图所示,下列表述正确的是( )
A
D
A.c(Z)=0.75 mol/L B.c(Z)=1.2 mol/L
C.c(W)=0.8 mol/L D.c(W)=1 mol/L
解析 可逆反应不能进行到底,即反应物均有剩余,所以消耗Y的物质的量必小于 1 mol,而生成 Z 的物质的量必小于 1.5 mol, 生成 W 的物质的量必小于1 mol,所以D错。
D
选项 正反应速率 逆反应速率
A vA=2 mol ·L-1·min-1 vB=2 mol ·L-1·min-1
B vA=2 mol ·L-1·min-1 vC=2 mol ·L-1·min-1
C vA=1 mol ·L-1·min-1 vB=2 mol ·L-1·min-1
D vA=1 mol ·L-1·min-1 vC=1.5 mol ·L-1·min-1
5.将煤块粉碎、进行脱硫处理、在适当过量的空气中燃烧,这样处理的目的分别是( )
A
①使煤充分燃烧,提高煤的利用率 ②减少SO2的产生,避免造成“酸雨” ③减少有毒的CO产生,避免污染空气 ④减少CO2的产生,避免“温室效应”
A.①②③ B.②③④
C.①③④ D.①②③④
解析 将煤块粉碎是为了提高煤的利用率;脱硫是为了减少SO2的产生;通入适当过量的空气是为了减少CO的产生。
A
A.混合气体的压强 B.混合气体的密度
C.混合气体的平均相对分子质量 D.固体A的质量
解析 该气体为气体体积不变的反应,在定容条件下,气体的压强始终不变,A不能表明反应已达平衡;反应向正反应方向进行时,气体质量增大,密度增大,密度不变说明反应达到平衡;反应向正反应方向进行时,气体质量增大,气体物质的量不变,气体的平均相对分子质量增大,不变时说明反应达到平衡;反应向正反应方向进行时,A的质量减小,质量不变说明反应达到平衡。
7.下列描述的化学反应状态,不一定是平衡状态的是( )
D
解析 A项,颜色的深浅与浓度有关,恒温、恒容下,反应体系中气体的颜色保持不变,说明溴分子的浓度不再发生变化,反应达到平衡状态,正确;B项,正反应是体积减小的,则恒温、恒容下,反应体系中气体的压强保持不变可以说明反应达到平衡状态,正确;C项,密度是气体的质量与容器容积的比值,气体质量是变化的,则恒温、恒容下,反应体系中气体的密度保持不变可以说明反应达到平衡状态,正确;D项,反应体系中H2与N2的物质的量之比保持3∶1不能说明是否平衡,因为初始量未知,错误。
C
A.SO2、O2、SO3的物质的量浓度之比为2∶1∶2
B.消耗SO2的速率与生成SO3的速率相等
C.SO2、O2、SO3的物质的量浓度不再改变
D.生成O2的速率与生成SO3的速率相等
B
A.达到化学平衡状态时,反应放出0.1a kJ 热量
B.达到化学平衡状态时,v(NH3)∶v(N2)=2∶1
C.使用催化剂能够提高原料平衡转化率
D.缩小容器体积,用氮气表示的反应速率:正反应速率增大,逆反应速率减少
温度/K 压强/(105Pa) 1.01 5.07 10.1 25.3 50.7
673 99.2 99.6 99.7 99.8 99.9
723 97.5 98.9 99.2 99.5 99.6
773 93.5 96.9 97.8 98.6 99.0
A.一定压强下降低温度,SO2 的转化率增大
B.在不同温度、压强下,转化相同物质的量的SO2 所需要的时间相等
C.使用催化剂可以缩短反应达到平衡所需的时间
D.工业生产通常不采取加压措施是因为常压下SO2 的转化率已相当高
答案 B
解析 A.由表格中数据可知,针对放热反应,一定压强下降低温度,反应物SO2的转化率增大,A项正确;B.由于在不同温度、压强下,化学反应速率不一定相等,故转化相同物质的量的SO2所需要的时间不一定相等,B项错误;C.催化剂可以同等程度改变正、逆反应速率不能改变化学平衡状态,但可以缩短到达平衡所需的时间,C项正确;D.由图中数据可知,不同温度下,1.01×105Pa(常压)下SO2的转化率分别为99.2%、97.5%、93.5%,已经相当高了,且加压后转化率升高并不明显,所以没有必要通过加压提高转化率,D项正确。
C
A. v逆(N2)=3v正(H2)
B.v正(HCl)=4v正(SiCl4)
C.混合气体密度保持不变
D.c(N2)∶c(H2)∶c(HCl)=1∶3∶6
解析 A.在任何时刻都存在3v正(N2)=v正(H2),若3v逆(N2)=v正(H2),则v正(N2)= v逆(N2),反应达到平衡状态,A不符合题意;B.在任何时刻都存在v正(HCl)=4v正(SiCl4),表示的都是正反应速率,不能据此判断反应是否达到平衡状态,B不符合题意;C.该反应在恒容密闭容器中进行,前后气体质量发生改变,当气体质量不变时,此时气体的密度不变,反应达到平衡状态,故C符合题意;D.反应体系中c(N2)∶c(H2)∶c(HCl)=1∶3∶6时,反应可能处于平衡状态,也可能未处于平衡状态,这与反应条件以及反应开始时加入反应物的多少有关,因此不能据此判断反应是否达到平衡状态,D不符合题意。
D
A.消耗1 mol SO2的同时消耗1 mol NO
B.混合气体的颜色(透光率)不再改变
C.混合气体的压强不再改变
D.混合气体的密度不再改变
解析 A.消耗1 mol SO2的同时产生1 mol NO,正、逆反应速率相等,故A正确;B.混合气体中只有NO2为有色气体,混合气体的颜色(透光率)不再改变,表明各组分的浓度不再变化,该反应达到平衡状态,故B正确;C.该反应前后气体体积不变,则反应中气体的总物质的量为定值,由于在绝热的恒容容器中反应,温度为变量,由pV=nRT可知,压强p也为变量,当混合气体的压强不再改变时,表明正、逆反应速率相等,达到平衡状态,故C正确;D.该反应中均为气体,且容器容积为定值,则混合气体的密度始终不变,不能根据混合气体密度判断平衡状态,故D错误。
(1)反应刚开始时,由于c(H2)=________,c(I2)=________,而c(HI)=________,所以化学反应速率________(填“v正”或“v逆”,下同)最大而________最小(为零)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)________,c(I2)________,而c(HI)________,从而化学反应速率v正________,而v逆________(填“增大”、“减小”或“不变”)。
解析 在化学平衡建立的过程中,开始时,c(H2)和c(I2)为最大值,正反应速率最大,由于此时没有HI,逆反应速率最小为0,随反应进行c(H2)和c(I2)逐渐减小,正反应速率逐渐减小,逆反应速率逐渐增大,直到平衡时v正=v逆,反应体系中各组分的浓度不变,百分含量也不变,由于反应前后气体的物质的量不变,故平衡时总压强不变。(4)化学反应速率之比等于各物质的化学计量数之比,H2(g)的消耗速率与HI(g)的生成速率比为1∶2,a不正确。化学平衡是动态平衡,化学平衡时,反应仍在进行,b不正确。在化学平衡之前,正、逆反应速率不断变化,所以c不正确。正、逆反应速率相等是化学反应达到平衡的标志,d正确。
时间/s 0 1 2 3 4 5
n(NO)/mol 0.020 0.010 0.008 0.007 0.007 0.007
(1)上图中,A点处v正________v逆(填“大于”“小于”或“等于”)。
(2)图中表示NO2变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。
(3)下列能说明该反应已经达到平衡状态的是________(填字母,下同)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
(4)下列能使该反应的反应速率增大的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
答案 (1)大于 (2)b 1.5×10-3 mol·L-1·s-1 (3)bc (4)bcd
(1)经测定前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为________________________________________________________________。
1.列出一个模型——“三段式”思维模型
微专题4 “三段式”思维模型及应用
———————【核心归纳】———————
2.掌握四个公式——“三段式”应用
———————【迁移应用】———————
B
2.在容积可变的密闭容器中,2 mol N2和8 mol H2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时氮气的体积分数接近于( )
A.5% B.10% C.15% D.20%
C
A.在5 min内该反应用C的浓度变化表示的反应速率为0.02 mol·L-1·min-1
B.5 min时,容器内D的浓度为0.2 mol·L-1
C.该可逆反应随反应的进行容器内压强不变
D.5 min时容器内气体总的物质的量为2.5 mol
C
A.用物质A表示2 s末的反应速率为0.6 mol/(L·s)
B.反应后的压强是开始时候的0.9倍
C.2 s时物质A的转化率为70%
D.C的产率为40%
B
A.反应达到平衡状态时A的转化率为60%
B.x=4
C.若混合气体的密度不再变化,则该可逆反应达到化学平衡状态
D.反应达到平衡状态时,相同条件下容器内气体的压强与起始时压强比为6∶5
D
6.往2 L密闭容器中充入1 mol N2和3 mol H2,在一定条件下发生合成氨反应,2 min时达平衡。测得平衡混合气体中NH3的体积分数为25%,则:
(1)0~2 min内,v(NH3)=________。
(2)H2在平衡混合气中的体积分数=________。
(3)平衡时容器的压强与起始时的压强之比为________。
答案 (1)0.2 mol/(L·min) (2)56.25% (3)4∶5
Thanks!
本课时内容结束
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
