第六章第一节 化学反应与能量变化第2课时 化学反应与电能 课件(共74张PPT)
文档属性
| 名称 | 第六章第一节 化学反应与能量变化第2课时 化学反应与电能 课件(共74张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-12 11:23:43 | ||
图片预览








文档简介
(共74张PPT)
第一节 化学反应与能
量变化
第2课时 化学反应与电能
第6章 化学反应与能量
【课程标准要求】
1.理解原电池的概念及工作原理,能正确判断原电池的正、负极。
2.设计实验认识构成原电池的条件。
新知自主预习
课堂互动探究
课时训练
目
录
CONTENTS
///////
///////
///////
课堂小结·即时达标
///////
一、化学能间接转化为电能——火力发电
1.火力发电的原理
首先通过化石燃料燃烧,使________________________,加热水使之________________以推动蒸汽轮机,然后带动发电机发电。
2.能量转化过程
3.关键——燃烧(氧化还原反应)
化学能转化为热能
汽化为蒸汽
热
机械
【微自测】
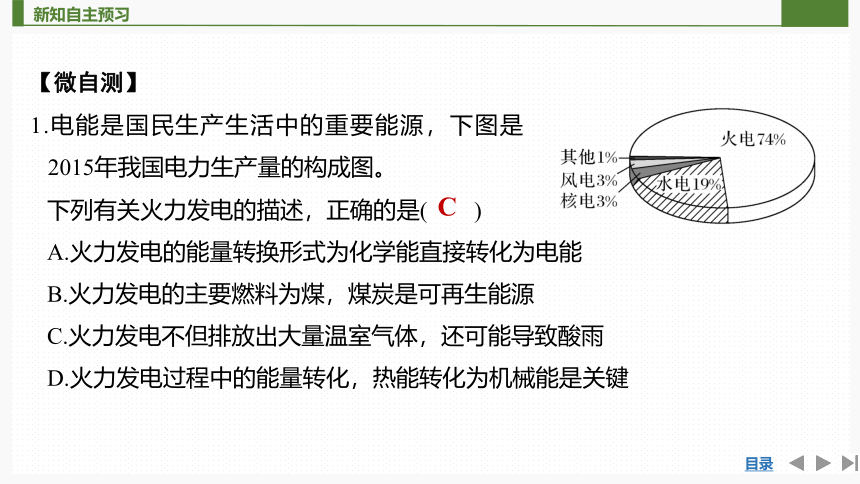
1.电能是国民生产生活中的重要能源,下图是2015年我国电力生产量的构成图。
下列有关火力发电的描述,正确的是( )
A.火力发电的能量转换形式为化学能直接转化为电能
B.火力发电的主要燃料为煤,煤炭是可再生能源
C.火力发电不但排放出大量温室气体,还可能导致酸雨
D.火力发电过程中的能量转化,热能转化为机械能是关键
C
解析 火力发电过程是化学能→热能→机械能→电能,是化学能间接转化为电能,A错误;作火力发电燃料的煤为不可再生能源,B错误;在燃煤过程中,会产生大量CO2和SO2,可导致温室效应及酸雨,C正确;火力发电过程中,燃烧是关键,D错误。
二、化学能直接转化为电能——原电池
1.概念:将________能转化为________能的装置。
化学
电
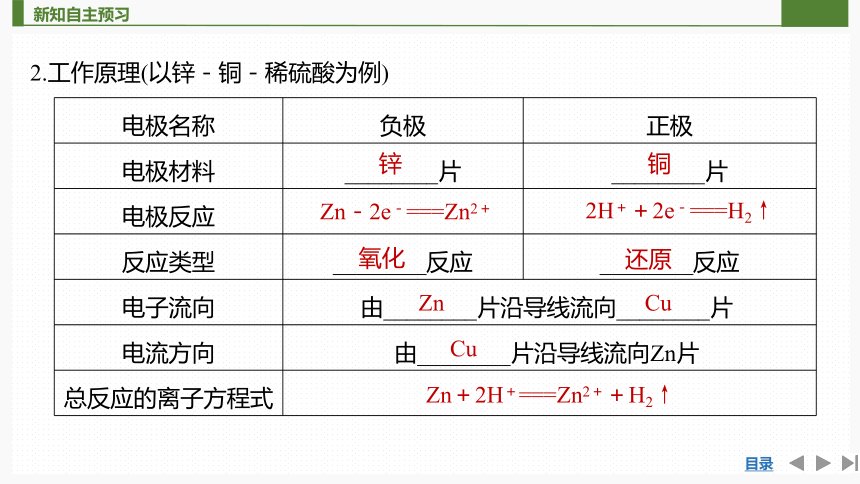
2.工作原理(以锌-铜-稀硫酸为例)
电极名称 负极 正极
电极材料 ________片 ________片
电极反应
反应类型 ________反应 ________反应
电子流向 由________片沿导线流向________片 电流方向 由________片沿导线流向Zn片 总反应的离子方程式 锌
铜
Zn-2e-===Zn2+
2H++2e-===H2↑
氧化
还原
Zn
Cu
Cu
Zn+2H+===Zn2++H2↑
【微自测】
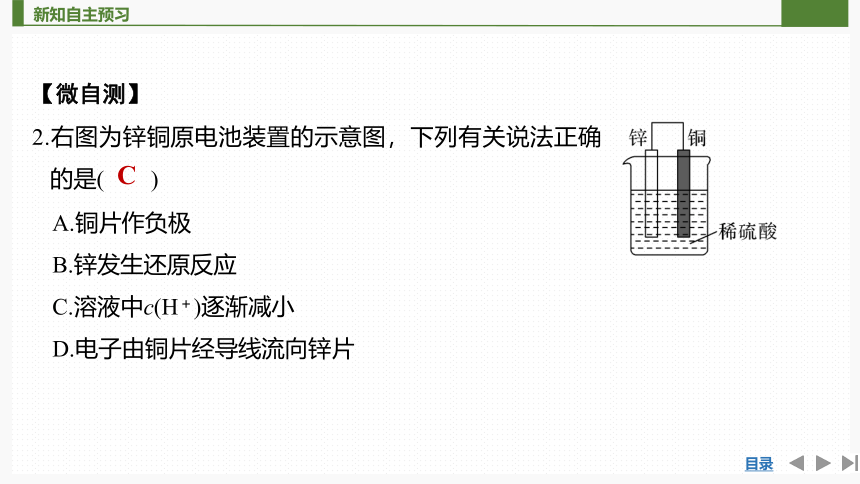
2.右图为锌铜原电池装置的示意图,下列有关说法正确的是( )
A.铜片作负极
B.锌发生还原反应
C.溶液中c(H+)逐渐减小
D.电子由铜片经导线流向锌片
C
二、原电池原理的简单应用
一、原电池的工作原理探究
一、原电池的工作原理探究
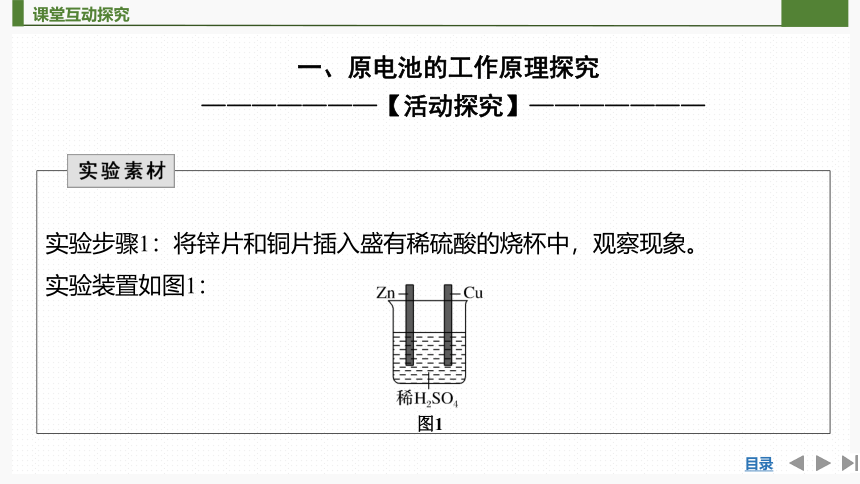
实验步骤1:将锌片和铜片插入盛有稀硫酸的烧杯中,观察现象。
实验装置如图1:
———————【活动探究】———————
图1
实验步骤2:用导线连接锌片和铜片,观察、比较导线连接前后的现象。
实验装置如图2:
图2
实验步骤3:用导线在锌片和铜片之间串联一个电流表,观察电流表的指针是否偏转。
实验装置如图3:
图3
1.装置2、3中铜片不与稀硫酸反应,为什么铜上会有氢气生成?
提示:虽然铜不活泼,不能失去电子,但锌比铜活泼,锌与稀硫酸接触时,失去电子,这些电子沿着导线传递到铜的表面,被溶液中接近的氢离子获得后,形成了氢气放出。
2.若将装置3中铜片换作石墨棒,能否产生电流?电极反应有无变化?
提示:改为石墨棒后,仍可形成原电池,产生电流。更换后锌作负极,石墨棒作正极,电极反应与电池总反应均不变。
3.若将装置3中稀硫酸换成硫酸铜溶液,能否产生电流 电极反应有何不同?
提示:将稀硫酸换成硫酸铜溶液,同样能形成原电池 ,产生电流。Zn作负极,发生失电子的氧化反应,电极反应式为Zn-2e-=== Zn2+;铜作正极,溶液中的Cu2+在铜电极上发生得电子的还原反应,电极反应式为Cu2++2e-===Cu,总反应式为Zn+Cu2+===Cu+Zn2+。
4.原电池的电极材料都必须是金属吗?
提示:原电池的电极材料可以是两种活泼性不同的金属 ,也可以是一种金属与一种可导电的惰性材料(如非金属石墨等)。
1.原电池的构成条件
———————【核心归纳】———————
2.工作原理
(1)反应类型:负极发生氧化反应,正极发生还原反应。
(2)电子的移动方向:从负极流出,经导线流向正极。
(3)离子的移动方向:阳离子向正极移动,阴离子向负极移动。
(4)电流方向:正极→导线→负极。
3.原电池正、负极的判断
在原电池中,电子在导线中定向移动(由负极流出,流入正极),离子在溶液中定向移动(阳离子移向正极,阴离子移向负极),即“电子不下水,离子不上岸”或“电子走陆路,离子走水路”,它们共同组成了一个完整的闭合回路。
——原电池中电子、离子的移动规律及判断口诀
1.如图所示各装置示意图中,不能构成原电池的是(烧杯中所盛液体都是稀硫酸)( )
———————【实践应用】———————
D
解析 原电池的形成条件包括活动性不同的电极、电解质溶液、形成闭合回路、自发进行氧化还原反应。对图示各个装置示意图进行观察,发现只有D项不能形成闭合回路,因此D项不能形成原电池。
2.如图所示,a的金属活动性在氢之前,b为碳棒。关于该装置的说法中,正确的是( )
A.a极上发生还原反应,b极上发生氧化反应
B.碳棒上有气体逸出,溶液中c(H+)增大
C.导线上有电流,电流方向a→b
D.反应后a极质量减小
D
解析 a金属可与稀硫酸反应,a为原电池的负极,a极失电子发生氧化反应,b为正极,发生还原反应,A不正确,D正确;溶液中的H+在b极上得电子生成氢气,c(H+)减小,B不正确;导线中电子流向为a→b,所以导线中电流方向为b→a,C不正确。
二、原电池原理的简单应用
实验装置示意图:
实验探究:观察产生气体的位置和产生气体的快慢。
———————【活动探究】———————
1.上述甲、乙装置中能量转化形式有何不同?
提示:装置甲中由化学能部分转化为热能,装置乙中化学能部分转化为电能。
2.产生H2的速率哪个快?为什么?
提示:装置乙产生H2的反应速率快。装置甲中,氧化反应和还原反应都在Zn表面进行,生成的Zn2+排斥H+,使H+越来越难靠近Zn表面得电子。装置乙构成了原电池,氧化反应和还原反应分别在两个不同区域进行,Zn失去的电子沿导线聚集在Cu棒上,溶液中H+非常容易靠近Cu表面得电子生成H2,因此反应速率加快。
1.加快氧化还原反应的速率
(1)原理:原电池中,氧化反应和还原反应分别在两极进行,使溶液中离子运动时相互的干扰减小,使反应速率增大。
(2)实例:实验室用Zn和稀硫酸反应制取氢气时,可滴入几滴硫酸铜溶液,形成原电池,加快反应速率。
———————【核心归纳】———————
2.比较金属的活动性强弱
原电池中,一般活动性强的金属为负极,活动性弱的金属为正极。即活动性:负极(金属)>正极(金属)。
3.用于保护金属
使被保护的金属制品与比其活泼的金属相连接,作原电池正极而得到保护。例如,在大海中航行的轮船,钢制船壳上常镶嵌一定量的锌块,锌块与钢铁外壳形成原电池,锌作负极,铁作正极被保护。
3.实验室制取氢气最好的方法是( )
A.纯锌与稀硫酸反应
B.纯锌与浓硫酸反应
C.纯锌与稀盐酸反应
D.粗锌(含铜、银)与稀硫酸反应
解析 含有铜和银的粗锌与稀硫酸反应时,由于发生原电池反应,生成氢气的速率加快。
———————【实践应用】———————
D
4.利用原电池原理可比较金属的活泼性,原电池中,作负极的金属活动性一般比作正极的金属活动性强。结合相关知识解答下列问题。
由A、B、C三种金属按表中装置进行实验:
装置 甲 乙
现象 A不断溶解,B上产生气泡 C的质量增加,B的质量减轻
(1)在甲中,金属片________(填“A”或“B”)发生氧化反应。
(2)在乙中,金属片________(填“B”或“C”)作负极。
(3)如果把B、C用导线连接后同时浸入稀硫酸溶液中,有一电极产生气泡。则金属片________(填“B”或“C”)上有气泡产生。
(4)上述三种金属的活动性顺序是____________。
答案 (1)A (2)B (3)C (4)A>B>C
核心体系建构
1.下列设备工作时,将化学能转化为电能的是( )
A
A B C D
锂离子电池 太阳能集热器 燃气灶 硅太阳能电池
解析 A项,锂离子电池将化学能转化为电能,故正确;B项,太阳能集热器将太阳能转化为热能,故错误;C项,燃烧是放热反应,将化学能转化为热能,故错误;D项,硅太阳能电池将太阳能转化为电能,故错误。
A
2.下列叙述不正确的是( )
A.用天然气火力发电时,每一步都需要化学反应来完成
B.利用太阳能等清洁能源代替化石燃料,有利于节约资源,保护环境
C.原电池反应一定为氧化还原反应
D.在火力发电时,化学能转化为热能的过程实际上是氧化还原反应发生的过程,伴随着能量的变化
C
3.如图所示,两电极一为碳棒,一为铁片,若电流计的指针发生偏转, 且a极上有大量气泡生成,则以下叙述正确的是( )
选项 a电极名称 a电极材料 烧杯溶液
A 负极 Fe 稀硫酸
B 负极 Fe 硫酸铜溶液
C 正极 碳棒 稀硫酸
D 正极 碳棒 硫酸铜溶液
解析 Fe、C形成的原电池中,负极铁失去电子,变成+2价的亚铁离子,由于a极上有大量气泡产生,所以为正极(C):2H++2e-===H2↑,a为正极,是碳棒;b为负极,是铁片;电解质溶液为硫酸溶液。
B
4.将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两个装置都构成了原电池
B.甲装置构成了原电池,乙装置没有构成原电池
C.两烧杯中的锌片上都有大量气泡产生
D.产生气泡的速率甲比乙慢
解析 甲中构成了铜锌原电池,锌作负极,失电子;铜作正极,H+在铜极上得电子,生成H2;总反应式为Zn+H2SO4===ZnSO4+H2↑,乙装置没有构成原电池,因为没有形成闭合电路。构成原电池后生成H2的速率加快。
5.根据原电池原理,结合装置图,按要求解答问题:
(1)若X为Zn,Y为硫酸铜溶液,则X为________(填电极名称),
判断依据:_________________________________________;
铜电极的名称是________,溶液中的Cu2+移向________(填
“Cu”或“X”)电极。
(2)若X为银,Y为硝酸银溶液,则X为________(填电极名称),判断依据:________________________________________________________________;
铜电极的名称是________,溶液中的Ag+移向________(填“Cu”或“X”)电极。
(3)若X为Fe,Y为浓硝酸,则Cu为________(填电极名称),铜电极可能观察到的现象是___________________________________________________;X电极的名称是________。
答案 (1)负极 锌的活泼性比铜强(或Zn的还原性比Cu强) 正极 Cu (2)正极 铜的活泼性比银强(或Cu的还原性比Ag强) 负极 X (3)负极 铜电极逐渐溶解,溶液变蓝 正极
一、选择题(每小题只有一个选项符合题意)
1.下面是四个化学反应,你认为理论上不可用于设计原电池的化学反应是( )
D
解析 D是吸热的氧化还原反应,反应过程中吸收能量,不能设计为原电池。
2.下列各装置露置在空气中,能在外电路获得电流的是( )
B
解析 A、D项,两极的材料相同,不能形成原电池;C项,酒精是非电解质,不能形成原电池。
3.下列关于原电池的叙述中,不正确的是( )
C
A.原电池的负极发生的反应是氧化反应
B.原电池的正极上发生的反应为还原反应
C.原电池电解质溶液中阳离子移向负极,阴离子移向正极
D.原电池中电子流入的极一定是正极
解析 原电池的负极失去电子被氧化,发生氧化反应,A正确;原电池正极得电子,发生还原反应,B正确;在原电池电解质溶液中,阳离子向正极移动,阴离子向负极移动,C错误;原电池放电时,电子转移的方向是从负极沿导线流向正极,所以正极为电子流入的电极,D正确。
4.如图所示,电流计指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,下列说法错误的是( )
C
A.B极为原电池的正极
B.A、B、C可能分别为Zn、Cu、稀盐酸
C.C中阳离子向A极移动
D.A极发生氧化反应
解析 原电池中,负极金属失去电子溶解,质量减小,故A极是负极,B极是正极,根据构成情况可判断A、B、C可能分别为Zn、Cu、稀盐酸,A、B两项正确;离子移动方向:阳离子向正极移动,阴离子向负极移动,C项错误;负极发生氧化反应,正极发生还原反应,D项正确。
5.下列关于实验现象的描述不正确的是( )
C
A.铜、锌组成的原电池中,电子从锌极经过导线流向铜极
B.把铜片和锌片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
C.把铜片插入FeCl3溶液中,在铜片表面出现一层铁
D.将铜片和铁片用导线相连浸入硫酸铜溶液中,一段时间后,铁片质量减轻,铜片质量增加
解析 铜、锌组成的原电池中,金属锌作负极,金属铜作正极,电子从锌极流向铜极,故A项正确;把铜片和锌片紧靠在一起浸入稀硫酸中,形成铜—锌—稀硫酸原电池,金属铜作正极,该极上产生气体,故B项正确;把铜片插入FeCl3溶液中,Cu和FeCl3反应生成CuCl2和FeCl2,故C项错误;将铜片和铁片用导线相连浸入硫酸铜溶液中,形成原电池,铜片作正极,铁片作负极,铁片失电子,形成Fe2+进入溶液,质量减轻,溶液中的Cu2+在铜电极上得电子,生成单质铜,质量增加,故D项正确。
6.将铝片与铜片用导线连接后,插入浓硝酸的烧杯中。下列叙述正确的是( )
C
A.Al比Cu活泼,Al为负极,Cu极上析出NO2
B.Cu为负极,Al正极,Al极上析出Cu
C.Cu为负极,电极反应为Cu-2e-===Cu2+
D.Al为正极,电极反应为2H++2e-===H2↑
解析 Al在浓硝酸中发生钝化,Cu在浓硝酸中发生反应,被氧化,即在浓硝酸中活动性Cu>Al,Cu是原电池的负极,电极反应为Cu-2e-===Cu2+,Al是原电池的正极,由于HNO3的氧化性大于Cu2+和H+,故在该电极上硝酸根被还原。
7.我国在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是(已知质子交换膜只允许H+通过)( )
A
A.该制氢工艺中光能最终转化为化学能
B.该装置工作时,H+由b极区流向a极区
C.a极上发生的电极反应为Fe3++e-===Fe2+
D.a极区需不断补充含Fe3+和Fe2+的溶液
解析 该制氢工艺中光能转化为电能,最终转化为化学能,A项正确;该装置工作时,H+由a极区流向b极区,B项错误;a极上有电子流出,发生氧化反应,所以a极上发生的电极反应为Fe2+-e-===Fe3+,C项错误;由图可知,a极区Fe2+和Fe3+可相互转化,故不需补充含Fe3+和Fe2+的溶液,D项错误。
8.A、B、C都是金属,B中混有C时,只有C能被盐酸溶解;A、B与稀硫酸组成原电池时,A为电池的正极。A、B、C三种金属的活动性顺序为( )
C
A.A>B>C B.A>C>B
C.C>B>A D.B>C>A
解析 B中混有C时,只有C能被盐酸溶解,根据金属活动顺序表,推出C比B活泼,A、B与稀硫酸构成原电池,A为正极,则B为负极,根据原电池工作原理,推出B比A活泼,综上所述,金属活动性强弱顺序是C>B>A,故C正确。
9.已知金属锈蚀的原理是在潮湿空气中金属表面形成水膜,金属与杂质和水膜中溶解的电解质组成原电池,从而使金属锈蚀加快,下列制品的镀层损坏后,金属腐蚀速率最快的是( )
B
A.镀铝塑料扣 B.食品罐头盒(镀锡铁盒)
C.白铁水桶(镀锌) D.镀银铜质奖章
解析 在构成原电池的反应中,两极的活泼性差别越大,活泼金属被腐蚀的速度越快,故镀锡铁盒镀层破坏后腐蚀最快。
10.将等质量的两份锌粉a和b分别加入过量的稀硫酸,同时向a中加少量CuSO4溶液,下图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是( )
A
解析 a中加入少量CuSO4溶液,被置换出的Cu覆盖在Zn的表面,形成原电池,产生H2的速率加快,反应所需时间变短,但置换铜时消耗了一部分锌,故与稀硫酸反应的锌的量比b少,产生的H2量比b少。
11.某学生用如图装置研究原电池原理,下列说法错误的是( )
A
A.(3)中Zn片增加的质量与Cu片减小的质量的比值为65∶64
B.(2)与(3)中锌电极上发生的反应相同
C.(1)中铜片上没有气体产生
D.当(2)与(3)中正极生成物的质量比为1∶32时,通过外电路的电子数相等
解析 (3)中Zn片质量减小,Cu片质量增加,A项错误;(2)中Zn片失去电子发生氧化反应,(3)中Zn片也是失去电子发生氧化反应,B项正确;装置(1)不能形成原电池且铜不与稀硫酸反应,C项正确;(2)中正极产生氢气的质量为1 g时通过外电路的电子为1 mol,(3)中正极析出铜的质量为32 g时通过外电路的电子为1 mol,D项正确。
12.(2021·菏泽思源学校高一期末)现有X、Y、Z、W四种金属片,①把X、Y用导线连接后同时浸入硫酸溶液中,X上有气泡产生,Y溶解;②把Z、W用导线连接后同时浸入硫酸溶液中,W极上发生还原反应;③把X、Z用导线连接后同时浸入硫酸溶液中,电子流动方向为X→导线→Z。则下列选项中正确的是( )
C
A.①中金属片Y发生还原反应
B.②中金属片W做负极
C.上述四种金属的活动性顺序为Y>X>Z>W
D.如果把Y、W用导线相连后同时浸入硫酸溶液中,则电子流动方向为Y→溶液→W
解析 原电池中,一般来说,较活泼金属作负极、较不活泼金属作正极,负极上发生氧化反应、正极上发生还原反应;电子从负极沿导线流向正极。①把X、Y用导线连接后同时浸入稀硫酸溶液中,X上有气泡产生,Y溶解,说明X是正极、Y是负极,则金属活动性Y>X; ②把Z、W用导线连接后同时浸入稀硫酸溶液中,W极上发生还原反应,则W是正极、Z是负极,金属活动性Z>W;③把X、Z用导线连接后同时浸入稀硫酸溶液中,电子流动方向为X→导线→Z,则X是负极、Z是正极,金属活动性X>Z,通过以上分析知,金属活动性顺序是Y>X>Z>W;A.在①中,Y是负极、X是正极,负极上X得电子发生还原反应,Y失电子发生氧化反应,故A错误;B.在②中,金属片Z作负极、W作正极,故B错误;C.通过以上分析知,上述四种金属的活动顺序是Y>X>Z>W,故C正确;D.金属性Y>W,如果把Y、W用导线连接后同时浸入稀硫酸溶液,构成原电池,Y是负极、W是正极,则电子流动方向为Y→导线→W,故D错误。
二、非选择题
13.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)A中反应的离子方程式为______________________________________
________________________________________________________________。
(2)B中锡极为________极,电极反应式为________________,锡极附近溶液的酸性________(填“增强”“减弱”或“不变”)。B中Fe极为________极,电极反应式为_____________________________________________________
________________________________________________________________。
(3)C中被腐蚀的金属是________,总反应的化学方程式为________________________________________________________________。
(4)A、B、C中铁被腐蚀由快到慢的顺序是________。
答案 (1)Fe+2H+===Fe2++H2↑
(2)正 2H++2e-===H2↑ 减弱 负 Fe-2e-===Fe2+
(3)Zn Zn+H2SO4===ZnSO4+H2↑
(4)B>A>C
解析 A中不能形成原电池,铁与稀硫酸发生置换反应。B中能形成原电池,铁比锡活泼,锡为正极,铁为负极,铁被腐蚀的速率加快。C能形成原电池,锌比铁活泼,锌为负极,不断被腐蚀,铁为正极,保持不变。
14.Ⅰ.由A、B、C、D四种金属按下表中装置图进行实验。
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是________________________________。
(2)装置乙中正极的电极反应式是_________________________________。
(3)四种金属活动性由强到弱的顺序是_____________________________。
装置
现象 二价金属A不断溶解 C的质量增加 A上有气体产生
Ⅱ.分别按图所示甲、乙装置进行实验,图中两个烧杯中的溶液为相同浓度的稀硫酸,甲中 为电流表。
(1)下列叙述正确的是________(填字母)。
A.两烧杯中铜片表面均无气泡产生 B.甲中铜片作正极,乙中铜片作负极
C.两烧杯中溶液中的H+浓度均减小 D.产生气泡的速率:甲比乙慢
(2)甲装置中,某同学发现不仅铜片上有气泡产生,锌片上也产生了气体,原因可能是__________________________________________________________。
(3)甲装置中,若把稀硫酸换成CuSO4溶液,试写出铜电极的电极反应式:________________________________________________________________。
答案 Ⅰ.(1)A-2e-===A2+
(2)Cu2++2e-===Cu
(3)D>A>B>C
Ⅱ.(1)C (2)锌片不纯,锌与杂质构成原电池 (3)Cu2++2e-===Cu
解析 Ⅰ.(1)甲装置中,二价金属A不断溶解,说明A失电子发生氧化反应,则A作负极,B作正极,装置甲中负极的电极反应式是A-2e-===A2+。
(2)乙装置中,C的质量增加,说明C电极上铜离子得电子发生还原反应,则C作正极,B作负极,装置乙中正极的电极反应式是Cu2++2e-===Cu。
(3)丙装置中,A上有气体产生,说明A上氢离子得电子发生还原反应,则A作正极,D作负极,结合(1)(2)分析可知,四种金属活动性由强到弱的顺序是D>A>B>C。
Ⅱ.(1)铜不能与稀硫酸反应,则乙烧杯中铜片表面无气泡生成,甲装置中形成原电池,铜作正极,则甲烧杯中铜片表面有气泡产生,故A错误;乙装置没有形成闭合回路,不能形成原电池,故B错误;两烧杯中硫酸都参加反应,溶液中氢离子浓度均减小,故C正确;甲装置能形成原电池,其反应速率较一般化学反应速率更大,所以甲中产生气泡的速率比乙中快,故D错误。
(2)在甲装置中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,可能是由于锌片不纯,在锌片上形成原电池。(3)在甲装置中,如果把稀硫酸换成硫酸铜溶液,Cu2+在正极上得电子产生Cu,电极反应式为Cu2++2e-===Cu。
15.(2021·北京市第三十五中学高一期中)化学电池的发明,是贮能和供能技术的巨大进步。
(1)如图所示装置中,Cu片是________(填“正极”或“负极”)。
(2)如图所示装置可将_____________________________________________
(写化学方程式)反应释放的能量直接转变为电能;能证明产生电能的实验现象是________________、________________。
(3)锌在如图所示装置中的作用是传导电子、________。
(4)2019年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如下。
下列说法正确的是________(填序号)。
①A为电池的正极
②该装置实现了化学能转化为电能
③电池工作时,电池内部的锂离子定向移动
答案 (1)正极
(2)Zn+H2SO4===ZnSO4+H2↑ 电流表指针偏转 铜片上有气泡产生
(3)作负极反应物
(4)②③
解析 (1)Zn与硫酸反应,Cu不反应,Zn失去电子发生氧化反应,故Zn为负极,Cu为正极;(2)装置将反应:Zn+H2SO4===ZnSO4+H2↑ 释放的能量直接转变为电能,灵敏电流计可以检测电流,能证明产生电能的实验现象是:电流计的指针发生偏转,铜片上产生大量的气泡;(3)由于锌比铜活泼,故锌电极作负极,参与原电池反应,电极反应为:Zn-2e-===Zn2+,锌在如图所示装置中的作用是传导电子、作负极反应物;(4)①由图所示,电子从A极流出,流入B极,故A为负极,B为正极,①错误;②该装置为原电池,实现了化学能转化为电能,②正确;③由图所示,电池工作时,电池内部的锂离子从负极区向正极区定向移动,③正确。
Thanks!
本课时内容结束
第一节 化学反应与能
量变化
第2课时 化学反应与电能
第6章 化学反应与能量
【课程标准要求】
1.理解原电池的概念及工作原理,能正确判断原电池的正、负极。
2.设计实验认识构成原电池的条件。
新知自主预习
课堂互动探究
课时训练
目
录
CONTENTS
///////
///////
///////
课堂小结·即时达标
///////
一、化学能间接转化为电能——火力发电
1.火力发电的原理
首先通过化石燃料燃烧,使________________________,加热水使之________________以推动蒸汽轮机,然后带动发电机发电。
2.能量转化过程
3.关键——燃烧(氧化还原反应)
化学能转化为热能
汽化为蒸汽
热
机械
【微自测】
1.电能是国民生产生活中的重要能源,下图是2015年我国电力生产量的构成图。
下列有关火力发电的描述,正确的是( )
A.火力发电的能量转换形式为化学能直接转化为电能
B.火力发电的主要燃料为煤,煤炭是可再生能源
C.火力发电不但排放出大量温室气体,还可能导致酸雨
D.火力发电过程中的能量转化,热能转化为机械能是关键
C
解析 火力发电过程是化学能→热能→机械能→电能,是化学能间接转化为电能,A错误;作火力发电燃料的煤为不可再生能源,B错误;在燃煤过程中,会产生大量CO2和SO2,可导致温室效应及酸雨,C正确;火力发电过程中,燃烧是关键,D错误。
二、化学能直接转化为电能——原电池
1.概念:将________能转化为________能的装置。
化学
电
2.工作原理(以锌-铜-稀硫酸为例)
电极名称 负极 正极
电极材料 ________片 ________片
电极反应
反应类型 ________反应 ________反应
电子流向 由________片沿导线流向________片 电流方向 由________片沿导线流向Zn片 总反应的离子方程式 锌
铜
Zn-2e-===Zn2+
2H++2e-===H2↑
氧化
还原
Zn
Cu
Cu
Zn+2H+===Zn2++H2↑
【微自测】
2.右图为锌铜原电池装置的示意图,下列有关说法正确的是( )
A.铜片作负极
B.锌发生还原反应
C.溶液中c(H+)逐渐减小
D.电子由铜片经导线流向锌片
C
二、原电池原理的简单应用
一、原电池的工作原理探究
一、原电池的工作原理探究
实验步骤1:将锌片和铜片插入盛有稀硫酸的烧杯中,观察现象。
实验装置如图1:
———————【活动探究】———————
图1
实验步骤2:用导线连接锌片和铜片,观察、比较导线连接前后的现象。
实验装置如图2:
图2
实验步骤3:用导线在锌片和铜片之间串联一个电流表,观察电流表的指针是否偏转。
实验装置如图3:
图3
1.装置2、3中铜片不与稀硫酸反应,为什么铜上会有氢气生成?
提示:虽然铜不活泼,不能失去电子,但锌比铜活泼,锌与稀硫酸接触时,失去电子,这些电子沿着导线传递到铜的表面,被溶液中接近的氢离子获得后,形成了氢气放出。
2.若将装置3中铜片换作石墨棒,能否产生电流?电极反应有无变化?
提示:改为石墨棒后,仍可形成原电池,产生电流。更换后锌作负极,石墨棒作正极,电极反应与电池总反应均不变。
3.若将装置3中稀硫酸换成硫酸铜溶液,能否产生电流 电极反应有何不同?
提示:将稀硫酸换成硫酸铜溶液,同样能形成原电池 ,产生电流。Zn作负极,发生失电子的氧化反应,电极反应式为Zn-2e-=== Zn2+;铜作正极,溶液中的Cu2+在铜电极上发生得电子的还原反应,电极反应式为Cu2++2e-===Cu,总反应式为Zn+Cu2+===Cu+Zn2+。
4.原电池的电极材料都必须是金属吗?
提示:原电池的电极材料可以是两种活泼性不同的金属 ,也可以是一种金属与一种可导电的惰性材料(如非金属石墨等)。
1.原电池的构成条件
———————【核心归纳】———————
2.工作原理
(1)反应类型:负极发生氧化反应,正极发生还原反应。
(2)电子的移动方向:从负极流出,经导线流向正极。
(3)离子的移动方向:阳离子向正极移动,阴离子向负极移动。
(4)电流方向:正极→导线→负极。
3.原电池正、负极的判断
在原电池中,电子在导线中定向移动(由负极流出,流入正极),离子在溶液中定向移动(阳离子移向正极,阴离子移向负极),即“电子不下水,离子不上岸”或“电子走陆路,离子走水路”,它们共同组成了一个完整的闭合回路。
——原电池中电子、离子的移动规律及判断口诀
1.如图所示各装置示意图中,不能构成原电池的是(烧杯中所盛液体都是稀硫酸)( )
———————【实践应用】———————
D
解析 原电池的形成条件包括活动性不同的电极、电解质溶液、形成闭合回路、自发进行氧化还原反应。对图示各个装置示意图进行观察,发现只有D项不能形成闭合回路,因此D项不能形成原电池。
2.如图所示,a的金属活动性在氢之前,b为碳棒。关于该装置的说法中,正确的是( )
A.a极上发生还原反应,b极上发生氧化反应
B.碳棒上有气体逸出,溶液中c(H+)增大
C.导线上有电流,电流方向a→b
D.反应后a极质量减小
D
解析 a金属可与稀硫酸反应,a为原电池的负极,a极失电子发生氧化反应,b为正极,发生还原反应,A不正确,D正确;溶液中的H+在b极上得电子生成氢气,c(H+)减小,B不正确;导线中电子流向为a→b,所以导线中电流方向为b→a,C不正确。
二、原电池原理的简单应用
实验装置示意图:
实验探究:观察产生气体的位置和产生气体的快慢。
———————【活动探究】———————
1.上述甲、乙装置中能量转化形式有何不同?
提示:装置甲中由化学能部分转化为热能,装置乙中化学能部分转化为电能。
2.产生H2的速率哪个快?为什么?
提示:装置乙产生H2的反应速率快。装置甲中,氧化反应和还原反应都在Zn表面进行,生成的Zn2+排斥H+,使H+越来越难靠近Zn表面得电子。装置乙构成了原电池,氧化反应和还原反应分别在两个不同区域进行,Zn失去的电子沿导线聚集在Cu棒上,溶液中H+非常容易靠近Cu表面得电子生成H2,因此反应速率加快。
1.加快氧化还原反应的速率
(1)原理:原电池中,氧化反应和还原反应分别在两极进行,使溶液中离子运动时相互的干扰减小,使反应速率增大。
(2)实例:实验室用Zn和稀硫酸反应制取氢气时,可滴入几滴硫酸铜溶液,形成原电池,加快反应速率。
———————【核心归纳】———————
2.比较金属的活动性强弱
原电池中,一般活动性强的金属为负极,活动性弱的金属为正极。即活动性:负极(金属)>正极(金属)。
3.用于保护金属
使被保护的金属制品与比其活泼的金属相连接,作原电池正极而得到保护。例如,在大海中航行的轮船,钢制船壳上常镶嵌一定量的锌块,锌块与钢铁外壳形成原电池,锌作负极,铁作正极被保护。
3.实验室制取氢气最好的方法是( )
A.纯锌与稀硫酸反应
B.纯锌与浓硫酸反应
C.纯锌与稀盐酸反应
D.粗锌(含铜、银)与稀硫酸反应
解析 含有铜和银的粗锌与稀硫酸反应时,由于发生原电池反应,生成氢气的速率加快。
———————【实践应用】———————
D
4.利用原电池原理可比较金属的活泼性,原电池中,作负极的金属活动性一般比作正极的金属活动性强。结合相关知识解答下列问题。
由A、B、C三种金属按表中装置进行实验:
装置 甲 乙
现象 A不断溶解,B上产生气泡 C的质量增加,B的质量减轻
(1)在甲中,金属片________(填“A”或“B”)发生氧化反应。
(2)在乙中,金属片________(填“B”或“C”)作负极。
(3)如果把B、C用导线连接后同时浸入稀硫酸溶液中,有一电极产生气泡。则金属片________(填“B”或“C”)上有气泡产生。
(4)上述三种金属的活动性顺序是____________。
答案 (1)A (2)B (3)C (4)A>B>C
核心体系建构
1.下列设备工作时,将化学能转化为电能的是( )
A
A B C D
锂离子电池 太阳能集热器 燃气灶 硅太阳能电池
解析 A项,锂离子电池将化学能转化为电能,故正确;B项,太阳能集热器将太阳能转化为热能,故错误;C项,燃烧是放热反应,将化学能转化为热能,故错误;D项,硅太阳能电池将太阳能转化为电能,故错误。
A
2.下列叙述不正确的是( )
A.用天然气火力发电时,每一步都需要化学反应来完成
B.利用太阳能等清洁能源代替化石燃料,有利于节约资源,保护环境
C.原电池反应一定为氧化还原反应
D.在火力发电时,化学能转化为热能的过程实际上是氧化还原反应发生的过程,伴随着能量的变化
C
3.如图所示,两电极一为碳棒,一为铁片,若电流计的指针发生偏转, 且a极上有大量气泡生成,则以下叙述正确的是( )
选项 a电极名称 a电极材料 烧杯溶液
A 负极 Fe 稀硫酸
B 负极 Fe 硫酸铜溶液
C 正极 碳棒 稀硫酸
D 正极 碳棒 硫酸铜溶液
解析 Fe、C形成的原电池中,负极铁失去电子,变成+2价的亚铁离子,由于a极上有大量气泡产生,所以为正极(C):2H++2e-===H2↑,a为正极,是碳棒;b为负极,是铁片;电解质溶液为硫酸溶液。
B
4.将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两个装置都构成了原电池
B.甲装置构成了原电池,乙装置没有构成原电池
C.两烧杯中的锌片上都有大量气泡产生
D.产生气泡的速率甲比乙慢
解析 甲中构成了铜锌原电池,锌作负极,失电子;铜作正极,H+在铜极上得电子,生成H2;总反应式为Zn+H2SO4===ZnSO4+H2↑,乙装置没有构成原电池,因为没有形成闭合电路。构成原电池后生成H2的速率加快。
5.根据原电池原理,结合装置图,按要求解答问题:
(1)若X为Zn,Y为硫酸铜溶液,则X为________(填电极名称),
判断依据:_________________________________________;
铜电极的名称是________,溶液中的Cu2+移向________(填
“Cu”或“X”)电极。
(2)若X为银,Y为硝酸银溶液,则X为________(填电极名称),判断依据:________________________________________________________________;
铜电极的名称是________,溶液中的Ag+移向________(填“Cu”或“X”)电极。
(3)若X为Fe,Y为浓硝酸,则Cu为________(填电极名称),铜电极可能观察到的现象是___________________________________________________;X电极的名称是________。
答案 (1)负极 锌的活泼性比铜强(或Zn的还原性比Cu强) 正极 Cu (2)正极 铜的活泼性比银强(或Cu的还原性比Ag强) 负极 X (3)负极 铜电极逐渐溶解,溶液变蓝 正极
一、选择题(每小题只有一个选项符合题意)
1.下面是四个化学反应,你认为理论上不可用于设计原电池的化学反应是( )
D
解析 D是吸热的氧化还原反应,反应过程中吸收能量,不能设计为原电池。
2.下列各装置露置在空气中,能在外电路获得电流的是( )
B
解析 A、D项,两极的材料相同,不能形成原电池;C项,酒精是非电解质,不能形成原电池。
3.下列关于原电池的叙述中,不正确的是( )
C
A.原电池的负极发生的反应是氧化反应
B.原电池的正极上发生的反应为还原反应
C.原电池电解质溶液中阳离子移向负极,阴离子移向正极
D.原电池中电子流入的极一定是正极
解析 原电池的负极失去电子被氧化,发生氧化反应,A正确;原电池正极得电子,发生还原反应,B正确;在原电池电解质溶液中,阳离子向正极移动,阴离子向负极移动,C错误;原电池放电时,电子转移的方向是从负极沿导线流向正极,所以正极为电子流入的电极,D正确。
4.如图所示,电流计指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,下列说法错误的是( )
C
A.B极为原电池的正极
B.A、B、C可能分别为Zn、Cu、稀盐酸
C.C中阳离子向A极移动
D.A极发生氧化反应
解析 原电池中,负极金属失去电子溶解,质量减小,故A极是负极,B极是正极,根据构成情况可判断A、B、C可能分别为Zn、Cu、稀盐酸,A、B两项正确;离子移动方向:阳离子向正极移动,阴离子向负极移动,C项错误;负极发生氧化反应,正极发生还原反应,D项正确。
5.下列关于实验现象的描述不正确的是( )
C
A.铜、锌组成的原电池中,电子从锌极经过导线流向铜极
B.把铜片和锌片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
C.把铜片插入FeCl3溶液中,在铜片表面出现一层铁
D.将铜片和铁片用导线相连浸入硫酸铜溶液中,一段时间后,铁片质量减轻,铜片质量增加
解析 铜、锌组成的原电池中,金属锌作负极,金属铜作正极,电子从锌极流向铜极,故A项正确;把铜片和锌片紧靠在一起浸入稀硫酸中,形成铜—锌—稀硫酸原电池,金属铜作正极,该极上产生气体,故B项正确;把铜片插入FeCl3溶液中,Cu和FeCl3反应生成CuCl2和FeCl2,故C项错误;将铜片和铁片用导线相连浸入硫酸铜溶液中,形成原电池,铜片作正极,铁片作负极,铁片失电子,形成Fe2+进入溶液,质量减轻,溶液中的Cu2+在铜电极上得电子,生成单质铜,质量增加,故D项正确。
6.将铝片与铜片用导线连接后,插入浓硝酸的烧杯中。下列叙述正确的是( )
C
A.Al比Cu活泼,Al为负极,Cu极上析出NO2
B.Cu为负极,Al正极,Al极上析出Cu
C.Cu为负极,电极反应为Cu-2e-===Cu2+
D.Al为正极,电极反应为2H++2e-===H2↑
解析 Al在浓硝酸中发生钝化,Cu在浓硝酸中发生反应,被氧化,即在浓硝酸中活动性Cu>Al,Cu是原电池的负极,电极反应为Cu-2e-===Cu2+,Al是原电池的正极,由于HNO3的氧化性大于Cu2+和H+,故在该电极上硝酸根被还原。
7.我国在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是(已知质子交换膜只允许H+通过)( )
A
A.该制氢工艺中光能最终转化为化学能
B.该装置工作时,H+由b极区流向a极区
C.a极上发生的电极反应为Fe3++e-===Fe2+
D.a极区需不断补充含Fe3+和Fe2+的溶液
解析 该制氢工艺中光能转化为电能,最终转化为化学能,A项正确;该装置工作时,H+由a极区流向b极区,B项错误;a极上有电子流出,发生氧化反应,所以a极上发生的电极反应为Fe2+-e-===Fe3+,C项错误;由图可知,a极区Fe2+和Fe3+可相互转化,故不需补充含Fe3+和Fe2+的溶液,D项错误。
8.A、B、C都是金属,B中混有C时,只有C能被盐酸溶解;A、B与稀硫酸组成原电池时,A为电池的正极。A、B、C三种金属的活动性顺序为( )
C
A.A>B>C B.A>C>B
C.C>B>A D.B>C>A
解析 B中混有C时,只有C能被盐酸溶解,根据金属活动顺序表,推出C比B活泼,A、B与稀硫酸构成原电池,A为正极,则B为负极,根据原电池工作原理,推出B比A活泼,综上所述,金属活动性强弱顺序是C>B>A,故C正确。
9.已知金属锈蚀的原理是在潮湿空气中金属表面形成水膜,金属与杂质和水膜中溶解的电解质组成原电池,从而使金属锈蚀加快,下列制品的镀层损坏后,金属腐蚀速率最快的是( )
B
A.镀铝塑料扣 B.食品罐头盒(镀锡铁盒)
C.白铁水桶(镀锌) D.镀银铜质奖章
解析 在构成原电池的反应中,两极的活泼性差别越大,活泼金属被腐蚀的速度越快,故镀锡铁盒镀层破坏后腐蚀最快。
10.将等质量的两份锌粉a和b分别加入过量的稀硫酸,同时向a中加少量CuSO4溶液,下图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是( )
A
解析 a中加入少量CuSO4溶液,被置换出的Cu覆盖在Zn的表面,形成原电池,产生H2的速率加快,反应所需时间变短,但置换铜时消耗了一部分锌,故与稀硫酸反应的锌的量比b少,产生的H2量比b少。
11.某学生用如图装置研究原电池原理,下列说法错误的是( )
A
A.(3)中Zn片增加的质量与Cu片减小的质量的比值为65∶64
B.(2)与(3)中锌电极上发生的反应相同
C.(1)中铜片上没有气体产生
D.当(2)与(3)中正极生成物的质量比为1∶32时,通过外电路的电子数相等
解析 (3)中Zn片质量减小,Cu片质量增加,A项错误;(2)中Zn片失去电子发生氧化反应,(3)中Zn片也是失去电子发生氧化反应,B项正确;装置(1)不能形成原电池且铜不与稀硫酸反应,C项正确;(2)中正极产生氢气的质量为1 g时通过外电路的电子为1 mol,(3)中正极析出铜的质量为32 g时通过外电路的电子为1 mol,D项正确。
12.(2021·菏泽思源学校高一期末)现有X、Y、Z、W四种金属片,①把X、Y用导线连接后同时浸入硫酸溶液中,X上有气泡产生,Y溶解;②把Z、W用导线连接后同时浸入硫酸溶液中,W极上发生还原反应;③把X、Z用导线连接后同时浸入硫酸溶液中,电子流动方向为X→导线→Z。则下列选项中正确的是( )
C
A.①中金属片Y发生还原反应
B.②中金属片W做负极
C.上述四种金属的活动性顺序为Y>X>Z>W
D.如果把Y、W用导线相连后同时浸入硫酸溶液中,则电子流动方向为Y→溶液→W
解析 原电池中,一般来说,较活泼金属作负极、较不活泼金属作正极,负极上发生氧化反应、正极上发生还原反应;电子从负极沿导线流向正极。①把X、Y用导线连接后同时浸入稀硫酸溶液中,X上有气泡产生,Y溶解,说明X是正极、Y是负极,则金属活动性Y>X; ②把Z、W用导线连接后同时浸入稀硫酸溶液中,W极上发生还原反应,则W是正极、Z是负极,金属活动性Z>W;③把X、Z用导线连接后同时浸入稀硫酸溶液中,电子流动方向为X→导线→Z,则X是负极、Z是正极,金属活动性X>Z,通过以上分析知,金属活动性顺序是Y>X>Z>W;A.在①中,Y是负极、X是正极,负极上X得电子发生还原反应,Y失电子发生氧化反应,故A错误;B.在②中,金属片Z作负极、W作正极,故B错误;C.通过以上分析知,上述四种金属的活动顺序是Y>X>Z>W,故C正确;D.金属性Y>W,如果把Y、W用导线连接后同时浸入稀硫酸溶液,构成原电池,Y是负极、W是正极,则电子流动方向为Y→导线→W,故D错误。
二、非选择题
13.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)A中反应的离子方程式为______________________________________
________________________________________________________________。
(2)B中锡极为________极,电极反应式为________________,锡极附近溶液的酸性________(填“增强”“减弱”或“不变”)。B中Fe极为________极,电极反应式为_____________________________________________________
________________________________________________________________。
(3)C中被腐蚀的金属是________,总反应的化学方程式为________________________________________________________________。
(4)A、B、C中铁被腐蚀由快到慢的顺序是________。
答案 (1)Fe+2H+===Fe2++H2↑
(2)正 2H++2e-===H2↑ 减弱 负 Fe-2e-===Fe2+
(3)Zn Zn+H2SO4===ZnSO4+H2↑
(4)B>A>C
解析 A中不能形成原电池,铁与稀硫酸发生置换反应。B中能形成原电池,铁比锡活泼,锡为正极,铁为负极,铁被腐蚀的速率加快。C能形成原电池,锌比铁活泼,锌为负极,不断被腐蚀,铁为正极,保持不变。
14.Ⅰ.由A、B、C、D四种金属按下表中装置图进行实验。
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是________________________________。
(2)装置乙中正极的电极反应式是_________________________________。
(3)四种金属活动性由强到弱的顺序是_____________________________。
装置
现象 二价金属A不断溶解 C的质量增加 A上有气体产生
Ⅱ.分别按图所示甲、乙装置进行实验,图中两个烧杯中的溶液为相同浓度的稀硫酸,甲中 为电流表。
(1)下列叙述正确的是________(填字母)。
A.两烧杯中铜片表面均无气泡产生 B.甲中铜片作正极,乙中铜片作负极
C.两烧杯中溶液中的H+浓度均减小 D.产生气泡的速率:甲比乙慢
(2)甲装置中,某同学发现不仅铜片上有气泡产生,锌片上也产生了气体,原因可能是__________________________________________________________。
(3)甲装置中,若把稀硫酸换成CuSO4溶液,试写出铜电极的电极反应式:________________________________________________________________。
答案 Ⅰ.(1)A-2e-===A2+
(2)Cu2++2e-===Cu
(3)D>A>B>C
Ⅱ.(1)C (2)锌片不纯,锌与杂质构成原电池 (3)Cu2++2e-===Cu
解析 Ⅰ.(1)甲装置中,二价金属A不断溶解,说明A失电子发生氧化反应,则A作负极,B作正极,装置甲中负极的电极反应式是A-2e-===A2+。
(2)乙装置中,C的质量增加,说明C电极上铜离子得电子发生还原反应,则C作正极,B作负极,装置乙中正极的电极反应式是Cu2++2e-===Cu。
(3)丙装置中,A上有气体产生,说明A上氢离子得电子发生还原反应,则A作正极,D作负极,结合(1)(2)分析可知,四种金属活动性由强到弱的顺序是D>A>B>C。
Ⅱ.(1)铜不能与稀硫酸反应,则乙烧杯中铜片表面无气泡生成,甲装置中形成原电池,铜作正极,则甲烧杯中铜片表面有气泡产生,故A错误;乙装置没有形成闭合回路,不能形成原电池,故B错误;两烧杯中硫酸都参加反应,溶液中氢离子浓度均减小,故C正确;甲装置能形成原电池,其反应速率较一般化学反应速率更大,所以甲中产生气泡的速率比乙中快,故D错误。
(2)在甲装置中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,可能是由于锌片不纯,在锌片上形成原电池。(3)在甲装置中,如果把稀硫酸换成硫酸铜溶液,Cu2+在正极上得电子产生Cu,电极反应式为Cu2++2e-===Cu。
15.(2021·北京市第三十五中学高一期中)化学电池的发明,是贮能和供能技术的巨大进步。
(1)如图所示装置中,Cu片是________(填“正极”或“负极”)。
(2)如图所示装置可将_____________________________________________
(写化学方程式)反应释放的能量直接转变为电能;能证明产生电能的实验现象是________________、________________。
(3)锌在如图所示装置中的作用是传导电子、________。
(4)2019年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如下。
下列说法正确的是________(填序号)。
①A为电池的正极
②该装置实现了化学能转化为电能
③电池工作时,电池内部的锂离子定向移动
答案 (1)正极
(2)Zn+H2SO4===ZnSO4+H2↑ 电流表指针偏转 铜片上有气泡产生
(3)作负极反应物
(4)②③
解析 (1)Zn与硫酸反应,Cu不反应,Zn失去电子发生氧化反应,故Zn为负极,Cu为正极;(2)装置将反应:Zn+H2SO4===ZnSO4+H2↑ 释放的能量直接转变为电能,灵敏电流计可以检测电流,能证明产生电能的实验现象是:电流计的指针发生偏转,铜片上产生大量的气泡;(3)由于锌比铜活泼,故锌电极作负极,参与原电池反应,电极反应为:Zn-2e-===Zn2+,锌在如图所示装置中的作用是传导电子、作负极反应物;(4)①由图所示,电子从A极流出,流入B极,故A为负极,B为正极,①错误;②该装置为原电池,实现了化学能转化为电能,②正确;③由图所示,电池工作时,电池内部的锂离子从负极区向正极区定向移动,③正确。
Thanks!
本课时内容结束
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
