2022—2023学年化学人教版九年级下册第8单元 金属和金属材料 同步练习(有答案)
文档属性
| 名称 | 2022—2023学年化学人教版九年级下册第8单元 金属和金属材料 同步练习(有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 214.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-12 15:47:44 | ||
图片预览




文档简介
2022—2023学年化学人教版九年级下册第8单元 金属和金属材料 同步练习含答案
人教第8单元 金属和金属材料
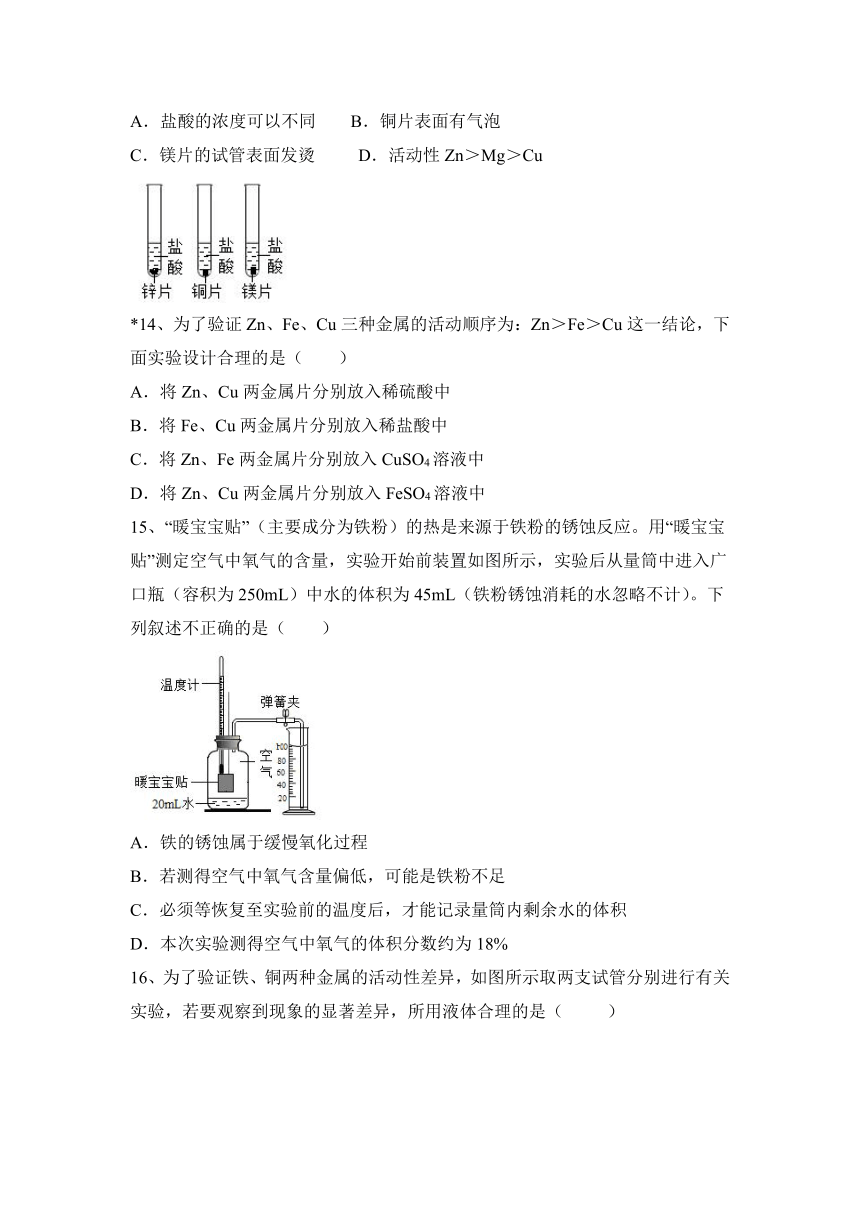
一、选择题。
1、在下面的物理性质中:①银白色金属;②延展性;③导热性;④导电性;⑤被磁铁吸引。其中铁、铜、铝三种金属都具有的是( )
A.①②③ B.②③④ C.③④⑤ D.①⑤
2、下列关于金属与氧气反应的说法中正确的是( )
A.细铁丝在空气中不能燃烧,是因为温度没有达到其着火点
B.铜在空气中能与氧气发生化学反应,其化学方程式为Cu+O2CuO
C.“真金不怕火炼”说明即使在高温条件下金也不与氧气反应
D.金属与氧气发生化学反应时,都需要在点燃或加热的条件下才能发生
3、下列各组实验,不能说明铁和铜的金属活动性强弱的是( )
A.铁丝和铜丝分别插入稀硫酸中
B.铁丝和铜丝分别插入硝酸银溶液中
C.铜丝插入硫酸亚铁溶液中
D.铁丝插入硫酸铜溶液中
4、下列关于工业炼铁的说法错误的是( )
A.高炉炼铁得到的是纯铁
B.石灰石的作用是除去二氧化硅,形成炉渣
C.高炉中焦炭的作用是产生一氧化碳和提供热量
D.工业炼铁原料有铁矿石、焦炭、石灰石和空气
5、下列做法中不利于保护金属资源的是( )
A.在金属制品表面刷漆、涂油防止金属腐蚀
B.回收铝质饮料罐
C.扩大开采规模
D.寻找金属的替代品
6、下列物质的用途主要由其物理性质决定的是( )
A.金刚石切割大理石 B.碳素墨水写档案
C.氮气用于食品防腐 D.黄铁矿用于炼铁
7、现有X、Y、Z三种金属,已知:①X+YCl2===XCl2+Y,②把Y、Z两种金属分别放入稀硫酸中,只有 Y 和稀硫酸反应。这三种金属的活动性由强到弱的顺序是( )
A. X>Z>Y B. Z>Y>X C. Y>Z>X D. X>Y>Z
8、铜能被加工成厚度仅为7微米的超薄铜箔,说明铜具有良好的( )
A.延展性 B.导电性 C.导热性 D.抗腐蚀性
9、下列物质可由金属与酸直接反应制得的是( )
A.AgCl B.CuSO4 C.Fe2(SO4)3 D.AlCl3
10、下表是2019年北京市某转运站生活垃圾组成的质量分数(%),该转运站生活垃圾中数量最多的是( )
厨余 纸类 塑料 玻璃 金属 木竹 砖瓦 纺织类 灰土类
39-53 17-24 18-26 0.9-1.9 0.1-0.3 1.7-6.1 0.8-2 1.1-4.4 1-4.9
A.厨余垃圾 B.纸质垃圾 C.塑料垃圾 D.砖瓦垃圾
11、把锌片放入CuSO4溶液中,锌片表面覆盖一层红色物质,一会儿又有气泡冒出,同学们对此现象进行猜想和分析,其中没有科学依据的是( )
A. 甲认为红色物质是铜
B. 乙认为锌的活动性比铜强
C. 丙推测气体是二氧化碳并检验
D. 丁猜想CuSO4溶液呈酸性并检验
12、黄铜是铜锌合金,将纯铜片和黄铜片相互刻划(如右图所示),是为了比较二者的( )
A.硬度 B.延展性 C.密度 D.颜色
13、铜、镁的金属活动性时,下列现象、分析或结论正确的是( )
A.盐酸的浓度可以不同 B.铜片表面有气泡
C.镁片的试管表面发烫 D.活动性Zn>Mg>Cu
*14、为了验证Zn、Fe、Cu三种金属的活动顺序为:Zn>Fe>Cu这一结论,下面实验设计合理的是( )
A.将Zn、Cu两金属片分别放入稀硫酸中
B.将Fe、Cu两金属片分别放入稀盐酸中
C.将Zn、Fe两金属片分别放入CuSO4溶液中
D.将Zn、Cu两金属片分别放入FeSO4溶液中
15、“暖宝宝贴”(主要成分为铁粉)的热是来源于铁粉的锈蚀反应。用“暖宝宝贴”测定空气中氧气的含量,实验开始前装置如图所示,实验后从量筒中进入广口瓶(容积为250mL)中水的体积为45mL(铁粉锈蚀消耗的水忽略不计)。下列叙述不正确的是( )
A.铁的锈蚀属于缓慢氧化过程
B.若测得空气中氧气含量偏低,可能是铁粉不足
C.必须等恢复至实验前的温度后,才能记录量筒内剩余水的体积
D.本次实验测得空气中氧气的体积分数约为18%
16、为了验证铁、铜两种金属的活动性差异,如图所示取两支试管分别进行有关实验,若要观察到现象的显著差异,所用液体合理的是( )
A. 蒸馏水 B. 稀盐酸 C. 酒精水溶液 D. 硫酸钠溶液
二、填空题。
17、人类使用金属的历史,由早到晚的顺序正确的是________,目前世界上金属的年产量由多到少的顺序是________。(均填字母序号)
A.铁→铜→铝 B.铜→铝→铁 C.铜→铁→铝 D.铁→铝→铜
18、根据图示化合物与单质相互转化的关系回答:
若乙的溶液是浅绿色,Y是红色固体,则X是________。
19、铁锈主要成分 (填化学式),铁锈的颜色为 。
20、向5支试管中分别加入用砂纸打磨后的镁条、铝片、锌片、铁片、铜片,然后分别加入5 mL稀硫酸。其中金属 的表面不会产生气泡;能产生气泡且速率最快的金属是 ;试写出铝与稀硫酸反应的化学方程式: 。
21、导电性最好的金属是____________。
22、用铝丝、洁净的铜丝、稀盐酸、AgNO3溶液,验证Al、Cu Ag的活动性顺序。
(1)把打磨过的铝丝和洁净的铜丝分别浸入稀盐酸中,观察到铝丝表面有气泡产生,铜丝表面无明显现象,由此判断出Al和Cu的活动性强弱顺序为________>(H)>________;发生反应的基本反应类型是________ ;铝丝使用前需用砂纸打磨的原因是________ ;
(2)为了达到实验目的,除(1)中实验外,还需要进行的实验是:
________ 。
23、金属与我们的生活息息相关,在各个领域中用途广泛。
(1)化工生产中,人们习惯上把金、银、铜、铁、锡五种金属统称为“五金,在“五金”顺序中若将 的位置移到最后,正好符合由弱到强的金属活动性顺序。
(2)“沙里淘金”说明金在自然界中能以 (选填“单质”或“化合物“)的形式存在。
(3)日常使用的金属材料大部分为合金,焊锡是一种重要的合金,常用来焊接电子元件等,这是因为与其组成的金属相比,焊锡具有 的特性。
(4)铜锈的主要成分是碱式碳酸铜【Cu2(OH)2CO3】,是铜与空气中的氧气、水和 共同作用的结果。
(5)金属矿物的储量有限,而且不能再生,保护金属资源的有效途径除防止金属的腐蚀外,还有 (写出一条即可)等。
三、实验题。
24、人类每年要向自然界索取大量的金属矿物资源,金属的用途与它们的物理性质和化学性质有着密切的关系,请回答下列问题。
(1)如图甲所示,将纯铜片和黄铜片互相刻画,纯铜片上留下明显的痕迹,这一实验现象说明了 。
(2)如图乙所示,用坩埚钳夹取一根铜丝, 放在酒精灯火焰上加热,产生的现象为 。
(3)小亮同学想设计实验来比较铁、铜、银三种金属的活动性强弱。现有铁、铜和银三种金属,请你帮助他选择合适的仪器和药品完成实验。
实验操作 实验现象 实验结论
四、计算题。
25、为检查某石灰石样品中碳酸钙的纯度,取该样品12g放入烧杯中,再向烧杯中加入35g稀盐酸,恰好完全反应(杂质不参加反应),反应后烧杯中剩余固体物质共42.6g,计算:
(1)反应生成CO2的质量为 g;
(2)石灰石样品中碳酸钙的质量.(要求写出计算过程)
2022—2023学年化学人教版九年级下册第8单元 金属和金属材料 同步练习含答案
人教第8单元 金属和金属材料
一、选择题。
1、在下面的物理性质中:①银白色金属;②延展性;③导热性;④导电性;⑤被磁铁吸引。其中铁、铜、铝三种金属都具有的是( )
A.①②③ B.②③④ C.③④⑤ D.①⑤
【答案】B;
2、下列关于金属与氧气反应的说法中正确的是( )
A.细铁丝在空气中不能燃烧,是因为温度没有达到其着火点
B.铜在空气中能与氧气发生化学反应,其化学方程式为Cu+O2CuO
C.“真金不怕火炼”说明即使在高温条件下金也不与氧气反应
D.金属与氧气发生化学反应时,都需要在点燃或加热的条件下才能发生
【答案】C
3、下列各组实验,不能说明铁和铜的金属活动性强弱的是( )
A.铁丝和铜丝分别插入稀硫酸中
B.铁丝和铜丝分别插入硝酸银溶液中
C.铜丝插入硫酸亚铁溶液中
D.铁丝插入硫酸铜溶液中
【答案】B
4、下列关于工业炼铁的说法错误的是( )
A.高炉炼铁得到的是纯铁
B.石灰石的作用是除去二氧化硅,形成炉渣
C.高炉中焦炭的作用是产生一氧化碳和提供热量
D.工业炼铁原料有铁矿石、焦炭、石灰石和空气
【答案】A
5、下列做法中不利于保护金属资源的是( )
A.在金属制品表面刷漆、涂油防止金属腐蚀
B.回收铝质饮料罐
C.扩大开采规模
D.寻找金属的替代品
【答案】C
6、下列物质的用途主要由其物理性质决定的是( )
A.金刚石切割大理石 B.碳素墨水写档案
C.氮气用于食品防腐 D.黄铁矿用于炼铁
【答案】A
7、现有X、Y、Z三种金属,已知:①X+YCl2===XCl2+Y,②把Y、Z两种金属分别放入稀硫酸中,只有 Y 和稀硫酸反应。这三种金属的活动性由强到弱的顺序是( )
A. X>Z>Y B. Z>Y>X C. Y>Z>X D. X>Y>Z
【答案】D
8、铜能被加工成厚度仅为7微米的超薄铜箔,说明铜具有良好的( )
A.延展性 B.导电性 C.导热性 D.抗腐蚀性
【答案】A;
9、下列物质可由金属与酸直接反应制得的是( )
A.AgCl B.CuSO4 C.Fe2(SO4)3 D.AlCl3
【答案】D
10、下表是2019年北京市某转运站生活垃圾组成的质量分数(%),该转运站生活垃圾中数量最多的是( )
厨余 纸类 塑料 玻璃 金属 木竹 砖瓦 纺织类 灰土类
39-53 17-24 18-26 0.9-1.9 0.1-0.3 1.7-6.1 0.8-2 1.1-4.4 1-4.9
A.厨余垃圾 B.纸质垃圾 C.塑料垃圾 D.砖瓦垃圾
【答案】A
11、把锌片放入CuSO4溶液中,锌片表面覆盖一层红色物质,一会儿又有气泡冒出,同学们对此现象进行猜想和分析,其中没有科学依据的是( )
A. 甲认为红色物质是铜
B. 乙认为锌的活动性比铜强
C. 丙推测气体是二氧化碳并检验
D. 丁猜想CuSO4溶液呈酸性并检验
【答案】C
12、黄铜是铜锌合金,将纯铜片和黄铜片相互刻划(如右图所示),是为了比较二者的( )
A.硬度 B.延展性 C.密度 D.颜色
【答案】A;
13、铜、镁的金属活动性时,下列现象、分析或结论正确的是( )
A.盐酸的浓度可以不同 B.铜片表面有气泡
C.镁片的试管表面发烫 D.活动性Zn>Mg>Cu
【答案】C
*14、为了验证Zn、Fe、Cu三种金属的活动顺序为:Zn>Fe>Cu这一结论,下面实验设计合理的是( )
A.将Zn、Cu两金属片分别放入稀硫酸中
B.将Fe、Cu两金属片分别放入稀盐酸中
C.将Zn、Fe两金属片分别放入CuSO4溶液中
D.将Zn、Cu两金属片分别放入FeSO4溶液中
【答案】D
15、“暖宝宝贴”(主要成分为铁粉)的热是来源于铁粉的锈蚀反应。用“暖宝宝贴”测定空气中氧气的含量,实验开始前装置如图所示,实验后从量筒中进入广口瓶(容积为250mL)中水的体积为45mL(铁粉锈蚀消耗的水忽略不计)。下列叙述不正确的是( )
A.铁的锈蚀属于缓慢氧化过程
B.若测得空气中氧气含量偏低,可能是铁粉不足
C.必须等恢复至实验前的温度后,才能记录量筒内剩余水的体积
D.本次实验测得空气中氧气的体积分数约为18%
【答案】D
16、为了验证铁、铜两种金属的活动性差异,如图所示取两支试管分别进行有关实验,若要观察到现象的显著差异,所用液体合理的是( )
A. 蒸馏水 B. 稀盐酸 C. 酒精水溶液 D. 硫酸钠溶液
【答案】B
二、填空题。
17、人类使用金属的历史,由早到晚的顺序正确的是________,目前世界上金属的年产量由多到少的顺序是________。(均填字母序号)
A.铁→铜→铝 B.铜→铝→铁 C.铜→铁→铝 D.铁→铝→铜
【答案】C D
18、根据图示化合物与单质相互转化的关系回答:
若乙的溶液是浅绿色,Y是红色固体,则X是________。
【答案】铁
19、铁锈主要成分 (填化学式),铁锈的颜色为 。
【答案】Fe2O3;红色。
20、向5支试管中分别加入用砂纸打磨后的镁条、铝片、锌片、铁片、铜片,然后分别加入5 mL稀硫酸。其中金属 的表面不会产生气泡;能产生气泡且速率最快的金属是 ;试写出铝与稀硫酸反应的化学方程式: 。
【答案】铜 镁 2Al+3H2SO4Al2(SO4)3+3H2↑
21、导电性最好的金属是____________。
【答案】银
22、用铝丝、洁净的铜丝、稀盐酸、AgNO3溶液,验证Al、Cu Ag的活动性顺序。
(1)把打磨过的铝丝和洁净的铜丝分别浸入稀盐酸中,观察到铝丝表面有气泡产生,铜丝表面无明显现象,由此判断出Al和Cu的活动性强弱顺序为________>(H)>________;发生反应的基本反应类型是________ ;铝丝使用前需用砂纸打磨的原因是________ ;
(2)为了达到实验目的,除(1)中实验外,还需要进行的实验是:
________ 。
【答案】(1)Al;Cu(或铝 铜);置换反应;除去铝表面致密的氧化铝薄膜,防止其影响反应(或除去铝表面的氧化膜或除去铝表面的氧化物等,合理均可)
(2)将铜丝浸入硝酸银溶液中(只要用不超出所给四种试剂,就能得出符合题意结论的即可给分)
23、金属与我们的生活息息相关,在各个领域中用途广泛。
(1)化工生产中,人们习惯上把金、银、铜、铁、锡五种金属统称为“五金,在“五金”顺序中若将 的位置移到最后,正好符合由弱到强的金属活动性顺序。
(2)“沙里淘金”说明金在自然界中能以 (选填“单质”或“化合物“)的形式存在。
(3)日常使用的金属材料大部分为合金,焊锡是一种重要的合金,常用来焊接电子元件等,这是因为与其组成的金属相比,焊锡具有 的特性。
(4)铜锈的主要成分是碱式碳酸铜【Cu2(OH)2CO3】,是铜与空气中的氧气、水和 共同作用的结果。
(5)金属矿物的储量有限,而且不能再生,保护金属资源的有效途径除防止金属的腐蚀外,还有 (写出一条即可)等。
【答案】铁;单质;熔点低;二氧化碳;金属的回收利用。
三、实验题。
24、人类每年要向自然界索取大量的金属矿物资源,金属的用途与它们的物理性质和化学性质有着密切的关系,请回答下列问题。
(1)如图甲所示,将纯铜片和黄铜片互相刻画,纯铜片上留下明显的痕迹,这一实验现象说明了 。
(2)如图乙所示,用坩埚钳夹取一根铜丝, 放在酒精灯火焰上加热,产生的现象为 。
(3)小亮同学想设计实验来比较铁、铜、银三种金属的活动性强弱。现有铁、铜和银三种金属,请你帮助他选择合适的仪器和药品完成实验。
实验操作 实验现象 实验结论
【答案】(1)黄铜的硬度大于纯铜的硬度(合理即可) (2)铜丝表面变黑
(3)
实验操作 实验现象 实验结论
将铁片和铜片用砂纸打磨后,分别放入盛有稀硫酸的试管中;将铜片用砂纸打磨后放入盛有硝酸银溶液的试管中 铁片表面产生气泡,铜片表面没有变化;浸入硝酸银溶液中的铜片表面析出一层黑色固体,溶液由无色变为蓝色 三种金属的活动性由强到弱的顺序是铁>铜>银
(合理即可)
四、计算题。
25、为检查某石灰石样品中碳酸钙的纯度,取该样品12g放入烧杯中,再向烧杯中加入35g稀盐酸,恰好完全反应(杂质不参加反应),反应后烧杯中剩余固体物质共42.6g,计算:
(1)反应生成CO2的质量为 g;
(2)石灰石样品中碳酸钙的质量.(要求写出计算过程)
【答案】(1)反应生成二氧化碳的质量为:12g+35g﹣42.6g=4.4g,
(2)设碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 4.4g
=,
x=10g,
答:石灰石样品中碳酸钙的质量是10g.
人教第8单元 金属和金属材料
一、选择题。
1、在下面的物理性质中:①银白色金属;②延展性;③导热性;④导电性;⑤被磁铁吸引。其中铁、铜、铝三种金属都具有的是( )
A.①②③ B.②③④ C.③④⑤ D.①⑤
2、下列关于金属与氧气反应的说法中正确的是( )
A.细铁丝在空气中不能燃烧,是因为温度没有达到其着火点
B.铜在空气中能与氧气发生化学反应,其化学方程式为Cu+O2CuO
C.“真金不怕火炼”说明即使在高温条件下金也不与氧气反应
D.金属与氧气发生化学反应时,都需要在点燃或加热的条件下才能发生
3、下列各组实验,不能说明铁和铜的金属活动性强弱的是( )
A.铁丝和铜丝分别插入稀硫酸中
B.铁丝和铜丝分别插入硝酸银溶液中
C.铜丝插入硫酸亚铁溶液中
D.铁丝插入硫酸铜溶液中
4、下列关于工业炼铁的说法错误的是( )
A.高炉炼铁得到的是纯铁
B.石灰石的作用是除去二氧化硅,形成炉渣
C.高炉中焦炭的作用是产生一氧化碳和提供热量
D.工业炼铁原料有铁矿石、焦炭、石灰石和空气
5、下列做法中不利于保护金属资源的是( )
A.在金属制品表面刷漆、涂油防止金属腐蚀
B.回收铝质饮料罐
C.扩大开采规模
D.寻找金属的替代品
6、下列物质的用途主要由其物理性质决定的是( )
A.金刚石切割大理石 B.碳素墨水写档案
C.氮气用于食品防腐 D.黄铁矿用于炼铁
7、现有X、Y、Z三种金属,已知:①X+YCl2===XCl2+Y,②把Y、Z两种金属分别放入稀硫酸中,只有 Y 和稀硫酸反应。这三种金属的活动性由强到弱的顺序是( )
A. X>Z>Y B. Z>Y>X C. Y>Z>X D. X>Y>Z
8、铜能被加工成厚度仅为7微米的超薄铜箔,说明铜具有良好的( )
A.延展性 B.导电性 C.导热性 D.抗腐蚀性
9、下列物质可由金属与酸直接反应制得的是( )
A.AgCl B.CuSO4 C.Fe2(SO4)3 D.AlCl3
10、下表是2019年北京市某转运站生活垃圾组成的质量分数(%),该转运站生活垃圾中数量最多的是( )
厨余 纸类 塑料 玻璃 金属 木竹 砖瓦 纺织类 灰土类
39-53 17-24 18-26 0.9-1.9 0.1-0.3 1.7-6.1 0.8-2 1.1-4.4 1-4.9
A.厨余垃圾 B.纸质垃圾 C.塑料垃圾 D.砖瓦垃圾
11、把锌片放入CuSO4溶液中,锌片表面覆盖一层红色物质,一会儿又有气泡冒出,同学们对此现象进行猜想和分析,其中没有科学依据的是( )
A. 甲认为红色物质是铜
B. 乙认为锌的活动性比铜强
C. 丙推测气体是二氧化碳并检验
D. 丁猜想CuSO4溶液呈酸性并检验
12、黄铜是铜锌合金,将纯铜片和黄铜片相互刻划(如右图所示),是为了比较二者的( )
A.硬度 B.延展性 C.密度 D.颜色
13、铜、镁的金属活动性时,下列现象、分析或结论正确的是( )
A.盐酸的浓度可以不同 B.铜片表面有气泡
C.镁片的试管表面发烫 D.活动性Zn>Mg>Cu
*14、为了验证Zn、Fe、Cu三种金属的活动顺序为:Zn>Fe>Cu这一结论,下面实验设计合理的是( )
A.将Zn、Cu两金属片分别放入稀硫酸中
B.将Fe、Cu两金属片分别放入稀盐酸中
C.将Zn、Fe两金属片分别放入CuSO4溶液中
D.将Zn、Cu两金属片分别放入FeSO4溶液中
15、“暖宝宝贴”(主要成分为铁粉)的热是来源于铁粉的锈蚀反应。用“暖宝宝贴”测定空气中氧气的含量,实验开始前装置如图所示,实验后从量筒中进入广口瓶(容积为250mL)中水的体积为45mL(铁粉锈蚀消耗的水忽略不计)。下列叙述不正确的是( )
A.铁的锈蚀属于缓慢氧化过程
B.若测得空气中氧气含量偏低,可能是铁粉不足
C.必须等恢复至实验前的温度后,才能记录量筒内剩余水的体积
D.本次实验测得空气中氧气的体积分数约为18%
16、为了验证铁、铜两种金属的活动性差异,如图所示取两支试管分别进行有关实验,若要观察到现象的显著差异,所用液体合理的是( )
A. 蒸馏水 B. 稀盐酸 C. 酒精水溶液 D. 硫酸钠溶液
二、填空题。
17、人类使用金属的历史,由早到晚的顺序正确的是________,目前世界上金属的年产量由多到少的顺序是________。(均填字母序号)
A.铁→铜→铝 B.铜→铝→铁 C.铜→铁→铝 D.铁→铝→铜
18、根据图示化合物与单质相互转化的关系回答:
若乙的溶液是浅绿色,Y是红色固体,则X是________。
19、铁锈主要成分 (填化学式),铁锈的颜色为 。
20、向5支试管中分别加入用砂纸打磨后的镁条、铝片、锌片、铁片、铜片,然后分别加入5 mL稀硫酸。其中金属 的表面不会产生气泡;能产生气泡且速率最快的金属是 ;试写出铝与稀硫酸反应的化学方程式: 。
21、导电性最好的金属是____________。
22、用铝丝、洁净的铜丝、稀盐酸、AgNO3溶液,验证Al、Cu Ag的活动性顺序。
(1)把打磨过的铝丝和洁净的铜丝分别浸入稀盐酸中,观察到铝丝表面有气泡产生,铜丝表面无明显现象,由此判断出Al和Cu的活动性强弱顺序为________>(H)>________;发生反应的基本反应类型是________ ;铝丝使用前需用砂纸打磨的原因是________ ;
(2)为了达到实验目的,除(1)中实验外,还需要进行的实验是:
________ 。
23、金属与我们的生活息息相关,在各个领域中用途广泛。
(1)化工生产中,人们习惯上把金、银、铜、铁、锡五种金属统称为“五金,在“五金”顺序中若将 的位置移到最后,正好符合由弱到强的金属活动性顺序。
(2)“沙里淘金”说明金在自然界中能以 (选填“单质”或“化合物“)的形式存在。
(3)日常使用的金属材料大部分为合金,焊锡是一种重要的合金,常用来焊接电子元件等,这是因为与其组成的金属相比,焊锡具有 的特性。
(4)铜锈的主要成分是碱式碳酸铜【Cu2(OH)2CO3】,是铜与空气中的氧气、水和 共同作用的结果。
(5)金属矿物的储量有限,而且不能再生,保护金属资源的有效途径除防止金属的腐蚀外,还有 (写出一条即可)等。
三、实验题。
24、人类每年要向自然界索取大量的金属矿物资源,金属的用途与它们的物理性质和化学性质有着密切的关系,请回答下列问题。
(1)如图甲所示,将纯铜片和黄铜片互相刻画,纯铜片上留下明显的痕迹,这一实验现象说明了 。
(2)如图乙所示,用坩埚钳夹取一根铜丝, 放在酒精灯火焰上加热,产生的现象为 。
(3)小亮同学想设计实验来比较铁、铜、银三种金属的活动性强弱。现有铁、铜和银三种金属,请你帮助他选择合适的仪器和药品完成实验。
实验操作 实验现象 实验结论
四、计算题。
25、为检查某石灰石样品中碳酸钙的纯度,取该样品12g放入烧杯中,再向烧杯中加入35g稀盐酸,恰好完全反应(杂质不参加反应),反应后烧杯中剩余固体物质共42.6g,计算:
(1)反应生成CO2的质量为 g;
(2)石灰石样品中碳酸钙的质量.(要求写出计算过程)
2022—2023学年化学人教版九年级下册第8单元 金属和金属材料 同步练习含答案
人教第8单元 金属和金属材料
一、选择题。
1、在下面的物理性质中:①银白色金属;②延展性;③导热性;④导电性;⑤被磁铁吸引。其中铁、铜、铝三种金属都具有的是( )
A.①②③ B.②③④ C.③④⑤ D.①⑤
【答案】B;
2、下列关于金属与氧气反应的说法中正确的是( )
A.细铁丝在空气中不能燃烧,是因为温度没有达到其着火点
B.铜在空气中能与氧气发生化学反应,其化学方程式为Cu+O2CuO
C.“真金不怕火炼”说明即使在高温条件下金也不与氧气反应
D.金属与氧气发生化学反应时,都需要在点燃或加热的条件下才能发生
【答案】C
3、下列各组实验,不能说明铁和铜的金属活动性强弱的是( )
A.铁丝和铜丝分别插入稀硫酸中
B.铁丝和铜丝分别插入硝酸银溶液中
C.铜丝插入硫酸亚铁溶液中
D.铁丝插入硫酸铜溶液中
【答案】B
4、下列关于工业炼铁的说法错误的是( )
A.高炉炼铁得到的是纯铁
B.石灰石的作用是除去二氧化硅,形成炉渣
C.高炉中焦炭的作用是产生一氧化碳和提供热量
D.工业炼铁原料有铁矿石、焦炭、石灰石和空气
【答案】A
5、下列做法中不利于保护金属资源的是( )
A.在金属制品表面刷漆、涂油防止金属腐蚀
B.回收铝质饮料罐
C.扩大开采规模
D.寻找金属的替代品
【答案】C
6、下列物质的用途主要由其物理性质决定的是( )
A.金刚石切割大理石 B.碳素墨水写档案
C.氮气用于食品防腐 D.黄铁矿用于炼铁
【答案】A
7、现有X、Y、Z三种金属,已知:①X+YCl2===XCl2+Y,②把Y、Z两种金属分别放入稀硫酸中,只有 Y 和稀硫酸反应。这三种金属的活动性由强到弱的顺序是( )
A. X>Z>Y B. Z>Y>X C. Y>Z>X D. X>Y>Z
【答案】D
8、铜能被加工成厚度仅为7微米的超薄铜箔,说明铜具有良好的( )
A.延展性 B.导电性 C.导热性 D.抗腐蚀性
【答案】A;
9、下列物质可由金属与酸直接反应制得的是( )
A.AgCl B.CuSO4 C.Fe2(SO4)3 D.AlCl3
【答案】D
10、下表是2019年北京市某转运站生活垃圾组成的质量分数(%),该转运站生活垃圾中数量最多的是( )
厨余 纸类 塑料 玻璃 金属 木竹 砖瓦 纺织类 灰土类
39-53 17-24 18-26 0.9-1.9 0.1-0.3 1.7-6.1 0.8-2 1.1-4.4 1-4.9
A.厨余垃圾 B.纸质垃圾 C.塑料垃圾 D.砖瓦垃圾
【答案】A
11、把锌片放入CuSO4溶液中,锌片表面覆盖一层红色物质,一会儿又有气泡冒出,同学们对此现象进行猜想和分析,其中没有科学依据的是( )
A. 甲认为红色物质是铜
B. 乙认为锌的活动性比铜强
C. 丙推测气体是二氧化碳并检验
D. 丁猜想CuSO4溶液呈酸性并检验
【答案】C
12、黄铜是铜锌合金,将纯铜片和黄铜片相互刻划(如右图所示),是为了比较二者的( )
A.硬度 B.延展性 C.密度 D.颜色
【答案】A;
13、铜、镁的金属活动性时,下列现象、分析或结论正确的是( )
A.盐酸的浓度可以不同 B.铜片表面有气泡
C.镁片的试管表面发烫 D.活动性Zn>Mg>Cu
【答案】C
*14、为了验证Zn、Fe、Cu三种金属的活动顺序为:Zn>Fe>Cu这一结论,下面实验设计合理的是( )
A.将Zn、Cu两金属片分别放入稀硫酸中
B.将Fe、Cu两金属片分别放入稀盐酸中
C.将Zn、Fe两金属片分别放入CuSO4溶液中
D.将Zn、Cu两金属片分别放入FeSO4溶液中
【答案】D
15、“暖宝宝贴”(主要成分为铁粉)的热是来源于铁粉的锈蚀反应。用“暖宝宝贴”测定空气中氧气的含量,实验开始前装置如图所示,实验后从量筒中进入广口瓶(容积为250mL)中水的体积为45mL(铁粉锈蚀消耗的水忽略不计)。下列叙述不正确的是( )
A.铁的锈蚀属于缓慢氧化过程
B.若测得空气中氧气含量偏低,可能是铁粉不足
C.必须等恢复至实验前的温度后,才能记录量筒内剩余水的体积
D.本次实验测得空气中氧气的体积分数约为18%
【答案】D
16、为了验证铁、铜两种金属的活动性差异,如图所示取两支试管分别进行有关实验,若要观察到现象的显著差异,所用液体合理的是( )
A. 蒸馏水 B. 稀盐酸 C. 酒精水溶液 D. 硫酸钠溶液
【答案】B
二、填空题。
17、人类使用金属的历史,由早到晚的顺序正确的是________,目前世界上金属的年产量由多到少的顺序是________。(均填字母序号)
A.铁→铜→铝 B.铜→铝→铁 C.铜→铁→铝 D.铁→铝→铜
【答案】C D
18、根据图示化合物与单质相互转化的关系回答:
若乙的溶液是浅绿色,Y是红色固体,则X是________。
【答案】铁
19、铁锈主要成分 (填化学式),铁锈的颜色为 。
【答案】Fe2O3;红色。
20、向5支试管中分别加入用砂纸打磨后的镁条、铝片、锌片、铁片、铜片,然后分别加入5 mL稀硫酸。其中金属 的表面不会产生气泡;能产生气泡且速率最快的金属是 ;试写出铝与稀硫酸反应的化学方程式: 。
【答案】铜 镁 2Al+3H2SO4Al2(SO4)3+3H2↑
21、导电性最好的金属是____________。
【答案】银
22、用铝丝、洁净的铜丝、稀盐酸、AgNO3溶液,验证Al、Cu Ag的活动性顺序。
(1)把打磨过的铝丝和洁净的铜丝分别浸入稀盐酸中,观察到铝丝表面有气泡产生,铜丝表面无明显现象,由此判断出Al和Cu的活动性强弱顺序为________>(H)>________;发生反应的基本反应类型是________ ;铝丝使用前需用砂纸打磨的原因是________ ;
(2)为了达到实验目的,除(1)中实验外,还需要进行的实验是:
________ 。
【答案】(1)Al;Cu(或铝 铜);置换反应;除去铝表面致密的氧化铝薄膜,防止其影响反应(或除去铝表面的氧化膜或除去铝表面的氧化物等,合理均可)
(2)将铜丝浸入硝酸银溶液中(只要用不超出所给四种试剂,就能得出符合题意结论的即可给分)
23、金属与我们的生活息息相关,在各个领域中用途广泛。
(1)化工生产中,人们习惯上把金、银、铜、铁、锡五种金属统称为“五金,在“五金”顺序中若将 的位置移到最后,正好符合由弱到强的金属活动性顺序。
(2)“沙里淘金”说明金在自然界中能以 (选填“单质”或“化合物“)的形式存在。
(3)日常使用的金属材料大部分为合金,焊锡是一种重要的合金,常用来焊接电子元件等,这是因为与其组成的金属相比,焊锡具有 的特性。
(4)铜锈的主要成分是碱式碳酸铜【Cu2(OH)2CO3】,是铜与空气中的氧气、水和 共同作用的结果。
(5)金属矿物的储量有限,而且不能再生,保护金属资源的有效途径除防止金属的腐蚀外,还有 (写出一条即可)等。
【答案】铁;单质;熔点低;二氧化碳;金属的回收利用。
三、实验题。
24、人类每年要向自然界索取大量的金属矿物资源,金属的用途与它们的物理性质和化学性质有着密切的关系,请回答下列问题。
(1)如图甲所示,将纯铜片和黄铜片互相刻画,纯铜片上留下明显的痕迹,这一实验现象说明了 。
(2)如图乙所示,用坩埚钳夹取一根铜丝, 放在酒精灯火焰上加热,产生的现象为 。
(3)小亮同学想设计实验来比较铁、铜、银三种金属的活动性强弱。现有铁、铜和银三种金属,请你帮助他选择合适的仪器和药品完成实验。
实验操作 实验现象 实验结论
【答案】(1)黄铜的硬度大于纯铜的硬度(合理即可) (2)铜丝表面变黑
(3)
实验操作 实验现象 实验结论
将铁片和铜片用砂纸打磨后,分别放入盛有稀硫酸的试管中;将铜片用砂纸打磨后放入盛有硝酸银溶液的试管中 铁片表面产生气泡,铜片表面没有变化;浸入硝酸银溶液中的铜片表面析出一层黑色固体,溶液由无色变为蓝色 三种金属的活动性由强到弱的顺序是铁>铜>银
(合理即可)
四、计算题。
25、为检查某石灰石样品中碳酸钙的纯度,取该样品12g放入烧杯中,再向烧杯中加入35g稀盐酸,恰好完全反应(杂质不参加反应),反应后烧杯中剩余固体物质共42.6g,计算:
(1)反应生成CO2的质量为 g;
(2)石灰石样品中碳酸钙的质量.(要求写出计算过程)
【答案】(1)反应生成二氧化碳的质量为:12g+35g﹣42.6g=4.4g,
(2)设碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 4.4g
=,
x=10g,
答:石灰石样品中碳酸钙的质量是10g.
同课章节目录
