2022—2023学年化学人教版九年级下册第九单元 溶液 同步练习(有答案)
文档属性
| 名称 | 2022—2023学年化学人教版九年级下册第九单元 溶液 同步练习(有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 249.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-12 15:50:24 | ||
图片预览



文档简介
2022—2023学年化学人教版九年级下册第九单元 溶液 同步练习含答案
人教第九单元 溶液
一、选择题。
1、下列厨房里的物质与水混合充分搅拌后,不能形成溶液的是( )
A.味精 B.蔗糖 C.食盐 D.菜籽油
2、下列关于溶液组成的说法,正确的是( )
A.溶剂是能溶解其他物质的物质
B.水是常用的溶剂,能溶解所有的物质
C.被溶解的物质都是以离子的形式存在于溶剂中
D.溶质只能是固体物质
3、将适量的下列物质溶解于水的过程中,会使溶液的温度显著降低的是( )
A.氢氧化钙 B.硝酸铵 C.氢氧化钠 D.食盐
4、有关溶液的下列说法,正确的是( )
A 溶液一定是无色的 B 溶剂一定是水
C 溶液一定是液体 D 溶液一定是混合物
5、0 ℃时,四个实验小组分别取不同质量的NaCl,逐渐加入盛有50 g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表。下列说法错误的是 ( )
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
A.20 ℃时,50 g NaCl饱和溶液中含有18 g NaCl
B.用蒸发的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9∶25
D.第一组所得溶液是不饱和溶液
6、闻名中外的青岛啤酒内溶有一定量的二氧化碳,打开瓶盖,你会发现啤酒会自动喷出,喝了啤酒后又会打嗝儿,这说明气体在水中的溶解度与压强和温度有关。下列说法正确的是( )
A.压强越小,气体的溶解度越大
B.压强越小,气体的溶解度越小
C.温度升高,气体的溶解度增大
D.温度降低,气体的溶解度减小
7、实验操作后的溶液一定是不饱和溶液的是( )
A. B.
C. D.
8、欲配制100g质量分数为10%的氢氧化钠溶液。下列说法中不正确的是( )
A.用托盘天平称取10.0g氢氧化钠
B.氢氧化钠易潮解,应放在玻璃器皿中称量
C.实验中用玻璃棒搅拌,其目的是加快氢氧化钠的溶解速率
D.将配好的溶液装入试剂瓶时,少量溶液洒出,溶质质量分数变小
9、用6%的氯化钠溶液配制质量分数为3%的氯化钠溶液,其操作顺序正确的是( )
A.计算、量取、混匀、装瓶 B.量取、计算、混匀、装瓶
C.称取、计算、混匀、装瓶 D.计算、称量、量取、溶解
10、下列物质属于溶液,且溶质是单质的是( )
A 盐酸 B 少量的粉笔灰加入水中
C 少量碘溶于酒精中 D 少量的锌粉溶于稀盐酸中
11、一定温度下,向饱和澄清石灰水中加入少量氧化钙,充分反应后恢复到原来的温度,反应后的溶液与原饱和澄清石灰水相比,下列说法正确的是( )
A. 溶质的质量不变 B. 溶质的质量减少
C. 溶质的质量分数变大 D. 溶质的质量分数减小
12、用固体氢氧化钠配制50克20%的氢氧化钠溶液时,有①溶解、②称量、③计算、④量取等步骤。下列顺序中正确的是( )
A.③②④① B.③②①④ C.①②③④ D.②③④①
13、将50g 20%的氯化钾溶液稀释到5%,需要加水的质量为( )
A.50g B.100g C.150g D.200g
14、下列叙述正确的是( )
A 均一、稳定、无色透明的液体一定是溶液
B 泥水中,泥是溶质,水是溶剂
C 溶液一定是由溶质和溶剂组成的
D 冰和水混合在一起,冰是溶质,水是溶剂
15、下图是a、b、c三种物质的溶解度曲线图,现有一定温度下的a、b、c的不饱和溶液,分别通过增加溶质、蒸发溶剂或升高温度三种方法,均可变成饱和溶液的是( )
A. a溶液 B. b溶液 C. c溶液 D. a溶液和c溶液
二、填空题。
16、甲、乙、丙三种固体物质的溶解度曲线如图所示。请回答:
(1)0℃时,三种物质中溶解度最大的是_____ 。
(2)t2℃时,在盛有50g水的烧杯中加入35g甲物质,充分搅拌后所得溶液的质量是____ 。
(3)将甲溶液由A点转变为B点,可采用的方法是_______________(填一种即可)。
(4)如图,将放有固体X的试管放入烧杯中,然后向试管内加入液体Y,一段时间后丙溶液中有固体析出,则对应的X和Y物质是_____。
A.氯化钠和水 B.镁条和稀盐酸
C.硝酸铵和水 D.氢氧化钠和水
17、已知20 ℃时,10 g水中最多能溶解3.6 g食盐,那么100 g水中最多能溶解食盐______g。20 ℃时将5.4 g食盐投入20 g水中,充分溶解后所得到的溶液是_______________。欲使其成为该温度下的饱和溶液还需加入_______g食盐,或蒸发掉______g水。
18、水是一种重要的资源。
(1)电解水实验揭示了水的组成.图1实验中得到氧气的试管是________ (填“1”或“2”)。
(2)自来水厂净水过程中用到活性炭,其作用是________。
(3)海水淡化可缓解淡水资源匮乏的问题.图2为太阳能海水淡化装置示意图.
①水变成水蒸气的过程中,不发生变化的是________ (填字母序号)。
A.分子质量 B.分子种类 C.分子间隔
②利用该装置将一定量的海水暴晒一段时间后,剩余海水中氯化钠的质量分数会________ 。(填“变大”、“变小”或“不变”)
19、某实验小组同学准备用粗盐配制一定质量分数的氯化钠溶液,他们设计了如下实验流程:粗盐溶解→沉淀、过滤→蒸发结晶→配制溶液。请回答下列问题:
(1)过滤操作中除用到铁架台、烧杯。滤纸外,还要用到的仪器有__________;
(2)配制溶液过程中,需用__________称量氯化钠,用__________量取蒸馏水。
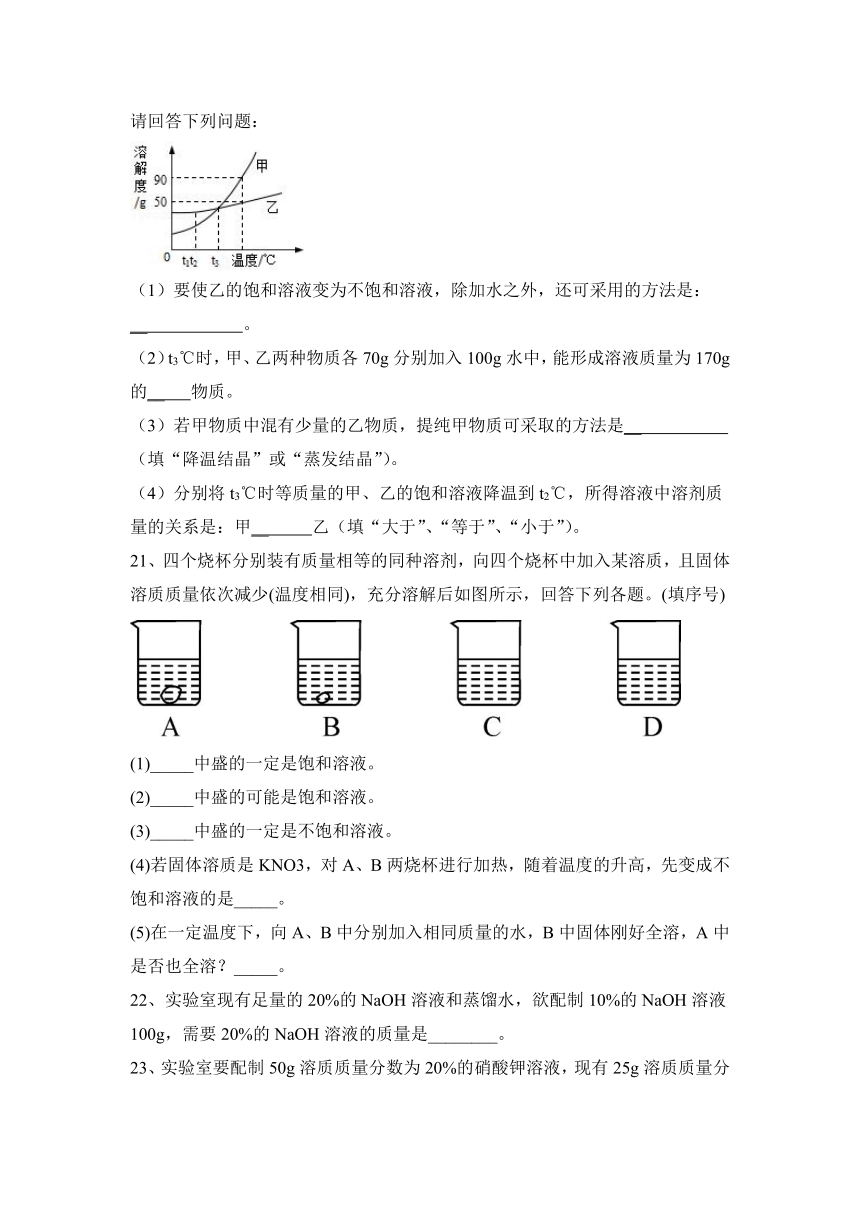
20、作图法是常用的数据处理方法,甲、乙两种物质的溶解度曲线如下图所示。请回答下列问题:
(1)要使乙的饱和溶液变为不饱和溶液,除加水之外,还可采用的方法是:
__ 。
(2)t3℃时,甲、乙两种物质各70g分别加入100g水中,能形成溶液质量为170g的__ 物质。
(3)若甲物质中混有少量的乙物质,提纯甲物质可采取的方法是__ (填“降温结晶”或“蒸发结晶”)。
(4)分别将t3℃时等质量的甲、乙的饱和溶液降温到t2℃,所得溶液中溶剂质量的关系是:甲__ 乙(填“大于”、“等于”、“小于”)。
21、四个烧杯分别装有质量相等的同种溶剂,向四个烧杯中加入某溶质,且固体溶质质量依次减少(温度相同),充分溶解后如图所示,回答下列各题。(填序号)
(1)_____中盛的一定是饱和溶液。
(2)_____中盛的可能是饱和溶液。
(3)_____中盛的一定是不饱和溶液。
(4)若固体溶质是KNO3,对A、B两烧杯进行加热,随着温度的升高,先变成不饱和溶液的是_____。
(5)在一定温度下,向A、B中分别加入相同质量的水,B中固体刚好全溶,A中是否也全溶?_____。
22、实验室现有足量的20%的NaOH溶液和蒸馏水,欲配制10%的NaOH溶液100g,需要20%的NaOH溶液的质量是________。
23、实验室要配制50g溶质质量分数为20%的硝酸钾溶液,现有25g溶质质量分数为40%的硝酸钾溶液、20g溶质质量分数为15%的硝酸钾溶液及足够多的硝酸钾晶体和蒸馏水,请选用上述的药品,设计三种配制方案填入下表。
方案一:______________________________
方案二:______________________________
方案三:______________________________
三、实验探究题。
24、以下各图所示是某校兴趣小组测定硝酸钾溶解度的部分操作实况。
图A是给试管中水和硝酸钾固体加热;
图B是在加热过程中进行搅拌;
图C是待硝酸钾全部溶解后,将试管从烧杯中取出,停止加热;
图D是在溶液中插入温度计;
图E是用玻璃棒轻轻摩擦试管内壁,当溶液中刚出现硝酸钾晶体时,记下温度计上所示温度。
请根据上述实验内容,回答下列问题:
(1)当试管中硝酸钾的总量达到15.5g时,小组同学分别测出的温度为74.9℃、75.0℃、75.3℃,他们将在实验报告中记录的温度是 。他们进行反复实验的目的是 。
(2)如表所示为兴趣小组在实验报告中,设计的记录实验数据的表格。请根据表格中已有数据,分析实验时,试管中盛有水的体积为 ,并将表中空格内的相应溶解度填写完整。
试管中硝酸钾的总量/g 5 6.5 8 10 12.5
开始析出晶体时的温度t/℃ 32.8 39.6 45.8 54.7 64.9
溶解度/g 50
四、计算类综合题。
25、为检査某石灰石样品中碳酸钙的纯度,取该样品12g放入烧杯中,再向烧杯中加人35g稀盐酸,恰好完全反应(杂质不参加反应),反应后烧杯中物质共42.6g.
(1)反应生成CO2的质量为 ________ g;
(2)石灰石样品中碳酸钙的质量分数是多少?(结果保留到0.1%)
(3)反应后所得溶液的溶质质量分数是多少?(结果保留到0.1%)
2022—2023学年化学人教版九年级下册第九单元 溶液 同步练习含答案
人教第九单元 溶液
一、选择题。
1、下列厨房里的物质与水混合充分搅拌后,不能形成溶液的是( )
A.味精 B.蔗糖 C.食盐 D.菜籽油
【答案】D
2、下列关于溶液组成的说法,正确的是( )
A.溶剂是能溶解其他物质的物质
B.水是常用的溶剂,能溶解所有的物质
C.被溶解的物质都是以离子的形式存在于溶剂中
D.溶质只能是固体物质
【答案】A
3、将适量的下列物质溶解于水的过程中,会使溶液的温度显著降低的是( )
A.氢氧化钙 B.硝酸铵 C.氢氧化钠 D.食盐
【答案】B
4、有关溶液的下列说法,正确的是( )
A 溶液一定是无色的 B 溶剂一定是水
C 溶液一定是液体 D 溶液一定是混合物
【答案】D
5、0 ℃时,四个实验小组分别取不同质量的NaCl,逐渐加入盛有50 g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表。下列说法错误的是 ( )
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
A.20 ℃时,50 g NaCl饱和溶液中含有18 g NaCl
B.用蒸发的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9∶25
D.第一组所得溶液是不饱和溶液
【答案】A
6、闻名中外的青岛啤酒内溶有一定量的二氧化碳,打开瓶盖,你会发现啤酒会自动喷出,喝了啤酒后又会打嗝儿,这说明气体在水中的溶解度与压强和温度有关。下列说法正确的是( )
A.压强越小,气体的溶解度越大
B.压强越小,气体的溶解度越小
C.温度升高,气体的溶解度增大
D.温度降低,气体的溶解度减小
【答案】B
7、实验操作后的溶液一定是不饱和溶液的是( )
A. B.
C. D.
【答案】C
8、欲配制100g质量分数为10%的氢氧化钠溶液。下列说法中不正确的是( )
A.用托盘天平称取10.0g氢氧化钠
B.氢氧化钠易潮解,应放在玻璃器皿中称量
C.实验中用玻璃棒搅拌,其目的是加快氢氧化钠的溶解速率
D.将配好的溶液装入试剂瓶时,少量溶液洒出,溶质质量分数变小
【答案】D
9、用6%的氯化钠溶液配制质量分数为3%的氯化钠溶液,其操作顺序正确的是( )
A.计算、量取、混匀、装瓶 B.量取、计算、混匀、装瓶
C.称取、计算、混匀、装瓶 D.计算、称量、量取、溶解
【答案】A
10、下列物质属于溶液,且溶质是单质的是( )
A 盐酸 B 少量的粉笔灰加入水中
C 少量碘溶于酒精中 D 少量的锌粉溶于稀盐酸中
【答案】C
11、一定温度下,向饱和澄清石灰水中加入少量氧化钙,充分反应后恢复到原来的温度,反应后的溶液与原饱和澄清石灰水相比,下列说法正确的是( )
A. 溶质的质量不变 B. 溶质的质量减少
C. 溶质的质量分数变大 D. 溶质的质量分数减小
【答案】B
12、用固体氢氧化钠配制50克20%的氢氧化钠溶液时,有①溶解、②称量、③计算、④量取等步骤。下列顺序中正确的是( )
A.③②④① B.③②①④ C.①②③④ D.②③④①
【答案】A
13、将50g 20%的氯化钾溶液稀释到5%,需要加水的质量为( )
A.50g B.100g C.150g D.200g
【答案】C
14、下列叙述正确的是( )
A 均一、稳定、无色透明的液体一定是溶液
B 泥水中,泥是溶质,水是溶剂
C 溶液一定是由溶质和溶剂组成的
D 冰和水混合在一起,冰是溶质,水是溶剂
【答案】C
15、下图是a、b、c三种物质的溶解度曲线图,现有一定温度下的a、b、c的不饱和溶液,分别通过增加溶质、蒸发溶剂或升高温度三种方法,均可变成饱和溶液的是( )
A. a溶液 B. b溶液 C. c溶液 D. a溶液和c溶液
【答案】A
二、填空题。
16、甲、乙、丙三种固体物质的溶解度曲线如图所示。请回答:
(1)0℃时,三种物质中溶解度最大的是_____ 。
(2)t2℃时,在盛有50g水的烧杯中加入35g甲物质,充分搅拌后所得溶液的质量是____ 。
(3)将甲溶液由A点转变为B点,可采用的方法是_______________(填一种即可)。
(4)如图,将放有固体X的试管放入烧杯中,然后向试管内加入液体Y,一段时间后丙溶液中有固体析出,则对应的X和Y物质是_____。
A.氯化钠和水 B.镁条和稀盐酸
C.硝酸铵和水 D.氢氧化钠和水
【答案】丙 80g 增加溶质或恒温蒸发溶剂 (填一种即可) BD
17、已知20 ℃时,10 g水中最多能溶解3.6 g食盐,那么100 g水中最多能溶解食盐______g。20 ℃时将5.4 g食盐投入20 g水中,充分溶解后所得到的溶液是_______________。欲使其成为该温度下的饱和溶液还需加入_______g食盐,或蒸发掉______g水。
【答案】36 不饱和溶液 1.8 5
18、水是一种重要的资源。
(1)电解水实验揭示了水的组成.图1实验中得到氧气的试管是________ (填“1”或“2”)。
(2)自来水厂净水过程中用到活性炭,其作用是________。
(3)海水淡化可缓解淡水资源匮乏的问题.图2为太阳能海水淡化装置示意图.
①水变成水蒸气的过程中,不发生变化的是________ (填字母序号)。
A.分子质量 B.分子种类 C.分子间隔
②利用该装置将一定量的海水暴晒一段时间后,剩余海水中氯化钠的质量分数会________ 。(填“变大”、“变小”或“不变”)
【答案】2;吸附性;A,B;变大
19、某实验小组同学准备用粗盐配制一定质量分数的氯化钠溶液,他们设计了如下实验流程:粗盐溶解→沉淀、过滤→蒸发结晶→配制溶液。请回答下列问题:
(1)过滤操作中除用到铁架台、烧杯。滤纸外,还要用到的仪器有__________;
(2)配制溶液过程中,需用__________称量氯化钠,用__________量取蒸馏水。
【答案】漏斗、玻璃棒 托盘天平 量筒
20、作图法是常用的数据处理方法,甲、乙两种物质的溶解度曲线如下图所示。请回答下列问题:
(1)要使乙的饱和溶液变为不饱和溶液,除加水之外,还可采用的方法是:
__ 。
(2)t3℃时,甲、乙两种物质各70g分别加入100g水中,能形成溶液质量为170g的__ 物质。
(3)若甲物质中混有少量的乙物质,提纯甲物质可采取的方法是__ (填“降温结晶”或“蒸发结晶”)。
(4)分别将t3℃时等质量的甲、乙的饱和溶液降温到t2℃,所得溶液中溶剂质量的关系是:甲__ 乙(填“大于”、“等于”、“小于”)。
【答案】 (1)升高温度 (2)甲 (3)降温结晶 (4)小于
21、四个烧杯分别装有质量相等的同种溶剂,向四个烧杯中加入某溶质,且固体溶质质量依次减少(温度相同),充分溶解后如图所示,回答下列各题。(填序号)
(1)_____中盛的一定是饱和溶液。
(2)_____中盛的可能是饱和溶液。
(3)_____中盛的一定是不饱和溶液。
(4)若固体溶质是KNO3,对A、B两烧杯进行加热,随着温度的升高,先变成不饱和溶液的是_____。
(5)在一定温度下,向A、B中分别加入相同质量的水,B中固体刚好全溶,A中是否也全溶?_____。
【答案】AB C D B 否
22、实验室现有足量的20%的NaOH溶液和蒸馏水,欲配制10%的NaOH溶液100g,需要20%的NaOH溶液的质量是________。
【答案】50g
23、实验室要配制50g溶质质量分数为20%的硝酸钾溶液,现有25g溶质质量分数为40%的硝酸钾溶液、20g溶质质量分数为15%的硝酸钾溶液及足够多的硝酸钾晶体和蒸馏水,请选用上述的药品,设计三种配制方案填入下表。
方案一:______________________________
方案二:______________________________
方案三:______________________________
【答案】10g硝酸钾和40g水;
25g溶质质量分数40%的硝酸钾溶液和25g水;
20g溶质质量分数为15%的硝酸钾溶液、7g硝酸钾和23g水。
三、实验探究题。
24、以下各图所示是某校兴趣小组测定硝酸钾溶解度的部分操作实况。
图A是给试管中水和硝酸钾固体加热;
图B是在加热过程中进行搅拌;
图C是待硝酸钾全部溶解后,将试管从烧杯中取出,停止加热;
图D是在溶液中插入温度计;
图E是用玻璃棒轻轻摩擦试管内壁,当溶液中刚出现硝酸钾晶体时,记下温度计上所示温度。
请根据上述实验内容,回答下列问题:
(1)当试管中硝酸钾的总量达到15.5g时,小组同学分别测出的温度为74.9℃、75.0℃、75.3℃,他们将在实验报告中记录的温度是 。他们进行反复实验的目的是 。
(2)如表所示为兴趣小组在实验报告中,设计的记录实验数据的表格。请根据表格中已有数据,分析实验时,试管中盛有水的体积为 ,并将表中空格内的相应溶解度填写完整。
试管中硝酸钾的总量/g 5 6.5 8 10 12.5
开始析出晶体时的温度t/℃ 32.8 39.6 45.8 54.7 64.9
溶解度/g 50
【答案】(1)75.1℃;减少实验的误差; (2)10ml;65;80;100;125。
四、计算类综合题。
25、为检査某石灰石样品中碳酸钙的纯度,取该样品12g放入烧杯中,再向烧杯中加人35g稀盐酸,恰好完全反应(杂质不参加反应),反应后烧杯中物质共42.6g.
(1)反应生成CO2的质量为 ________ g;
(2)石灰石样品中碳酸钙的质量分数是多少?(结果保留到0.1%)
(3)反应后所得溶液的溶质质量分数是多少?(结果保留到0.1%)
【答案】(1)4.4 (2)碳酸钙的质量分数约为83.3%
(3)反应后所得溶液中溶质的质量分数约为27.3%
【解析】(2)设碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 4.4g
x=10g
碳酸钙的质量分数为:×100%≈83.3%
(3)设碳酸钙的质量为x,生成氯化钙的质量为y,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
111 44
y 4.4g
y=11.1g,
反应后所得溶液中溶质的质量分数为:×100%≈27.3%.
人教第九单元 溶液
一、选择题。
1、下列厨房里的物质与水混合充分搅拌后,不能形成溶液的是( )
A.味精 B.蔗糖 C.食盐 D.菜籽油
2、下列关于溶液组成的说法,正确的是( )
A.溶剂是能溶解其他物质的物质
B.水是常用的溶剂,能溶解所有的物质
C.被溶解的物质都是以离子的形式存在于溶剂中
D.溶质只能是固体物质
3、将适量的下列物质溶解于水的过程中,会使溶液的温度显著降低的是( )
A.氢氧化钙 B.硝酸铵 C.氢氧化钠 D.食盐
4、有关溶液的下列说法,正确的是( )
A 溶液一定是无色的 B 溶剂一定是水
C 溶液一定是液体 D 溶液一定是混合物
5、0 ℃时,四个实验小组分别取不同质量的NaCl,逐渐加入盛有50 g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表。下列说法错误的是 ( )
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
A.20 ℃时,50 g NaCl饱和溶液中含有18 g NaCl
B.用蒸发的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9∶25
D.第一组所得溶液是不饱和溶液
6、闻名中外的青岛啤酒内溶有一定量的二氧化碳,打开瓶盖,你会发现啤酒会自动喷出,喝了啤酒后又会打嗝儿,这说明气体在水中的溶解度与压强和温度有关。下列说法正确的是( )
A.压强越小,气体的溶解度越大
B.压强越小,气体的溶解度越小
C.温度升高,气体的溶解度增大
D.温度降低,气体的溶解度减小
7、实验操作后的溶液一定是不饱和溶液的是( )
A. B.
C. D.
8、欲配制100g质量分数为10%的氢氧化钠溶液。下列说法中不正确的是( )
A.用托盘天平称取10.0g氢氧化钠
B.氢氧化钠易潮解,应放在玻璃器皿中称量
C.实验中用玻璃棒搅拌,其目的是加快氢氧化钠的溶解速率
D.将配好的溶液装入试剂瓶时,少量溶液洒出,溶质质量分数变小
9、用6%的氯化钠溶液配制质量分数为3%的氯化钠溶液,其操作顺序正确的是( )
A.计算、量取、混匀、装瓶 B.量取、计算、混匀、装瓶
C.称取、计算、混匀、装瓶 D.计算、称量、量取、溶解
10、下列物质属于溶液,且溶质是单质的是( )
A 盐酸 B 少量的粉笔灰加入水中
C 少量碘溶于酒精中 D 少量的锌粉溶于稀盐酸中
11、一定温度下,向饱和澄清石灰水中加入少量氧化钙,充分反应后恢复到原来的温度,反应后的溶液与原饱和澄清石灰水相比,下列说法正确的是( )
A. 溶质的质量不变 B. 溶质的质量减少
C. 溶质的质量分数变大 D. 溶质的质量分数减小
12、用固体氢氧化钠配制50克20%的氢氧化钠溶液时,有①溶解、②称量、③计算、④量取等步骤。下列顺序中正确的是( )
A.③②④① B.③②①④ C.①②③④ D.②③④①
13、将50g 20%的氯化钾溶液稀释到5%,需要加水的质量为( )
A.50g B.100g C.150g D.200g
14、下列叙述正确的是( )
A 均一、稳定、无色透明的液体一定是溶液
B 泥水中,泥是溶质,水是溶剂
C 溶液一定是由溶质和溶剂组成的
D 冰和水混合在一起,冰是溶质,水是溶剂
15、下图是a、b、c三种物质的溶解度曲线图,现有一定温度下的a、b、c的不饱和溶液,分别通过增加溶质、蒸发溶剂或升高温度三种方法,均可变成饱和溶液的是( )
A. a溶液 B. b溶液 C. c溶液 D. a溶液和c溶液
二、填空题。
16、甲、乙、丙三种固体物质的溶解度曲线如图所示。请回答:
(1)0℃时,三种物质中溶解度最大的是_____ 。
(2)t2℃时,在盛有50g水的烧杯中加入35g甲物质,充分搅拌后所得溶液的质量是____ 。
(3)将甲溶液由A点转变为B点,可采用的方法是_______________(填一种即可)。
(4)如图,将放有固体X的试管放入烧杯中,然后向试管内加入液体Y,一段时间后丙溶液中有固体析出,则对应的X和Y物质是_____。
A.氯化钠和水 B.镁条和稀盐酸
C.硝酸铵和水 D.氢氧化钠和水
17、已知20 ℃时,10 g水中最多能溶解3.6 g食盐,那么100 g水中最多能溶解食盐______g。20 ℃时将5.4 g食盐投入20 g水中,充分溶解后所得到的溶液是_______________。欲使其成为该温度下的饱和溶液还需加入_______g食盐,或蒸发掉______g水。
18、水是一种重要的资源。
(1)电解水实验揭示了水的组成.图1实验中得到氧气的试管是________ (填“1”或“2”)。
(2)自来水厂净水过程中用到活性炭,其作用是________。
(3)海水淡化可缓解淡水资源匮乏的问题.图2为太阳能海水淡化装置示意图.
①水变成水蒸气的过程中,不发生变化的是________ (填字母序号)。
A.分子质量 B.分子种类 C.分子间隔
②利用该装置将一定量的海水暴晒一段时间后,剩余海水中氯化钠的质量分数会________ 。(填“变大”、“变小”或“不变”)
19、某实验小组同学准备用粗盐配制一定质量分数的氯化钠溶液,他们设计了如下实验流程:粗盐溶解→沉淀、过滤→蒸发结晶→配制溶液。请回答下列问题:
(1)过滤操作中除用到铁架台、烧杯。滤纸外,还要用到的仪器有__________;
(2)配制溶液过程中,需用__________称量氯化钠,用__________量取蒸馏水。
20、作图法是常用的数据处理方法,甲、乙两种物质的溶解度曲线如下图所示。请回答下列问题:
(1)要使乙的饱和溶液变为不饱和溶液,除加水之外,还可采用的方法是:
__ 。
(2)t3℃时,甲、乙两种物质各70g分别加入100g水中,能形成溶液质量为170g的__ 物质。
(3)若甲物质中混有少量的乙物质,提纯甲物质可采取的方法是__ (填“降温结晶”或“蒸发结晶”)。
(4)分别将t3℃时等质量的甲、乙的饱和溶液降温到t2℃,所得溶液中溶剂质量的关系是:甲__ 乙(填“大于”、“等于”、“小于”)。
21、四个烧杯分别装有质量相等的同种溶剂,向四个烧杯中加入某溶质,且固体溶质质量依次减少(温度相同),充分溶解后如图所示,回答下列各题。(填序号)
(1)_____中盛的一定是饱和溶液。
(2)_____中盛的可能是饱和溶液。
(3)_____中盛的一定是不饱和溶液。
(4)若固体溶质是KNO3,对A、B两烧杯进行加热,随着温度的升高,先变成不饱和溶液的是_____。
(5)在一定温度下,向A、B中分别加入相同质量的水,B中固体刚好全溶,A中是否也全溶?_____。
22、实验室现有足量的20%的NaOH溶液和蒸馏水,欲配制10%的NaOH溶液100g,需要20%的NaOH溶液的质量是________。
23、实验室要配制50g溶质质量分数为20%的硝酸钾溶液,现有25g溶质质量分数为40%的硝酸钾溶液、20g溶质质量分数为15%的硝酸钾溶液及足够多的硝酸钾晶体和蒸馏水,请选用上述的药品,设计三种配制方案填入下表。
方案一:______________________________
方案二:______________________________
方案三:______________________________
三、实验探究题。
24、以下各图所示是某校兴趣小组测定硝酸钾溶解度的部分操作实况。
图A是给试管中水和硝酸钾固体加热;
图B是在加热过程中进行搅拌;
图C是待硝酸钾全部溶解后,将试管从烧杯中取出,停止加热;
图D是在溶液中插入温度计;
图E是用玻璃棒轻轻摩擦试管内壁,当溶液中刚出现硝酸钾晶体时,记下温度计上所示温度。
请根据上述实验内容,回答下列问题:
(1)当试管中硝酸钾的总量达到15.5g时,小组同学分别测出的温度为74.9℃、75.0℃、75.3℃,他们将在实验报告中记录的温度是 。他们进行反复实验的目的是 。
(2)如表所示为兴趣小组在实验报告中,设计的记录实验数据的表格。请根据表格中已有数据,分析实验时,试管中盛有水的体积为 ,并将表中空格内的相应溶解度填写完整。
试管中硝酸钾的总量/g 5 6.5 8 10 12.5
开始析出晶体时的温度t/℃ 32.8 39.6 45.8 54.7 64.9
溶解度/g 50
四、计算类综合题。
25、为检査某石灰石样品中碳酸钙的纯度,取该样品12g放入烧杯中,再向烧杯中加人35g稀盐酸,恰好完全反应(杂质不参加反应),反应后烧杯中物质共42.6g.
(1)反应生成CO2的质量为 ________ g;
(2)石灰石样品中碳酸钙的质量分数是多少?(结果保留到0.1%)
(3)反应后所得溶液的溶质质量分数是多少?(结果保留到0.1%)
2022—2023学年化学人教版九年级下册第九单元 溶液 同步练习含答案
人教第九单元 溶液
一、选择题。
1、下列厨房里的物质与水混合充分搅拌后,不能形成溶液的是( )
A.味精 B.蔗糖 C.食盐 D.菜籽油
【答案】D
2、下列关于溶液组成的说法,正确的是( )
A.溶剂是能溶解其他物质的物质
B.水是常用的溶剂,能溶解所有的物质
C.被溶解的物质都是以离子的形式存在于溶剂中
D.溶质只能是固体物质
【答案】A
3、将适量的下列物质溶解于水的过程中,会使溶液的温度显著降低的是( )
A.氢氧化钙 B.硝酸铵 C.氢氧化钠 D.食盐
【答案】B
4、有关溶液的下列说法,正确的是( )
A 溶液一定是无色的 B 溶剂一定是水
C 溶液一定是液体 D 溶液一定是混合物
【答案】D
5、0 ℃时,四个实验小组分别取不同质量的NaCl,逐渐加入盛有50 g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表。下列说法错误的是 ( )
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
A.20 ℃时,50 g NaCl饱和溶液中含有18 g NaCl
B.用蒸发的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9∶25
D.第一组所得溶液是不饱和溶液
【答案】A
6、闻名中外的青岛啤酒内溶有一定量的二氧化碳,打开瓶盖,你会发现啤酒会自动喷出,喝了啤酒后又会打嗝儿,这说明气体在水中的溶解度与压强和温度有关。下列说法正确的是( )
A.压强越小,气体的溶解度越大
B.压强越小,气体的溶解度越小
C.温度升高,气体的溶解度增大
D.温度降低,气体的溶解度减小
【答案】B
7、实验操作后的溶液一定是不饱和溶液的是( )
A. B.
C. D.
【答案】C
8、欲配制100g质量分数为10%的氢氧化钠溶液。下列说法中不正确的是( )
A.用托盘天平称取10.0g氢氧化钠
B.氢氧化钠易潮解,应放在玻璃器皿中称量
C.实验中用玻璃棒搅拌,其目的是加快氢氧化钠的溶解速率
D.将配好的溶液装入试剂瓶时,少量溶液洒出,溶质质量分数变小
【答案】D
9、用6%的氯化钠溶液配制质量分数为3%的氯化钠溶液,其操作顺序正确的是( )
A.计算、量取、混匀、装瓶 B.量取、计算、混匀、装瓶
C.称取、计算、混匀、装瓶 D.计算、称量、量取、溶解
【答案】A
10、下列物质属于溶液,且溶质是单质的是( )
A 盐酸 B 少量的粉笔灰加入水中
C 少量碘溶于酒精中 D 少量的锌粉溶于稀盐酸中
【答案】C
11、一定温度下,向饱和澄清石灰水中加入少量氧化钙,充分反应后恢复到原来的温度,反应后的溶液与原饱和澄清石灰水相比,下列说法正确的是( )
A. 溶质的质量不变 B. 溶质的质量减少
C. 溶质的质量分数变大 D. 溶质的质量分数减小
【答案】B
12、用固体氢氧化钠配制50克20%的氢氧化钠溶液时,有①溶解、②称量、③计算、④量取等步骤。下列顺序中正确的是( )
A.③②④① B.③②①④ C.①②③④ D.②③④①
【答案】A
13、将50g 20%的氯化钾溶液稀释到5%,需要加水的质量为( )
A.50g B.100g C.150g D.200g
【答案】C
14、下列叙述正确的是( )
A 均一、稳定、无色透明的液体一定是溶液
B 泥水中,泥是溶质,水是溶剂
C 溶液一定是由溶质和溶剂组成的
D 冰和水混合在一起,冰是溶质,水是溶剂
【答案】C
15、下图是a、b、c三种物质的溶解度曲线图,现有一定温度下的a、b、c的不饱和溶液,分别通过增加溶质、蒸发溶剂或升高温度三种方法,均可变成饱和溶液的是( )
A. a溶液 B. b溶液 C. c溶液 D. a溶液和c溶液
【答案】A
二、填空题。
16、甲、乙、丙三种固体物质的溶解度曲线如图所示。请回答:
(1)0℃时,三种物质中溶解度最大的是_____ 。
(2)t2℃时,在盛有50g水的烧杯中加入35g甲物质,充分搅拌后所得溶液的质量是____ 。
(3)将甲溶液由A点转变为B点,可采用的方法是_______________(填一种即可)。
(4)如图,将放有固体X的试管放入烧杯中,然后向试管内加入液体Y,一段时间后丙溶液中有固体析出,则对应的X和Y物质是_____。
A.氯化钠和水 B.镁条和稀盐酸
C.硝酸铵和水 D.氢氧化钠和水
【答案】丙 80g 增加溶质或恒温蒸发溶剂 (填一种即可) BD
17、已知20 ℃时,10 g水中最多能溶解3.6 g食盐,那么100 g水中最多能溶解食盐______g。20 ℃时将5.4 g食盐投入20 g水中,充分溶解后所得到的溶液是_______________。欲使其成为该温度下的饱和溶液还需加入_______g食盐,或蒸发掉______g水。
【答案】36 不饱和溶液 1.8 5
18、水是一种重要的资源。
(1)电解水实验揭示了水的组成.图1实验中得到氧气的试管是________ (填“1”或“2”)。
(2)自来水厂净水过程中用到活性炭,其作用是________。
(3)海水淡化可缓解淡水资源匮乏的问题.图2为太阳能海水淡化装置示意图.
①水变成水蒸气的过程中,不发生变化的是________ (填字母序号)。
A.分子质量 B.分子种类 C.分子间隔
②利用该装置将一定量的海水暴晒一段时间后,剩余海水中氯化钠的质量分数会________ 。(填“变大”、“变小”或“不变”)
【答案】2;吸附性;A,B;变大
19、某实验小组同学准备用粗盐配制一定质量分数的氯化钠溶液,他们设计了如下实验流程:粗盐溶解→沉淀、过滤→蒸发结晶→配制溶液。请回答下列问题:
(1)过滤操作中除用到铁架台、烧杯。滤纸外,还要用到的仪器有__________;
(2)配制溶液过程中,需用__________称量氯化钠,用__________量取蒸馏水。
【答案】漏斗、玻璃棒 托盘天平 量筒
20、作图法是常用的数据处理方法,甲、乙两种物质的溶解度曲线如下图所示。请回答下列问题:
(1)要使乙的饱和溶液变为不饱和溶液,除加水之外,还可采用的方法是:
__ 。
(2)t3℃时,甲、乙两种物质各70g分别加入100g水中,能形成溶液质量为170g的__ 物质。
(3)若甲物质中混有少量的乙物质,提纯甲物质可采取的方法是__ (填“降温结晶”或“蒸发结晶”)。
(4)分别将t3℃时等质量的甲、乙的饱和溶液降温到t2℃,所得溶液中溶剂质量的关系是:甲__ 乙(填“大于”、“等于”、“小于”)。
【答案】 (1)升高温度 (2)甲 (3)降温结晶 (4)小于
21、四个烧杯分别装有质量相等的同种溶剂,向四个烧杯中加入某溶质,且固体溶质质量依次减少(温度相同),充分溶解后如图所示,回答下列各题。(填序号)
(1)_____中盛的一定是饱和溶液。
(2)_____中盛的可能是饱和溶液。
(3)_____中盛的一定是不饱和溶液。
(4)若固体溶质是KNO3,对A、B两烧杯进行加热,随着温度的升高,先变成不饱和溶液的是_____。
(5)在一定温度下,向A、B中分别加入相同质量的水,B中固体刚好全溶,A中是否也全溶?_____。
【答案】AB C D B 否
22、实验室现有足量的20%的NaOH溶液和蒸馏水,欲配制10%的NaOH溶液100g,需要20%的NaOH溶液的质量是________。
【答案】50g
23、实验室要配制50g溶质质量分数为20%的硝酸钾溶液,现有25g溶质质量分数为40%的硝酸钾溶液、20g溶质质量分数为15%的硝酸钾溶液及足够多的硝酸钾晶体和蒸馏水,请选用上述的药品,设计三种配制方案填入下表。
方案一:______________________________
方案二:______________________________
方案三:______________________________
【答案】10g硝酸钾和40g水;
25g溶质质量分数40%的硝酸钾溶液和25g水;
20g溶质质量分数为15%的硝酸钾溶液、7g硝酸钾和23g水。
三、实验探究题。
24、以下各图所示是某校兴趣小组测定硝酸钾溶解度的部分操作实况。
图A是给试管中水和硝酸钾固体加热;
图B是在加热过程中进行搅拌;
图C是待硝酸钾全部溶解后,将试管从烧杯中取出,停止加热;
图D是在溶液中插入温度计;
图E是用玻璃棒轻轻摩擦试管内壁,当溶液中刚出现硝酸钾晶体时,记下温度计上所示温度。
请根据上述实验内容,回答下列问题:
(1)当试管中硝酸钾的总量达到15.5g时,小组同学分别测出的温度为74.9℃、75.0℃、75.3℃,他们将在实验报告中记录的温度是 。他们进行反复实验的目的是 。
(2)如表所示为兴趣小组在实验报告中,设计的记录实验数据的表格。请根据表格中已有数据,分析实验时,试管中盛有水的体积为 ,并将表中空格内的相应溶解度填写完整。
试管中硝酸钾的总量/g 5 6.5 8 10 12.5
开始析出晶体时的温度t/℃ 32.8 39.6 45.8 54.7 64.9
溶解度/g 50
【答案】(1)75.1℃;减少实验的误差; (2)10ml;65;80;100;125。
四、计算类综合题。
25、为检査某石灰石样品中碳酸钙的纯度,取该样品12g放入烧杯中,再向烧杯中加人35g稀盐酸,恰好完全反应(杂质不参加反应),反应后烧杯中物质共42.6g.
(1)反应生成CO2的质量为 ________ g;
(2)石灰石样品中碳酸钙的质量分数是多少?(结果保留到0.1%)
(3)反应后所得溶液的溶质质量分数是多少?(结果保留到0.1%)
【答案】(1)4.4 (2)碳酸钙的质量分数约为83.3%
(3)反应后所得溶液中溶质的质量分数约为27.3%
【解析】(2)设碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 4.4g
x=10g
碳酸钙的质量分数为:×100%≈83.3%
(3)设碳酸钙的质量为x,生成氯化钙的质量为y,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
111 44
y 4.4g
y=11.1g,
反应后所得溶液中溶质的质量分数为:×100%≈27.3%.
同课章节目录
