高一化学人教版(2019)必修第一册 第二章 第二节 氯及其化合物 第2课时(23张ppt)
文档属性
| 名称 | 高一化学人教版(2019)必修第一册 第二章 第二节 氯及其化合物 第2课时(23张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-13 11:17:14 | ||
图片预览






文档简介
(共23张PPT)
第二节 氯及其化合物
2019新教材必修一第二章
第2课时 氯水的成分、氯离子的检验
学习目标:
1、探究氯水的成分,并能分析氯水可能具有的化学性质,通过实验理解氯气漂白的本质。
2、通过氯离子的检验实验,形成证据推理意识。
难点:新制氯水的成分及化学性质
重点:氯水的成分及化学性质、氯离子的检验
新制氯水
久置氯水
放置一段时间之后的氯水
黄绿色
无色
变浅
导入
一 氯水的成分及性质探究
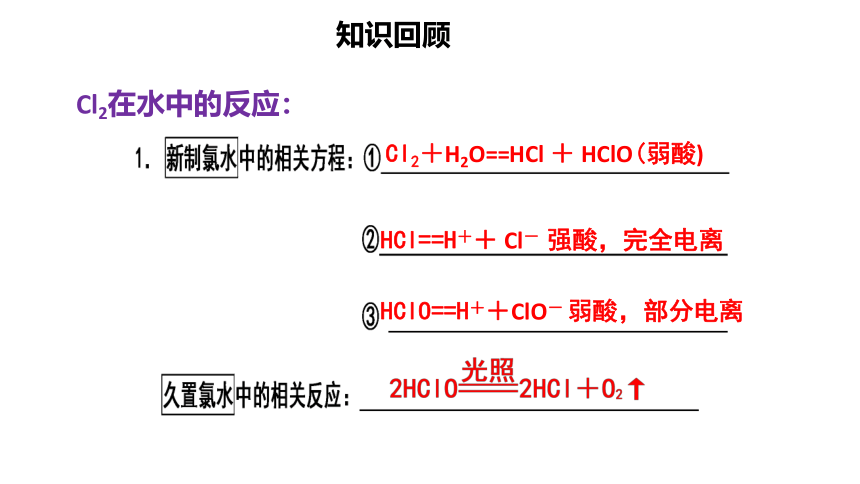
Cl2+H2O==HCl + HClO(弱酸)
HCl==H++ Cl- 强酸,完全电离
HClO==H++ClO- 弱酸,部分电离
知识回顾
Cl2在水中的反应:
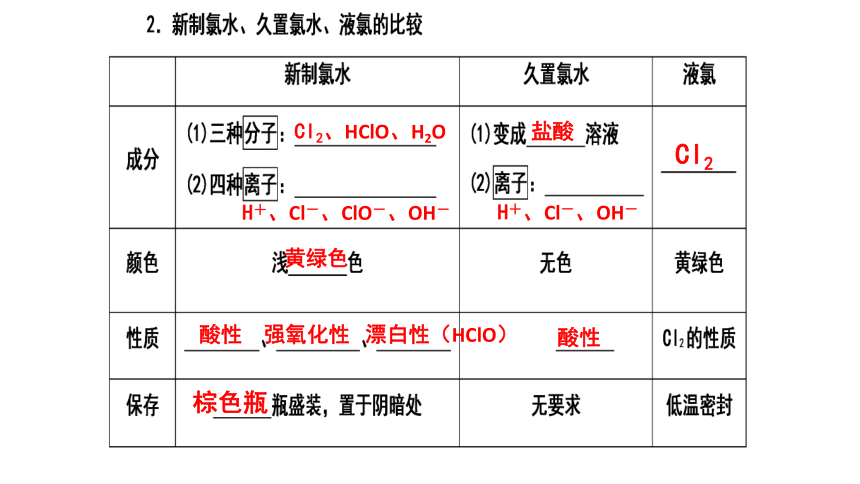
Cl2、HClO、H2O
H+、Cl-、ClO-、OH-
盐酸
H+、Cl-、OH-
Cl2
黄绿色
酸性
强氧化性
漂白性(HClO)
酸性
棕色瓶
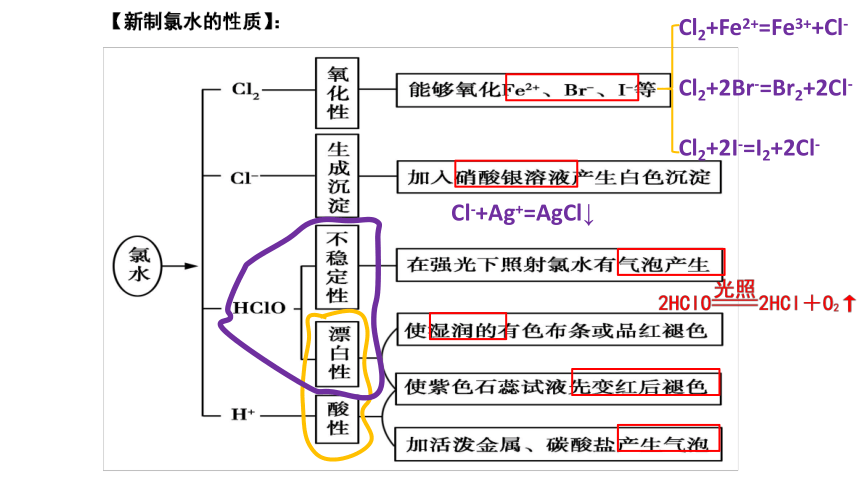
Cl2+Fe2+=Fe3++Cl-
Cl2+2Br-=Br2+2Cl-
Cl2+2I-=I2+2Cl-
Cl-+Ag+=AgCl↓
不褪色
没有
褪色
漂白
HClO
思考:干燥的氯气通入有色鲜花,鲜花是否褪色?
有色鲜花褪色,鲜花里的水分和氯气反应产生有漂白作用的次氯酸
强氧化性
二 氯离子的检验
不同离子的检验方法不同,一般采用可产生的特殊现象来判断,高中常用的如:
1.观察颜色法:
2.焰色试验法:
3.沉淀法:
4.气体法:
钾元素焰色:紫色(通过蓝色钴玻璃观察)、钠元素焰色:
黄色
Cu2+ ( )、Fe3+( )、Fe2+( )、
MnO4-( )
蓝色
棕黄色
浅绿色
紫红色
用于能转化为特殊沉淀的离子检验,如BaSO4、AgCl、Fe(OH)3等
用于能转化为特殊气体的离子检验,如CO2、NH3
【实验2-9】氯离子的检验——沉淀法
在三支试管中分别加入2~3mL稀盐酸、NaCl溶液、Na2CO3溶液,然后各滴入几滴AgNO3溶液,观察现象。再分别加入少量稀硝酸,观察现象。
试液2~3 mL 实验现象 离子方程式
滴入几滴AgNO3溶液 加入少量稀硝酸 ①稀盐酸 ______________ __________ __________________
②NaCl溶液 ______________ __________ __________________
③Na2CO3溶液 ______________ ____________________ __________________________________________________________
有白色沉淀生成
有白色沉淀生成
沉淀不溶解
有白色沉淀生成
有气泡产生
沉淀溶解,
Cl-+Ag+= AgCl↓
Cl-+Ag+= AgCl↓
CO32-+2Ag+= Ag2CO3↓
Ag2CO3+2H+= 2Ag++CO2↑+H2O
沉淀不溶解
归纳:
1.氯离子Cl-检验步骤:
①确定用沉淀法:AgCl沉淀, 选出检验试剂AgNO3溶液
②选择合适的试剂排除可能存在的干扰离子→
③滴加AgNO3试剂,根据现象,确定是否存在Cl-
CO32-
HNO3
思考:稀硝酸和AgNO3溶液顺序能否颠倒?
稀硝酸
2.氯离子Cl-检验的试剂: 。
硝酸银溶液
不溶于稀硝酸
白
3.氯离子Cl-检验的现象:产生 的 色沉淀
可以,不过现象顺序会不同
氯是目前使用最为广泛的消毒剂,用含氯的消毒药剂对自来水进行消毒杀菌,价廉、效果好、操作方便,深受欢迎,全世界通用。但是氯对细菌细胞杀灭效果好,同样,对其他生物体细胞、人体细胞也有严重影响。 添加氯,作为一种有效的杀菌消毒手段,目前仍被世界上超过80%的水厂使用着。所以,市政自来水中必须保持一定量的余氯,以确保饮用水的微生物指标安全。但是,当氯和有机酸反应,就会产生许多致癌的副产物,比如三氯甲烷等。 超过一定量的氯,就会对人体产生许多危害,且带有难闻的气味,俗称“漂白粉味”。专家研究发现,用自来水洗澡十分钟,浴室内氯气总量中有四成是经由呼吸道吸入,三成是由皮肤吸收。可见在密闭的空气中,经由呼吸或皮肤吸入的氯含量相当惊人。这些被皮肤所吸收的氯气,轻者会伤害皮肤,使肤质粗糙甚至产生瘙痒。重则日积月累会造成人的生理机能的衰退,癌症发病率的增加。 每一个家庭都应奉行吃水、用水统一标准,吃水重要,用水同样重要,有条件的家庭都应具备一套家庭中央净水机(系统)就可以很好地在往后的生活中尽量地避免,停止余氯继续对我们身体的侵害。
ClO2
自来水消毒
课堂小结:
1.液氯:Cl2 黄绿色
2. 新制氯水:浅黄绿色,有漂白性、强氧化性、酸性、
3.久置氯水:无色,实际就是盐酸溶液
4..氯离子Cl-检验的试剂:稀硝酸酸化的硝酸银溶液
Cl2+H2O==HCl + HClO(弱酸)
成分: Cl2、HClO、H2O
H+、Cl-、ClO-、OH-
三分子
四离子
B
随堂测:
Cl2
Cl-
H+
HClO
H2O
H+
C
D
C
6.下列关于氯水的叙述中正确的是( )
A.新制氯水中的微粒只含Cl2和H2O
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照新制氯水有气泡逸出,该气体是Cl2
D.新制氯水在密闭无色玻璃瓶中放置数天后酸性将减弱
B
8.下列有关氯气的叙述正确的是( ) A. 氯气可使湿的红布条褪色,所以氯气具有漂白性
B. 氯气可用作自来水消毒,是因为氯气与水反应生成了次氯酸
C. 氯气通入水中,水作还原剂
D. 将干燥的蓝色石蕊试纸放在液氯中,试纸先变红后褪色
7.有些地方的自来水用氯气消毒,某学生用这种自来水配制下列溶液,不会使药品变质的是( )
A.NaOH溶液 B .AgNO3溶液 C.Na2CO3溶液 D. 盐酸
B
D
9.在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是( )
A. 加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B. 溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在
C. 先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在
D. 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
B
谢谢聆听
第二节 氯及其化合物
2019新教材必修一第二章
第2课时 氯水的成分、氯离子的检验
学习目标:
1、探究氯水的成分,并能分析氯水可能具有的化学性质,通过实验理解氯气漂白的本质。
2、通过氯离子的检验实验,形成证据推理意识。
难点:新制氯水的成分及化学性质
重点:氯水的成分及化学性质、氯离子的检验
新制氯水
久置氯水
放置一段时间之后的氯水
黄绿色
无色
变浅
导入
一 氯水的成分及性质探究
Cl2+H2O==HCl + HClO(弱酸)
HCl==H++ Cl- 强酸,完全电离
HClO==H++ClO- 弱酸,部分电离
知识回顾
Cl2在水中的反应:
Cl2、HClO、H2O
H+、Cl-、ClO-、OH-
盐酸
H+、Cl-、OH-
Cl2
黄绿色
酸性
强氧化性
漂白性(HClO)
酸性
棕色瓶
Cl2+Fe2+=Fe3++Cl-
Cl2+2Br-=Br2+2Cl-
Cl2+2I-=I2+2Cl-
Cl-+Ag+=AgCl↓
不褪色
没有
褪色
漂白
HClO
思考:干燥的氯气通入有色鲜花,鲜花是否褪色?
有色鲜花褪色,鲜花里的水分和氯气反应产生有漂白作用的次氯酸
强氧化性
二 氯离子的检验
不同离子的检验方法不同,一般采用可产生的特殊现象来判断,高中常用的如:
1.观察颜色法:
2.焰色试验法:
3.沉淀法:
4.气体法:
钾元素焰色:紫色(通过蓝色钴玻璃观察)、钠元素焰色:
黄色
Cu2+ ( )、Fe3+( )、Fe2+( )、
MnO4-( )
蓝色
棕黄色
浅绿色
紫红色
用于能转化为特殊沉淀的离子检验,如BaSO4、AgCl、Fe(OH)3等
用于能转化为特殊气体的离子检验,如CO2、NH3
【实验2-9】氯离子的检验——沉淀法
在三支试管中分别加入2~3mL稀盐酸、NaCl溶液、Na2CO3溶液,然后各滴入几滴AgNO3溶液,观察现象。再分别加入少量稀硝酸,观察现象。
试液2~3 mL 实验现象 离子方程式
滴入几滴AgNO3溶液 加入少量稀硝酸 ①稀盐酸 ______________ __________ __________________
②NaCl溶液 ______________ __________ __________________
③Na2CO3溶液 ______________ ____________________ __________________________________________________________
有白色沉淀生成
有白色沉淀生成
沉淀不溶解
有白色沉淀生成
有气泡产生
沉淀溶解,
Cl-+Ag+= AgCl↓
Cl-+Ag+= AgCl↓
CO32-+2Ag+= Ag2CO3↓
Ag2CO3+2H+= 2Ag++CO2↑+H2O
沉淀不溶解
归纳:
1.氯离子Cl-检验步骤:
①确定用沉淀法:AgCl沉淀, 选出检验试剂AgNO3溶液
②选择合适的试剂排除可能存在的干扰离子→
③滴加AgNO3试剂,根据现象,确定是否存在Cl-
CO32-
HNO3
思考:稀硝酸和AgNO3溶液顺序能否颠倒?
稀硝酸
2.氯离子Cl-检验的试剂: 。
硝酸银溶液
不溶于稀硝酸
白
3.氯离子Cl-检验的现象:产生 的 色沉淀
可以,不过现象顺序会不同
氯是目前使用最为广泛的消毒剂,用含氯的消毒药剂对自来水进行消毒杀菌,价廉、效果好、操作方便,深受欢迎,全世界通用。但是氯对细菌细胞杀灭效果好,同样,对其他生物体细胞、人体细胞也有严重影响。 添加氯,作为一种有效的杀菌消毒手段,目前仍被世界上超过80%的水厂使用着。所以,市政自来水中必须保持一定量的余氯,以确保饮用水的微生物指标安全。但是,当氯和有机酸反应,就会产生许多致癌的副产物,比如三氯甲烷等。 超过一定量的氯,就会对人体产生许多危害,且带有难闻的气味,俗称“漂白粉味”。专家研究发现,用自来水洗澡十分钟,浴室内氯气总量中有四成是经由呼吸道吸入,三成是由皮肤吸收。可见在密闭的空气中,经由呼吸或皮肤吸入的氯含量相当惊人。这些被皮肤所吸收的氯气,轻者会伤害皮肤,使肤质粗糙甚至产生瘙痒。重则日积月累会造成人的生理机能的衰退,癌症发病率的增加。 每一个家庭都应奉行吃水、用水统一标准,吃水重要,用水同样重要,有条件的家庭都应具备一套家庭中央净水机(系统)就可以很好地在往后的生活中尽量地避免,停止余氯继续对我们身体的侵害。
ClO2
自来水消毒
课堂小结:
1.液氯:Cl2 黄绿色
2. 新制氯水:浅黄绿色,有漂白性、强氧化性、酸性、
3.久置氯水:无色,实际就是盐酸溶液
4..氯离子Cl-检验的试剂:稀硝酸酸化的硝酸银溶液
Cl2+H2O==HCl + HClO(弱酸)
成分: Cl2、HClO、H2O
H+、Cl-、ClO-、OH-
三分子
四离子
B
随堂测:
Cl2
Cl-
H+
HClO
H2O
H+
C
D
C
6.下列关于氯水的叙述中正确的是( )
A.新制氯水中的微粒只含Cl2和H2O
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照新制氯水有气泡逸出,该气体是Cl2
D.新制氯水在密闭无色玻璃瓶中放置数天后酸性将减弱
B
8.下列有关氯气的叙述正确的是( ) A. 氯气可使湿的红布条褪色,所以氯气具有漂白性
B. 氯气可用作自来水消毒,是因为氯气与水反应生成了次氯酸
C. 氯气通入水中,水作还原剂
D. 将干燥的蓝色石蕊试纸放在液氯中,试纸先变红后褪色
7.有些地方的自来水用氯气消毒,某学生用这种自来水配制下列溶液,不会使药品变质的是( )
A.NaOH溶液 B .AgNO3溶液 C.Na2CO3溶液 D. 盐酸
B
D
9.在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是( )
A. 加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B. 溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在
C. 先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在
D. 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
B
谢谢聆听
