高一化学人教版(2019)必修第一册 第二章 第一节 钠及其化合物 第1课时(24张ppt)
文档属性
| 名称 | 高一化学人教版(2019)必修第一册 第二章 第一节 钠及其化合物 第1课时(24张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-13 11:19:06 | ||
图片预览






文档简介
(共24张PPT)
第一节 钠及其化合物
2019新教材必修一第二章
第1课时 活泼的金属单质——钠
学习目标:
1、了解钠的主要性质,正确书写相关的化学方程式
2、在钠的性质探究过程中,选出证据推理意思,培养求实、创新的好品质
3.通过了解生产、生活中钠及其化合物的应用,感受化学的魅力,发展社会参与意识
难点:钠与水反应的探究实验
重点:钠与水反应
你知道生活中钠元素的存在吗?
食盐:NaCl
生理盐水NaCl
注射液
纯碱Na2CO3
情境导入
胃药(抗酸药):NaHCO3
发酵粉NaHCO3
火碱(烧碱)NaOH
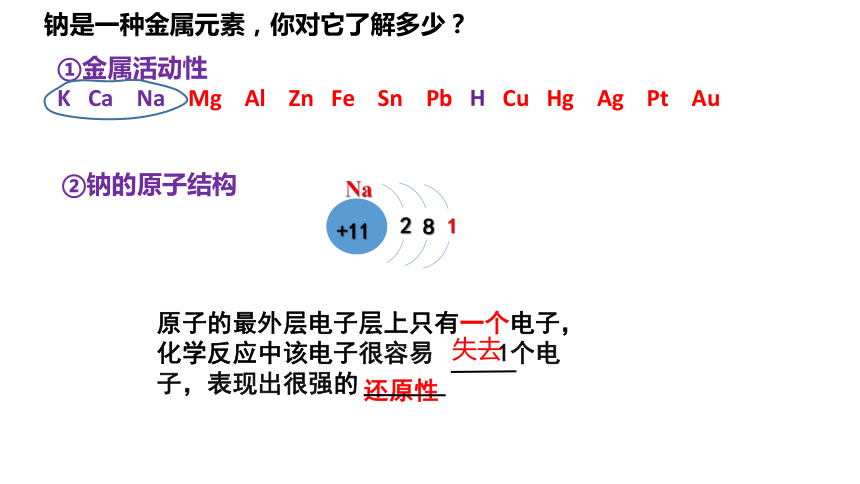
钠是一种金属元素,你对它了解多少?
②钠的原子结构
+11
2
8
1
Na
还原性
原子的最外层电子层上只有一个电子,化学反应中该电子很容易 1个电子,表现出很强的
失去
①金属活动性
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
1.钠非常活泼。钠元素在自然界中 以单质形式存在,都以
的形式存在,如NaCl、Na2CO3、Na2SO4等。
2.钠的单质需要通过化学反应制得,并妥善保存。
3.自然界中含量最多的含钠化合物是NaCl
不
化合物
海洋化学资源非常丰富,有80多种元素,其中钠元素最多,以NaCl形式存在
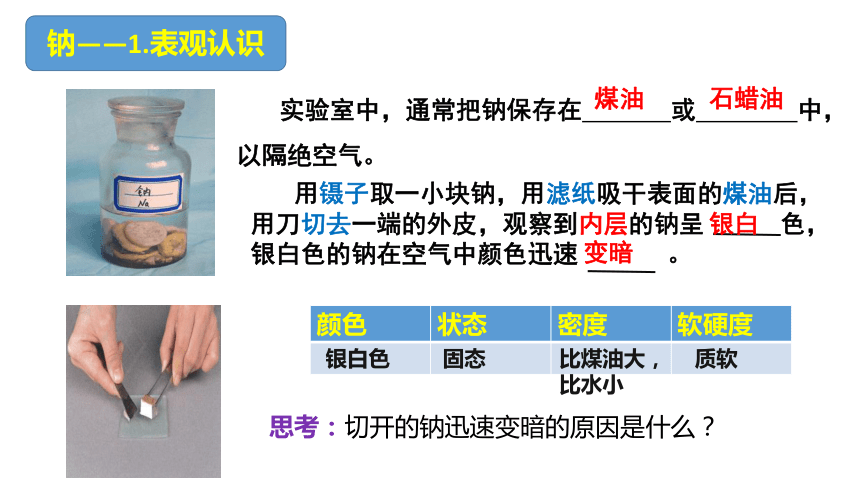
钠——1.表观认识
实验室中,通常把钠保存在 或 中,以隔绝空气。
用镊子取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察到内层的钠呈 色,银白色的钠在空气中颜色迅速 。
思考:切开的钠迅速变暗的原因是什么?
煤油
石蜡油
银白
变暗
颜色 状态 密度 软硬度
银白色
固态
比煤油大,
比水小
质软
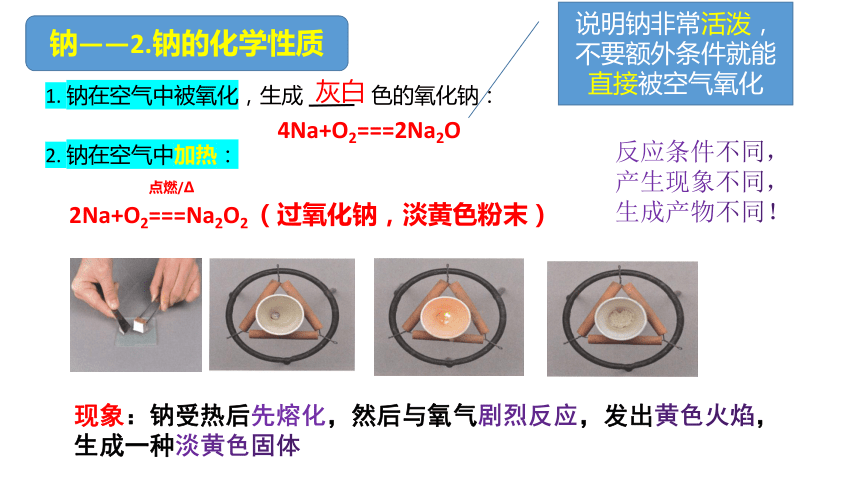
钠——2.钠的化学性质
1. 钠在空气中被氧化,生成 色的氧化钠:
4Na+O2===2Na2O
2. 钠在空气中加热:
点燃/Δ
2Na+O2===Na2O2 (过氧化钠,淡黄色粉末)
说明钠非常活泼,不要额外条件就能直接被空气氧化
现象:钠受热后先熔化,然后与氧气剧烈反应,发出黄色火焰,生成一种淡黄色固体
反应条件不同,
产生现象不同,
生成产物不同!
灰白
3. 钠与其他非金属单质反应:
(1)在氯气中燃烧:
(2)与硫反应:
2Na + Cl2 ===2NaCl
点燃
钠在氯气中剧烈燃烧、火焰呈黄色,产生大量白烟
2Na + S ===Na2S
研磨
火星四射、发生爆炸
4. 钠与水反应:
从物质组成及氧化还原反应的角度,预测钠与水反应的生成物?
探究:在烧杯中加入一些水,滴入几滴酚酞溶液,然后把一块绿豆大的钠放入水中。
钠和水反应,实质上是跟水电离的H+反应,而酸中的H+浓度更大,因此钠不但会和酸反应,且反应比和水反应更剧烈。
例如: 2Na + H2SO4 —— H2↑ + Na2SO4
2Na + 2HCl = 2NaCl + H2↑
5. 钠与酸溶液反应:
5. 钠与盐溶液反应:
思考:钠那么活泼,为什么不用钠来置换水溶液中其他相对不活泼的金属?
溶液中有较多的水,而钠又太活泼,把钠投入盐溶液中,钠会迅速与溶剂水反应,而不是和盐发生置换反应!
例:把一小粒金属钠投入CuSO4溶液中:
① 2Na + 2H2O = 2NaOH + H2↑
② 2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
钠投入CuSO4溶液中的现象:
①有气泡产生
②产生蓝色沉淀
拓展:把一小粒钠投入FeCl3溶液会有什么现象呢?
金属钠着火:
用干燥的沙土
工业上制取金属钠主要是用电解熔融的氯化钠的方法
2NaCl(熔融)===2Na + Cl2↑
电解
熔融态的氯化钠通电后,生成的氯气在此条件下密度较小,就飘在熔炉的上层而生成的钠也是以气体的形式存在,但密度较大,所以飘在下层。
两种气体相邻的位置一接触就会反应,生成氯化钠的小液滴,小液滴越来越多,最后就把两种气体完全隔开了。
再将两种气体分别抽出,再净化、冷却,就可以得到较纯金属钠了。
知识拓展——金属钠的制取
知识拓展——金属钠的用途
制备过氧化钠
钾钠合金导热剂
高压钠灯
将其他金属从卤化物中还原出来,如Na还原TiCl4得到金属Ti
金属钠的性质
质软可切割,硬度比较小,银白色,具有金属光泽固体
电和热的良导体,密度比水小0.971g/cm3
熔点低97.8℃,沸点883℃,保存在煤油和石蜡油中
课堂小结
物理性质
与非金属单质的反应
化学性质
与氧气反应 4Na + O2 === 2Na2O
2Na + O2 === Na2O2
与氯气反应 2Na + Cl2 === 2NaCl
与硫反应 2Na + S === Na2S
点燃
与水的反应
2Na + 2H2O === 2NaOH + H2↑
与酸、盐反应
随堂测:
1.实验室中保存金属钠的方法正确的是( )A.保存在水中
B.保存在四氯化碳中
C.保存在煤油中
D.保存在细沙中
2.下列关于钠的叙述中,不正确的是( ) A.Na硬度小、熔点低 B.金属钠着火,可以用水灭火C.Na在空气中燃烧,发出黄色火焰,产物是Na2O2 D.实验室未用完的金属钠应放回原试剂瓶
C
B
3.将一块金属钠投入足量的下列溶液中,既能生成气体,又能生成白色沉淀的是( )A.稀硫酸 B.Ba(OH)2稀溶液C.MgCl2溶液 D.CuSO4溶液
4.将金属钠投入盛有酚酞溶液的小烧杯中,可说明钠与水反应放热的是( )A.金属钠浮在水面上
B.金属钠熔成小球C.金属钠在水面上迅速游动
D.反应后的溶液呈现红色
C
B
5.下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应也随之改变的是( )
①Na和O2 ②NaOH和CO2 ③木炭(C)和O2 ④稀HCl与NaHCO3溶液
A.①②③④ B.①②③ C.①②④ D.①③④
6.关于钠原子与钠离子,下列叙述错误的是( )A.它们相差一个电子层
B.它们的化学性质相似 C.钠离子比钠原子稳定
D.钠原子、钠离子均为钠元素
B
B
7.下列关于钠的叙述中,不正确的是( )
A.钠燃烧时发出黄色的火焰 B.钠燃烧时产生氧化钠
C.钠具有很强的还原性 D.钠原子的最外电子层上只有1个电子
8. (双选)下列关于描述中,不正确的是( )
A. 钠和水反应的方程式:2Na + 2H2O —— 2NaOH + H2↑
B. 钠在空气中加热的方程式:4Na + O2 —— 2Na2O
C.钠和盐酸反应的方程式: 2Na + 2HCl —— 2NaCl + H2
D.钠和硫酸铜反应的方程式:2Na + CuSO4 —— Cu + Na2SO4
B
BD
9.下面关于金属钠的描述正确的是( )
A.钠的化学性质很活泼,在自然界里能以游离态存在
B.钠离子和钠原子都具有较强的还原性
C.钠能把钛锆等金属从它们的熔融盐中还原出来
D.保存在煤油中的钠是银白色的固体
C
谢谢聆听
第一节 钠及其化合物
2019新教材必修一第二章
第1课时 活泼的金属单质——钠
学习目标:
1、了解钠的主要性质,正确书写相关的化学方程式
2、在钠的性质探究过程中,选出证据推理意思,培养求实、创新的好品质
3.通过了解生产、生活中钠及其化合物的应用,感受化学的魅力,发展社会参与意识
难点:钠与水反应的探究实验
重点:钠与水反应
你知道生活中钠元素的存在吗?
食盐:NaCl
生理盐水NaCl
注射液
纯碱Na2CO3
情境导入
胃药(抗酸药):NaHCO3
发酵粉NaHCO3
火碱(烧碱)NaOH
钠是一种金属元素,你对它了解多少?
②钠的原子结构
+11
2
8
1
Na
还原性
原子的最外层电子层上只有一个电子,化学反应中该电子很容易 1个电子,表现出很强的
失去
①金属活动性
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
1.钠非常活泼。钠元素在自然界中 以单质形式存在,都以
的形式存在,如NaCl、Na2CO3、Na2SO4等。
2.钠的单质需要通过化学反应制得,并妥善保存。
3.自然界中含量最多的含钠化合物是NaCl
不
化合物
海洋化学资源非常丰富,有80多种元素,其中钠元素最多,以NaCl形式存在
钠——1.表观认识
实验室中,通常把钠保存在 或 中,以隔绝空气。
用镊子取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察到内层的钠呈 色,银白色的钠在空气中颜色迅速 。
思考:切开的钠迅速变暗的原因是什么?
煤油
石蜡油
银白
变暗
颜色 状态 密度 软硬度
银白色
固态
比煤油大,
比水小
质软
钠——2.钠的化学性质
1. 钠在空气中被氧化,生成 色的氧化钠:
4Na+O2===2Na2O
2. 钠在空气中加热:
点燃/Δ
2Na+O2===Na2O2 (过氧化钠,淡黄色粉末)
说明钠非常活泼,不要额外条件就能直接被空气氧化
现象:钠受热后先熔化,然后与氧气剧烈反应,发出黄色火焰,生成一种淡黄色固体
反应条件不同,
产生现象不同,
生成产物不同!
灰白
3. 钠与其他非金属单质反应:
(1)在氯气中燃烧:
(2)与硫反应:
2Na + Cl2 ===2NaCl
点燃
钠在氯气中剧烈燃烧、火焰呈黄色,产生大量白烟
2Na + S ===Na2S
研磨
火星四射、发生爆炸
4. 钠与水反应:
从物质组成及氧化还原反应的角度,预测钠与水反应的生成物?
探究:在烧杯中加入一些水,滴入几滴酚酞溶液,然后把一块绿豆大的钠放入水中。
钠和水反应,实质上是跟水电离的H+反应,而酸中的H+浓度更大,因此钠不但会和酸反应,且反应比和水反应更剧烈。
例如: 2Na + H2SO4 —— H2↑ + Na2SO4
2Na + 2HCl = 2NaCl + H2↑
5. 钠与酸溶液反应:
5. 钠与盐溶液反应:
思考:钠那么活泼,为什么不用钠来置换水溶液中其他相对不活泼的金属?
溶液中有较多的水,而钠又太活泼,把钠投入盐溶液中,钠会迅速与溶剂水反应,而不是和盐发生置换反应!
例:把一小粒金属钠投入CuSO4溶液中:
① 2Na + 2H2O = 2NaOH + H2↑
② 2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
钠投入CuSO4溶液中的现象:
①有气泡产生
②产生蓝色沉淀
拓展:把一小粒钠投入FeCl3溶液会有什么现象呢?
金属钠着火:
用干燥的沙土
工业上制取金属钠主要是用电解熔融的氯化钠的方法
2NaCl(熔融)===2Na + Cl2↑
电解
熔融态的氯化钠通电后,生成的氯气在此条件下密度较小,就飘在熔炉的上层而生成的钠也是以气体的形式存在,但密度较大,所以飘在下层。
两种气体相邻的位置一接触就会反应,生成氯化钠的小液滴,小液滴越来越多,最后就把两种气体完全隔开了。
再将两种气体分别抽出,再净化、冷却,就可以得到较纯金属钠了。
知识拓展——金属钠的制取
知识拓展——金属钠的用途
制备过氧化钠
钾钠合金导热剂
高压钠灯
将其他金属从卤化物中还原出来,如Na还原TiCl4得到金属Ti
金属钠的性质
质软可切割,硬度比较小,银白色,具有金属光泽固体
电和热的良导体,密度比水小0.971g/cm3
熔点低97.8℃,沸点883℃,保存在煤油和石蜡油中
课堂小结
物理性质
与非金属单质的反应
化学性质
与氧气反应 4Na + O2 === 2Na2O
2Na + O2 === Na2O2
与氯气反应 2Na + Cl2 === 2NaCl
与硫反应 2Na + S === Na2S
点燃
与水的反应
2Na + 2H2O === 2NaOH + H2↑
与酸、盐反应
随堂测:
1.实验室中保存金属钠的方法正确的是( )A.保存在水中
B.保存在四氯化碳中
C.保存在煤油中
D.保存在细沙中
2.下列关于钠的叙述中,不正确的是( ) A.Na硬度小、熔点低 B.金属钠着火,可以用水灭火C.Na在空气中燃烧,发出黄色火焰,产物是Na2O2 D.实验室未用完的金属钠应放回原试剂瓶
C
B
3.将一块金属钠投入足量的下列溶液中,既能生成气体,又能生成白色沉淀的是( )A.稀硫酸 B.Ba(OH)2稀溶液C.MgCl2溶液 D.CuSO4溶液
4.将金属钠投入盛有酚酞溶液的小烧杯中,可说明钠与水反应放热的是( )A.金属钠浮在水面上
B.金属钠熔成小球C.金属钠在水面上迅速游动
D.反应后的溶液呈现红色
C
B
5.下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应也随之改变的是( )
①Na和O2 ②NaOH和CO2 ③木炭(C)和O2 ④稀HCl与NaHCO3溶液
A.①②③④ B.①②③ C.①②④ D.①③④
6.关于钠原子与钠离子,下列叙述错误的是( )A.它们相差一个电子层
B.它们的化学性质相似 C.钠离子比钠原子稳定
D.钠原子、钠离子均为钠元素
B
B
7.下列关于钠的叙述中,不正确的是( )
A.钠燃烧时发出黄色的火焰 B.钠燃烧时产生氧化钠
C.钠具有很强的还原性 D.钠原子的最外电子层上只有1个电子
8. (双选)下列关于描述中,不正确的是( )
A. 钠和水反应的方程式:2Na + 2H2O —— 2NaOH + H2↑
B. 钠在空气中加热的方程式:4Na + O2 —— 2Na2O
C.钠和盐酸反应的方程式: 2Na + 2HCl —— 2NaCl + H2
D.钠和硫酸铜反应的方程式:2Na + CuSO4 —— Cu + Na2SO4
B
BD
9.下面关于金属钠的描述正确的是( )
A.钠的化学性质很活泼,在自然界里能以游离态存在
B.钠离子和钠原子都具有较强的还原性
C.钠能把钛锆等金属从它们的熔融盐中还原出来
D.保存在煤油中的钠是银白色的固体
C
谢谢聆听
