高一化学人教版(2019)必修第一册 第三章第二节 金属材料 第1课时(26张ppt)
文档属性
| 名称 | 高一化学人教版(2019)必修第一册 第三章第二节 金属材料 第1课时(26张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-13 11:20:01 | ||
图片预览








文档简介
(共26张PPT)
2019新教材必修一第三章
第二节《金属材料》
第1课时 金属材料
学习目标:
1、结合实例认识金属材料,科学、合理的选择和使用金属材料。
2、从合金结构与组成的角度理解合金的特殊性能。
3、知道铝及其化合物的两性性质
难点:铝及其化合物的两性性质
重点:认识常见的金属材料,如铁合金、铝合金等的优点
不锈钢
生铁
黄铜——铜合金
铝合金门窗
硬铝——铝合金
金属材料
纯净物,只有一种金属
混合物,由金属与其他金属或非金属组成
纯金属
合金
注:合金里至少有一种金属,其余物质可能是一种或多种金属,也可能是非金属,或者金属和非金属的混合
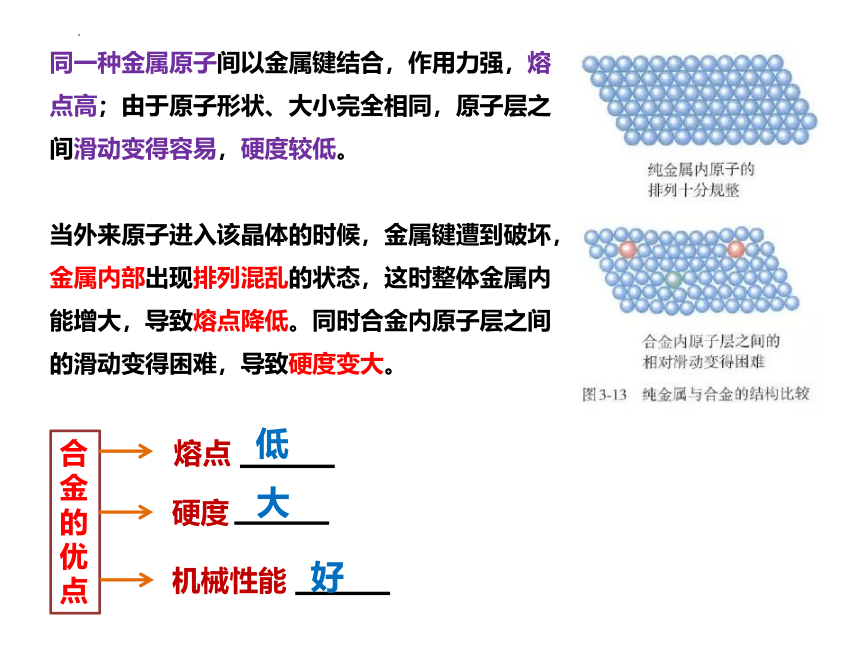
同一种金属原子间以金属键结合,作用力强,熔点高;由于原子形状、大小完全相同,原子层之间滑动变得容易,硬度较低。
当外来原子进入该晶体的时候,金属键遭到破坏,金属内部出现排列混乱的状态,这时整体金属内能增大,导致熔点降低。同时合金内原子层之间的滑动变得困难,导致硬度变大。
合金的优点
熔点
硬度
机械性能
低
大
好
一、铁合金
铁合金
生铁
钢
含碳: 2%~4.3%
含碳: 0.03%~2%
性能:硬度大、抗压、性脆、可铸造成型
用途:是制造机座、管道的重要材料。
性能:延展性、机械性能好、可锻轧和铸造
用途:广泛用于制造机械和交通工具等。
碳素钢
合金钢
不锈钢
超级钢
。。
低碳钢 含碳量低于0.3%
中碳钢 含碳量为0.3%-0.6%
高碳钢 含碳量高于0.6%
合金钢又叫特种钢,在碳素钢里加其他金属
不锈钢是最常见的合金钢,含铬Cr、镍Ni等,稳定,难生锈,抗腐蚀,用于医疗器材、厨房用具,餐具,列车车体
钢是用量最大、用途最广的合金
铁合金用途广泛,但我国最早出现的合金是不是铁合金,而是铜合金——青铜 你知道为什么吗?
古代炼铜场景
我国古代最大的青铜器——司母戊鼎
答:铜元素活泼性较低,容易以单质形式存在,从化合物中提取出铜的条件低
③化学性质:铝性质活泼,铝和铝合金制品比较稳定的原因是表面覆盖着致密的______ _, 保护内部金属。
氧化铝薄膜
①物理性质: 轻金属,有延展性,难溶于水,熔点660℃,沸点2327℃,有良好的导电性、导热性。
②含量:铝在地壳中含量位于金属元素第 位。
银白色
一
1. 铝的单质
二、铝及其化合物
1.铝与非金属单质如氧气反应
2.铝与某些盐如硫酸亚铁溶液反应
3.铝与酸如盐酸反应
4Al+3O2 = 2Al2O3
2Al+3Fe2+ =2Al3++3Fe
2Al+6H+ =2Al3++3H2↑
(致密的氧化膜)
2Al + 3FeSO4 = Al2(SO4)3 + 3Fe
2Al + 6HCl = 2AlCl3 + 3H2↑
铝片(未打磨)与盐酸反应
实验 操作
实验 现象 铝片 ,一段时间后产生气泡且速率由慢到快,将燃着的木条放在试管口,有 (说明有 生成)。
实验 结论 铝和铝表面的氧化膜(氧化铝)都能与酸反应。
化学方程式
【实验3-4】
1.铝、氧化铝与酸的反应
逐渐溶解
爆鸣声
氢气
Al2O3+6HCl=2AlCl3+3H2O
离子方程式呢?
【实验3-5】
2.铝、氧化铝与强碱的反应
铝与氢氧化钠溶液反应
实验 操作
实验 现象 放入打磨过铝片的试管中 产生气泡;而放入未打磨的铝片的试管中开始没有气泡, 才产生气泡。将燃着的木条分别放在两支试管口,均发出 (说明均有 生成)。
实验 结论 铝和铝表面的氧化膜(氧化铝)都能与强碱反应。
化学方程式
立即
一段时间后
爆鸣声
氢气
Al2O3+2NaOH=2NaAlO2+H2O
离子方程式呢?
偏铝酸钠
【知识拓展】
3.氢氧化铝与酸、碱的反应
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
离子方程式呢?
[日常应用] 铝表面有致密的氧化铝保护膜,所以家用铝锅可以随意使用 你认为这种说法对吗?
铝和氧化铝均能与酸、碱反应,因此铝锅不宜用来蒸煮或长时间存放酸性和碱性食物。
Al(OH)3+3H+=Al3++3H2O
Al(OH)3+OH-=AlO2-+2H2O
酸
偏铝酸
氢气
两性
碱
铝及其化合物性质小结:
1、Al、Al2O3、Al(OH)3都既能与 反应,又能与 反应,所以都属于 物质。
2、Al与酸或碱和水反应生成盐和
3、 Al2O3、Al(OH)3与酸、碱反应生成 盐和H2O
三、铝合金
例如: 硬铝中含有Cu、Mg、Mn、Si等元素,它的密度小、强度高,具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
铝合金是目前广泛应用的合金之一。纯铝的硬度和强度较
,不适合制造机器零件等。向铝中加入少量的合金元素,如Cu、Mg、Si、Mn、Zn及 等,可制成铝合金。
小
稀土元素
1. 列举生活中的合金材料,并简述选择该材料时利用了该合金的哪些优异性能。
①铝合金门窗:质轻、耐腐蚀;
②易拉罐:质轻、易回收利用。
2.为什么航空工业中铝合金比铁合金应用更广泛?
铝合金比铁合金密度小且耐高温、耐腐蚀。
3.根据铝的性质分析,如何除去镁粉中的铝粉?
将样品加入足量的NaOH溶液,然后过滤、洗涤、干燥。
[日常应用]
新型合金
储氢合金
钛合金
耐热合金
形状记忆合金合金
广泛应用于航空航天、生物工程、电子工业等领域
为氢能源的应用起到重要的推动作用
三、新型合金
1.下列关于合金的说法错误的是( )
A.合金是由两种或两种以上的金属或金属与非金属熔合而成的具有金属特性的物质
B.镁铝合金的硬度比镁和铝都小
C.在合金中加入适量的稀土金属能大大改善合金的性能
D.青铜、硬铝、钢都是合金
B
随堂测
2.高铁车厢大部分采用铝合金材料制造,这是因为铝合金( )
A.质地轻,强度大,抗腐蚀能力比较强
B.具有比较活泼的化学性质
C.各种成分在自然界中含量丰富,容易获取
D.比纯铝熔点高,耐高温
A
3.下列关于铝的说法中,正确的是( )
A.铝的化学性质不活泼
B.铝不与酸、碱反应
C.常温下铝不与氧气反应
D.铝表面容易生成一层致密的氧化铝保护膜
C
4.在空气中铝制品比铁制品耐腐蚀的原因是( )
A.铝的金属活动性比铁弱
B.铝不与氧气发生化学反应
C.铝在空气中易与氧气反应形成一层致密的氧化膜
D.铝的密度比铁的密度小
5.除去镁粉中的少量铝粉,可选用的是( )
A.稀硫酸 B.氢氧化钠溶液
C.水 D.稀盐酸
C
B
6.下列有关厨房铝制品的使用中,你认为合理的是( )
A.盛放 B.烧煮开水
C.用金属丝擦洗表面的污垢 D.用碱水洗涤
7.下列物质中,不属于合金的是( )
A.硬铝 B.黄铜 C.钢铁 D.水银
B
D
8.向某溶液中加入铝粉能放出H2,下列各组离子一定不能在该溶液中大量共存的是( )
A.Na+、Fe3+、SO42-、Cl-
B.Ba2+、Mg2+、HCO3-、NO3-
C.Na+、K+、NO3-、CO32-
D.K+、NO3-、Na+、SO42-
D
9.向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。上述实验过程中没有发生的离子反应是 。
A.CO2+2OH-===CO32-+H2O
B.Al2O3+2OH-===2AlO2-+H2O
C.2Al+2OH-+2H2O===2AlO2-+3H2↑
D.Al3++4OH-===AlO2-+2H2O
D
11.我国“蛟龙”号载人潜水器已成功下潜至海中7 062.68米处。“蛟龙”号载人潜水器的外壳是耐超高压的钛合金,下面有关合金的说法正确的是( )
A.钛合金是一种新型金属单质 B.钛合金熔点比钛金属高
C.钛合金的硬度与钛单质相同 D.青铜、合金钢和硬铝都是合金
12.下列不属于新型合金材料的是( )
A.储氢合金 B.形状记忆合金
C.不锈钢 D.镍钴耐热合金
D
C
13.下列关于新型合金材料说法不正确的是( )
A.镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料
B.钛合金生物相容性好,强度大,可作人造骨骼
C.形状记忆合金可在使合金发生形变的作用力消失后恢复原状
D.利用合金的熔点低于成分金属这一特点可制得耐热合金
D
谢谢聆听
2019新教材必修一第三章
第二节《金属材料》
第1课时 金属材料
学习目标:
1、结合实例认识金属材料,科学、合理的选择和使用金属材料。
2、从合金结构与组成的角度理解合金的特殊性能。
3、知道铝及其化合物的两性性质
难点:铝及其化合物的两性性质
重点:认识常见的金属材料,如铁合金、铝合金等的优点
不锈钢
生铁
黄铜——铜合金
铝合金门窗
硬铝——铝合金
金属材料
纯净物,只有一种金属
混合物,由金属与其他金属或非金属组成
纯金属
合金
注:合金里至少有一种金属,其余物质可能是一种或多种金属,也可能是非金属,或者金属和非金属的混合
同一种金属原子间以金属键结合,作用力强,熔点高;由于原子形状、大小完全相同,原子层之间滑动变得容易,硬度较低。
当外来原子进入该晶体的时候,金属键遭到破坏,金属内部出现排列混乱的状态,这时整体金属内能增大,导致熔点降低。同时合金内原子层之间的滑动变得困难,导致硬度变大。
合金的优点
熔点
硬度
机械性能
低
大
好
一、铁合金
铁合金
生铁
钢
含碳: 2%~4.3%
含碳: 0.03%~2%
性能:硬度大、抗压、性脆、可铸造成型
用途:是制造机座、管道的重要材料。
性能:延展性、机械性能好、可锻轧和铸造
用途:广泛用于制造机械和交通工具等。
碳素钢
合金钢
不锈钢
超级钢
。。
低碳钢 含碳量低于0.3%
中碳钢 含碳量为0.3%-0.6%
高碳钢 含碳量高于0.6%
合金钢又叫特种钢,在碳素钢里加其他金属
不锈钢是最常见的合金钢,含铬Cr、镍Ni等,稳定,难生锈,抗腐蚀,用于医疗器材、厨房用具,餐具,列车车体
钢是用量最大、用途最广的合金
铁合金用途广泛,但我国最早出现的合金是不是铁合金,而是铜合金——青铜 你知道为什么吗?
古代炼铜场景
我国古代最大的青铜器——司母戊鼎
答:铜元素活泼性较低,容易以单质形式存在,从化合物中提取出铜的条件低
③化学性质:铝性质活泼,铝和铝合金制品比较稳定的原因是表面覆盖着致密的______ _, 保护内部金属。
氧化铝薄膜
①物理性质: 轻金属,有延展性,难溶于水,熔点660℃,沸点2327℃,有良好的导电性、导热性。
②含量:铝在地壳中含量位于金属元素第 位。
银白色
一
1. 铝的单质
二、铝及其化合物
1.铝与非金属单质如氧气反应
2.铝与某些盐如硫酸亚铁溶液反应
3.铝与酸如盐酸反应
4Al+3O2 = 2Al2O3
2Al+3Fe2+ =2Al3++3Fe
2Al+6H+ =2Al3++3H2↑
(致密的氧化膜)
2Al + 3FeSO4 = Al2(SO4)3 + 3Fe
2Al + 6HCl = 2AlCl3 + 3H2↑
铝片(未打磨)与盐酸反应
实验 操作
实验 现象 铝片 ,一段时间后产生气泡且速率由慢到快,将燃着的木条放在试管口,有 (说明有 生成)。
实验 结论 铝和铝表面的氧化膜(氧化铝)都能与酸反应。
化学方程式
【实验3-4】
1.铝、氧化铝与酸的反应
逐渐溶解
爆鸣声
氢气
Al2O3+6HCl=2AlCl3+3H2O
离子方程式呢?
【实验3-5】
2.铝、氧化铝与强碱的反应
铝与氢氧化钠溶液反应
实验 操作
实验 现象 放入打磨过铝片的试管中 产生气泡;而放入未打磨的铝片的试管中开始没有气泡, 才产生气泡。将燃着的木条分别放在两支试管口,均发出 (说明均有 生成)。
实验 结论 铝和铝表面的氧化膜(氧化铝)都能与强碱反应。
化学方程式
立即
一段时间后
爆鸣声
氢气
Al2O3+2NaOH=2NaAlO2+H2O
离子方程式呢?
偏铝酸钠
【知识拓展】
3.氢氧化铝与酸、碱的反应
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
离子方程式呢?
[日常应用] 铝表面有致密的氧化铝保护膜,所以家用铝锅可以随意使用 你认为这种说法对吗?
铝和氧化铝均能与酸、碱反应,因此铝锅不宜用来蒸煮或长时间存放酸性和碱性食物。
Al(OH)3+3H+=Al3++3H2O
Al(OH)3+OH-=AlO2-+2H2O
酸
偏铝酸
氢气
两性
碱
铝及其化合物性质小结:
1、Al、Al2O3、Al(OH)3都既能与 反应,又能与 反应,所以都属于 物质。
2、Al与酸或碱和水反应生成盐和
3、 Al2O3、Al(OH)3与酸、碱反应生成 盐和H2O
三、铝合金
例如: 硬铝中含有Cu、Mg、Mn、Si等元素,它的密度小、强度高,具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
铝合金是目前广泛应用的合金之一。纯铝的硬度和强度较
,不适合制造机器零件等。向铝中加入少量的合金元素,如Cu、Mg、Si、Mn、Zn及 等,可制成铝合金。
小
稀土元素
1. 列举生活中的合金材料,并简述选择该材料时利用了该合金的哪些优异性能。
①铝合金门窗:质轻、耐腐蚀;
②易拉罐:质轻、易回收利用。
2.为什么航空工业中铝合金比铁合金应用更广泛?
铝合金比铁合金密度小且耐高温、耐腐蚀。
3.根据铝的性质分析,如何除去镁粉中的铝粉?
将样品加入足量的NaOH溶液,然后过滤、洗涤、干燥。
[日常应用]
新型合金
储氢合金
钛合金
耐热合金
形状记忆合金合金
广泛应用于航空航天、生物工程、电子工业等领域
为氢能源的应用起到重要的推动作用
三、新型合金
1.下列关于合金的说法错误的是( )
A.合金是由两种或两种以上的金属或金属与非金属熔合而成的具有金属特性的物质
B.镁铝合金的硬度比镁和铝都小
C.在合金中加入适量的稀土金属能大大改善合金的性能
D.青铜、硬铝、钢都是合金
B
随堂测
2.高铁车厢大部分采用铝合金材料制造,这是因为铝合金( )
A.质地轻,强度大,抗腐蚀能力比较强
B.具有比较活泼的化学性质
C.各种成分在自然界中含量丰富,容易获取
D.比纯铝熔点高,耐高温
A
3.下列关于铝的说法中,正确的是( )
A.铝的化学性质不活泼
B.铝不与酸、碱反应
C.常温下铝不与氧气反应
D.铝表面容易生成一层致密的氧化铝保护膜
C
4.在空气中铝制品比铁制品耐腐蚀的原因是( )
A.铝的金属活动性比铁弱
B.铝不与氧气发生化学反应
C.铝在空气中易与氧气反应形成一层致密的氧化膜
D.铝的密度比铁的密度小
5.除去镁粉中的少量铝粉,可选用的是( )
A.稀硫酸 B.氢氧化钠溶液
C.水 D.稀盐酸
C
B
6.下列有关厨房铝制品的使用中,你认为合理的是( )
A.盛放 B.烧煮开水
C.用金属丝擦洗表面的污垢 D.用碱水洗涤
7.下列物质中,不属于合金的是( )
A.硬铝 B.黄铜 C.钢铁 D.水银
B
D
8.向某溶液中加入铝粉能放出H2,下列各组离子一定不能在该溶液中大量共存的是( )
A.Na+、Fe3+、SO42-、Cl-
B.Ba2+、Mg2+、HCO3-、NO3-
C.Na+、K+、NO3-、CO32-
D.K+、NO3-、Na+、SO42-
D
9.向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。上述实验过程中没有发生的离子反应是 。
A.CO2+2OH-===CO32-+H2O
B.Al2O3+2OH-===2AlO2-+H2O
C.2Al+2OH-+2H2O===2AlO2-+3H2↑
D.Al3++4OH-===AlO2-+2H2O
D
11.我国“蛟龙”号载人潜水器已成功下潜至海中7 062.68米处。“蛟龙”号载人潜水器的外壳是耐超高压的钛合金,下面有关合金的说法正确的是( )
A.钛合金是一种新型金属单质 B.钛合金熔点比钛金属高
C.钛合金的硬度与钛单质相同 D.青铜、合金钢和硬铝都是合金
12.下列不属于新型合金材料的是( )
A.储氢合金 B.形状记忆合金
C.不锈钢 D.镍钴耐热合金
D
C
13.下列关于新型合金材料说法不正确的是( )
A.镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料
B.钛合金生物相容性好,强度大,可作人造骨骼
C.形状记忆合金可在使合金发生形变的作用力消失后恢复原状
D.利用合金的熔点低于成分金属这一特点可制得耐热合金
D
谢谢聆听
