高一化学人教版(2019)必修第一册 第二章 第一节 钠及其化合物 第2课时(24张ppt)
文档属性
| 名称 | 高一化学人教版(2019)必修第一册 第二章 第一节 钠及其化合物 第2课时(24张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-13 11:20:58 | ||
图片预览





文档简介
(共24张PPT)
第一节 钠及其化合物
2019新教材必修一第二章
第2课时 钠的几种化合物
焰色试验
学习目标:
1、通过实验探究了解过氧化钠、碳酸钠和碳酸氢钠的性质,了解这些物质在生产和生活中的应用。
2.了解过氧化钠性质,结合实验了解钠及其化合物的性质,了解其应用。
3.掌握焰色试验,领会化学的魅力
难点:1、过氧化钠的性质探究
2、碳酸钠、碳酸氢钠性质对比
重点:过氧化钠、碳酸钠、碳酸氢钠的化学性质。
钠是典型的金属元素,符合一般金属元素的研究规律:
金属单质 → 金属氧化物 → 碱 → 盐
+O2
+H2O
+酸
Na
Na2O
Na2O2
Na2CO3
NaHCO3
NaOH
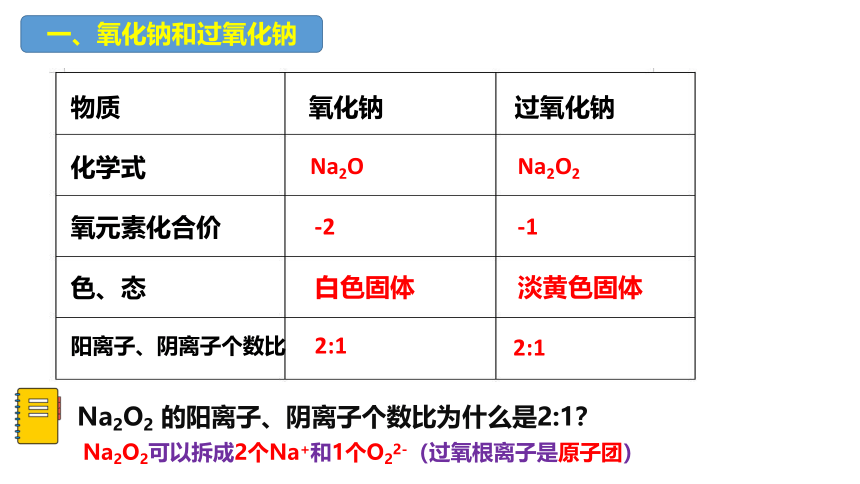
一、氧化钠和过氧化钠
物质 氧化钠 过氧化钠
化学式
氧元素化合价
色、态
阳离子、阴离子个数比
Na2O
Na2O2
-2
-1
白色固体
淡黄色固体
2:1
2:1
Na2O2 的阳离子、阴离子个数比为什么是2:1?
Na2O2可以拆成2个Na+和1个O22-(过氧根离子是原子团)
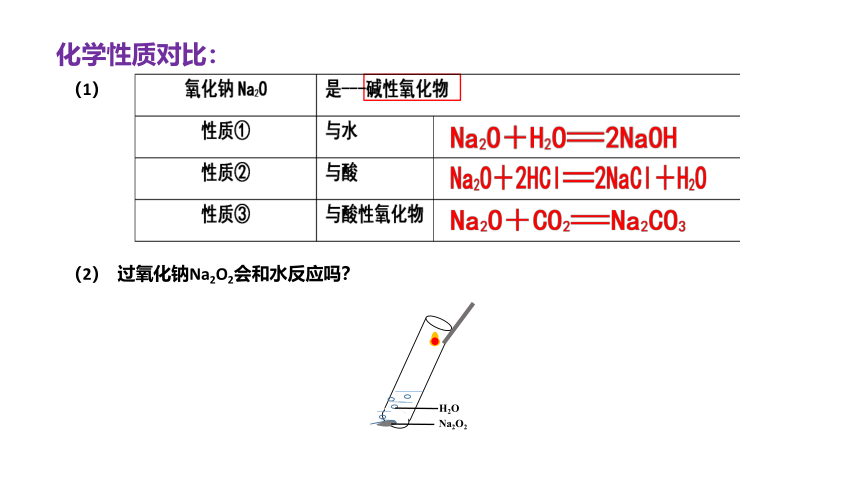
化学性质对比:
(1)
(2) 过氧化钠Na2O2会和水反应吗?
Na2O2
H2O
化学性质对比归纳:
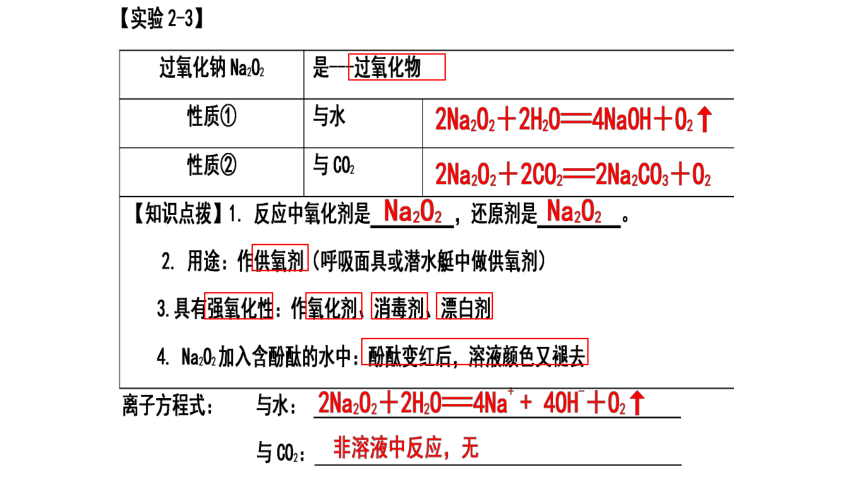
1、Na2O是碱性氧化物,过氧化钠 碱性氧化物。
2、过氧化钠与水、CO2、HCl反应时,都会产生
4、Na2O2用于呼吸面具时的方程式:
3、分析转移的电子数,Na2O2与O2的数量关系(配平):
Na2O2~~ O2
5、过氧化钠与水、CO2、HCl反应时,氧化剂是 ,还原剂是
不是
O2
2
1
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
Na2O2
Na2O2
二、碳酸钠和碳酸氢钠
Na2CO3
NaHCO3
苏打
盐
纯碱
小苏打
1、碳酸钠Na2CO3,俗名 , ,属于 类,常用于纺织、制取肥皂、造纸、生产玻璃等。
2、碳酸氢钠NaHCO3,俗名 ,酸式盐,常用于烘焙蛋糕、抗酸药等。
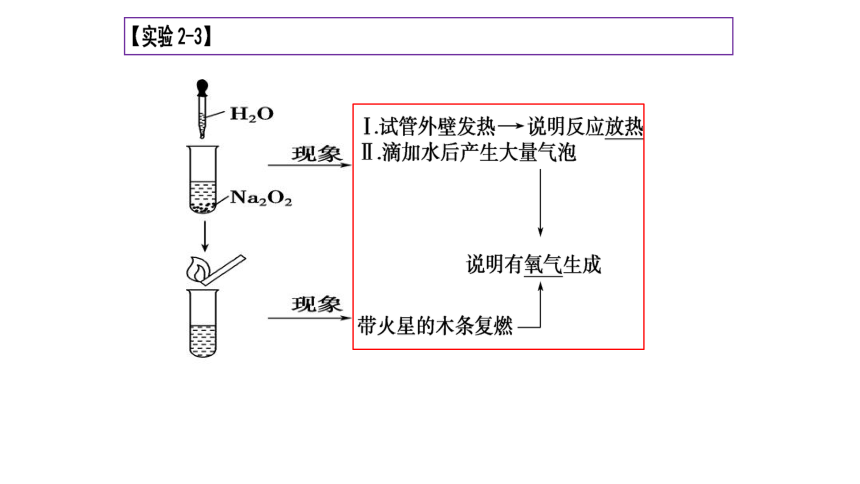
【实验2-4】
盐
(1)观察Na2CO3和NaHCO3的外
观并进行描述
(2)向两支试管中分别滴入几
滴水,振荡,观察现象,测温度
(3)继续向两支试管加入5ml水,用力振荡,观察现象
(4)分别向两试管滴入1~2滴酚
酞溶液,观察现象
初步结论
在两支试管中分别加入少量Na2CO3 和 NaHCO3 (各约1g),完成下列实验,并将实验现象和相应的结论填入下表。
Na2CO3
NaHCO3
白色粉末
细小的白色晶体
粉末结块,温度升高(放出热量)
晶体部分溶解,温度降低(吸收热量)
粉末完全溶解
晶体部分溶解
溶液变红色
溶液变微红色
1.热量: Na2CO3加少量水放热; NaHCO3加少量水吸热
2.溶解性: Na2CO3 > NaHCO3
3.溶液碱性: Na2CO3 > NaHCO3
分别加热Na2CO3和NaHCO3 ,观察现象,比较Na2CO3和NaHCO3的热稳定性。
Na2CO3 或NaHCO3
澄清
石灰水
Na2CO3很稳定,受热不易发生分解;NaHCO3不稳定,受热容易分解。
2NaHCO3 = Na2CO3 + H2O + CO2 ↑
应用:可利用加热的方法来鉴别NaHCO3和Na2CO3(固体)。
【实验2-5】
拓展:在水溶液中,存在方程式: Na2CO3 + H2O + CO2 = 2NaHCO3
固体受热分解
水溶液中
能否写出离子方程式?
实验探究:
向体积、浓度都相等的Na2CO3 和 NaHCO3 溶液中分别滴加等体积、浓度的盐酸和澄清石灰水。有什么现象?发生了什么反应?
①
Na2CO3
NaHCO3
盐酸
一开始没有气泡产生,后来逐渐出现气泡。
迅速产生气泡。
Na2CO3
NaHCO3
现象
解释
Na2CO3
NaHCO3
盐酸滴得少量时,发生反应:
Na2CO3 + HCl = NaCl + NaHCO3
NaHCO3 + HCl = NaCl + H2O + CO2↑
待Na2CO3完全转化为NaHCO3,继续滴加盐酸时发生的反应:
滴入盐酸后第一时间产生CO2气体
分两步反应
结论
与酸反应的剧烈程度(产生气体的速度): NaHCO3 >Na2CO3
②
Na2CO3
NaHCO3
澄清石灰水
Na2CO3
NaHCO3
现象
原理
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
NaHCO3 + Ca(OH)2 = CaCO3↓ + NaOH + H2O
产生白色沉淀
产生白色沉淀
思考:鉴别Na2CO3溶液和NaHCO3溶液,除了可以用盐酸,还能用什么试剂?
可用CaCl2、BaCl2、Ca(NO3)2、Ba(NO3)2等溶液
不可用Ca(OH)2 、Ba(OH)2 等溶液
三、焰色试验
1.概念
很多 在灼烧时都会使火焰呈现特殊的颜色。
根据火焰呈现的特征颜色,可以判断试样所含的 ,化学上把这样的定性分析操作称为焰色试验。
金属或它们的化合物
金属元素
2.焰色试验 化学反应,而是一种 分析操作,属于物理变化
不是
定性
3.操作
4.钠元素火焰:
钾元素火焰:
黄色
紫色(透过蓝色钴玻璃观察)
蓝色钴玻璃
部分金属元素的焰色
①焰色反应在化学上常用于金属单质或其离子的鉴别。
②利用焰色反应制节日烟花。
5.应用
课堂小结
钠元素火焰:
钾元素火焰:
黄色
紫色(透过蓝色钴玻璃观察)
2、碳酸钠和碳酸氢钠性质对比:
1.热量: Na2CO3加少量水放热; NaHCO3加少量水吸热
2.溶解性: Na2CO3 > NaHCO3
3.溶液碱性: Na2CO3 > NaHCO3
4.热稳定性:Na2CO3 > NaHCO3
5.与盐酸反应的剧烈程度:NaHCO3 > Na2CO3
2Na2O2 + 2CO2 = 2Na2CO3 + O2
1、2Na2O2 + 2H2O = 4NaOH + O2↑
过氧化钠可做漂白剂、消毒剂、呼吸面具中的供氧剂
3、焰色试验(不是化学反应)
2NaHCO3 = Na2CO3 + H2O + CO2 ↑
随堂测:
1.下列有关钠的化合物说法正确的是( )
A.将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体
B.用加热法除去NaHCO3固体中混有的Na2CO3
C.灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,一定没有K+
D.钠蒸气充入灯泡中制成钠灯,常用于公路照明
2.下列判断正确的是( )
A.可用水来检验Na2O粉末中是否含有Na2O2
B.可用CO2来检验Na2O粉末中是否含有Na2O2
C.氧化钠和过氧化钠阴、阳离子的个数比不相等
D.将足量的Na2O加到酚酞溶液中,溶液先变红,后褪色
A
D
3.在滴入酚酞的水溶液中加入过氧化钠,观察到的现象是( )
A.变红
B.无色
C.先变红后褪色
D.上述说法都不正确
4.除去Na2CO3固体中少量NaHCO3的最佳方法是( )
A.加入适量盐酸
B.加入NaOH溶液
C.加热灼烧
D.配成溶液后通入CO2
C
C
5.焰色试验实验过程中铂丝的清洗和灼烧与钾焰色试验的观察两项操作如图所示:
下列叙述中不正确的是( )
A.每次实验中都要先将铂丝灼烧至与原来的火焰颜色相同,再蘸取被检验物质
B.钾的焰色试验要透过蓝色钴玻璃观察
C.实验时最好选择本身颜色较深的火焰
D.没有铂丝可用无锈铁丝代替进行实验
C
6.已知A是一种金属单质,B显淡黄色,A、B、C、D之间的转化关系如图所示,下列说法错误的是( )
A.C是碳酸钠
B.D应密封保存
C.A与O2反应只能生成B
D.反应①、②中生成的气体相同
C
谢谢聆听
第一节 钠及其化合物
2019新教材必修一第二章
第2课时 钠的几种化合物
焰色试验
学习目标:
1、通过实验探究了解过氧化钠、碳酸钠和碳酸氢钠的性质,了解这些物质在生产和生活中的应用。
2.了解过氧化钠性质,结合实验了解钠及其化合物的性质,了解其应用。
3.掌握焰色试验,领会化学的魅力
难点:1、过氧化钠的性质探究
2、碳酸钠、碳酸氢钠性质对比
重点:过氧化钠、碳酸钠、碳酸氢钠的化学性质。
钠是典型的金属元素,符合一般金属元素的研究规律:
金属单质 → 金属氧化物 → 碱 → 盐
+O2
+H2O
+酸
Na
Na2O
Na2O2
Na2CO3
NaHCO3
NaOH
一、氧化钠和过氧化钠
物质 氧化钠 过氧化钠
化学式
氧元素化合价
色、态
阳离子、阴离子个数比
Na2O
Na2O2
-2
-1
白色固体
淡黄色固体
2:1
2:1
Na2O2 的阳离子、阴离子个数比为什么是2:1?
Na2O2可以拆成2个Na+和1个O22-(过氧根离子是原子团)
化学性质对比:
(1)
(2) 过氧化钠Na2O2会和水反应吗?
Na2O2
H2O
化学性质对比归纳:
1、Na2O是碱性氧化物,过氧化钠 碱性氧化物。
2、过氧化钠与水、CO2、HCl反应时,都会产生
4、Na2O2用于呼吸面具时的方程式:
3、分析转移的电子数,Na2O2与O2的数量关系(配平):
Na2O2~~ O2
5、过氧化钠与水、CO2、HCl反应时,氧化剂是 ,还原剂是
不是
O2
2
1
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
Na2O2
Na2O2
二、碳酸钠和碳酸氢钠
Na2CO3
NaHCO3
苏打
盐
纯碱
小苏打
1、碳酸钠Na2CO3,俗名 , ,属于 类,常用于纺织、制取肥皂、造纸、生产玻璃等。
2、碳酸氢钠NaHCO3,俗名 ,酸式盐,常用于烘焙蛋糕、抗酸药等。
【实验2-4】
盐
(1)观察Na2CO3和NaHCO3的外
观并进行描述
(2)向两支试管中分别滴入几
滴水,振荡,观察现象,测温度
(3)继续向两支试管加入5ml水,用力振荡,观察现象
(4)分别向两试管滴入1~2滴酚
酞溶液,观察现象
初步结论
在两支试管中分别加入少量Na2CO3 和 NaHCO3 (各约1g),完成下列实验,并将实验现象和相应的结论填入下表。
Na2CO3
NaHCO3
白色粉末
细小的白色晶体
粉末结块,温度升高(放出热量)
晶体部分溶解,温度降低(吸收热量)
粉末完全溶解
晶体部分溶解
溶液变红色
溶液变微红色
1.热量: Na2CO3加少量水放热; NaHCO3加少量水吸热
2.溶解性: Na2CO3 > NaHCO3
3.溶液碱性: Na2CO3 > NaHCO3
分别加热Na2CO3和NaHCO3 ,观察现象,比较Na2CO3和NaHCO3的热稳定性。
Na2CO3 或NaHCO3
澄清
石灰水
Na2CO3很稳定,受热不易发生分解;NaHCO3不稳定,受热容易分解。
2NaHCO3 = Na2CO3 + H2O + CO2 ↑
应用:可利用加热的方法来鉴别NaHCO3和Na2CO3(固体)。
【实验2-5】
拓展:在水溶液中,存在方程式: Na2CO3 + H2O + CO2 = 2NaHCO3
固体受热分解
水溶液中
能否写出离子方程式?
实验探究:
向体积、浓度都相等的Na2CO3 和 NaHCO3 溶液中分别滴加等体积、浓度的盐酸和澄清石灰水。有什么现象?发生了什么反应?
①
Na2CO3
NaHCO3
盐酸
一开始没有气泡产生,后来逐渐出现气泡。
迅速产生气泡。
Na2CO3
NaHCO3
现象
解释
Na2CO3
NaHCO3
盐酸滴得少量时,发生反应:
Na2CO3 + HCl = NaCl + NaHCO3
NaHCO3 + HCl = NaCl + H2O + CO2↑
待Na2CO3完全转化为NaHCO3,继续滴加盐酸时发生的反应:
滴入盐酸后第一时间产生CO2气体
分两步反应
结论
与酸反应的剧烈程度(产生气体的速度): NaHCO3 >Na2CO3
②
Na2CO3
NaHCO3
澄清石灰水
Na2CO3
NaHCO3
现象
原理
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
NaHCO3 + Ca(OH)2 = CaCO3↓ + NaOH + H2O
产生白色沉淀
产生白色沉淀
思考:鉴别Na2CO3溶液和NaHCO3溶液,除了可以用盐酸,还能用什么试剂?
可用CaCl2、BaCl2、Ca(NO3)2、Ba(NO3)2等溶液
不可用Ca(OH)2 、Ba(OH)2 等溶液
三、焰色试验
1.概念
很多 在灼烧时都会使火焰呈现特殊的颜色。
根据火焰呈现的特征颜色,可以判断试样所含的 ,化学上把这样的定性分析操作称为焰色试验。
金属或它们的化合物
金属元素
2.焰色试验 化学反应,而是一种 分析操作,属于物理变化
不是
定性
3.操作
4.钠元素火焰:
钾元素火焰:
黄色
紫色(透过蓝色钴玻璃观察)
蓝色钴玻璃
部分金属元素的焰色
①焰色反应在化学上常用于金属单质或其离子的鉴别。
②利用焰色反应制节日烟花。
5.应用
课堂小结
钠元素火焰:
钾元素火焰:
黄色
紫色(透过蓝色钴玻璃观察)
2、碳酸钠和碳酸氢钠性质对比:
1.热量: Na2CO3加少量水放热; NaHCO3加少量水吸热
2.溶解性: Na2CO3 > NaHCO3
3.溶液碱性: Na2CO3 > NaHCO3
4.热稳定性:Na2CO3 > NaHCO3
5.与盐酸反应的剧烈程度:NaHCO3 > Na2CO3
2Na2O2 + 2CO2 = 2Na2CO3 + O2
1、2Na2O2 + 2H2O = 4NaOH + O2↑
过氧化钠可做漂白剂、消毒剂、呼吸面具中的供氧剂
3、焰色试验(不是化学反应)
2NaHCO3 = Na2CO3 + H2O + CO2 ↑
随堂测:
1.下列有关钠的化合物说法正确的是( )
A.将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体
B.用加热法除去NaHCO3固体中混有的Na2CO3
C.灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,一定没有K+
D.钠蒸气充入灯泡中制成钠灯,常用于公路照明
2.下列判断正确的是( )
A.可用水来检验Na2O粉末中是否含有Na2O2
B.可用CO2来检验Na2O粉末中是否含有Na2O2
C.氧化钠和过氧化钠阴、阳离子的个数比不相等
D.将足量的Na2O加到酚酞溶液中,溶液先变红,后褪色
A
D
3.在滴入酚酞的水溶液中加入过氧化钠,观察到的现象是( )
A.变红
B.无色
C.先变红后褪色
D.上述说法都不正确
4.除去Na2CO3固体中少量NaHCO3的最佳方法是( )
A.加入适量盐酸
B.加入NaOH溶液
C.加热灼烧
D.配成溶液后通入CO2
C
C
5.焰色试验实验过程中铂丝的清洗和灼烧与钾焰色试验的观察两项操作如图所示:
下列叙述中不正确的是( )
A.每次实验中都要先将铂丝灼烧至与原来的火焰颜色相同,再蘸取被检验物质
B.钾的焰色试验要透过蓝色钴玻璃观察
C.实验时最好选择本身颜色较深的火焰
D.没有铂丝可用无锈铁丝代替进行实验
C
6.已知A是一种金属单质,B显淡黄色,A、B、C、D之间的转化关系如图所示,下列说法错误的是( )
A.C是碳酸钠
B.D应密封保存
C.A与O2反应只能生成B
D.反应①、②中生成的气体相同
C
谢谢聆听
