高一化学人教版(2019)必修第一册 第三章第一节 铁盐和亚铁盐之间的转化 第3课时(19张ppt)
文档属性
| 名称 | 高一化学人教版(2019)必修第一册 第三章第一节 铁盐和亚铁盐之间的转化 第3课时(19张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 917.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-13 11:24:00 | ||
图片预览





文档简介
(共19张PPT)
第一节 铁及其化合物
2019新教材必修一第三章
第3课时 铁盐和亚铁盐的转化
学习目标:
1、能通过氧化还原反应的原理,理解铁盐和亚铁盐的性质
2、通过探究实验,体会铁盐和亚铁盐的转化,并能写出相关的离子反应方程式
难点:铁盐和亚铁盐的转化
重点:铁盐和亚铁盐的转化
从氧化还原的角度分析Fe、Fe2+、Fe3+三种形态的铁元素,哪种只可以做氧化剂( )?哪种只可以做还原剂( )?哪种既能做氧化剂,又能做氧化剂( )?
Fe2+和Fe3+之间怎样实现相互转化呢?
Fe2+
Fe3+
氧化剂
还原剂
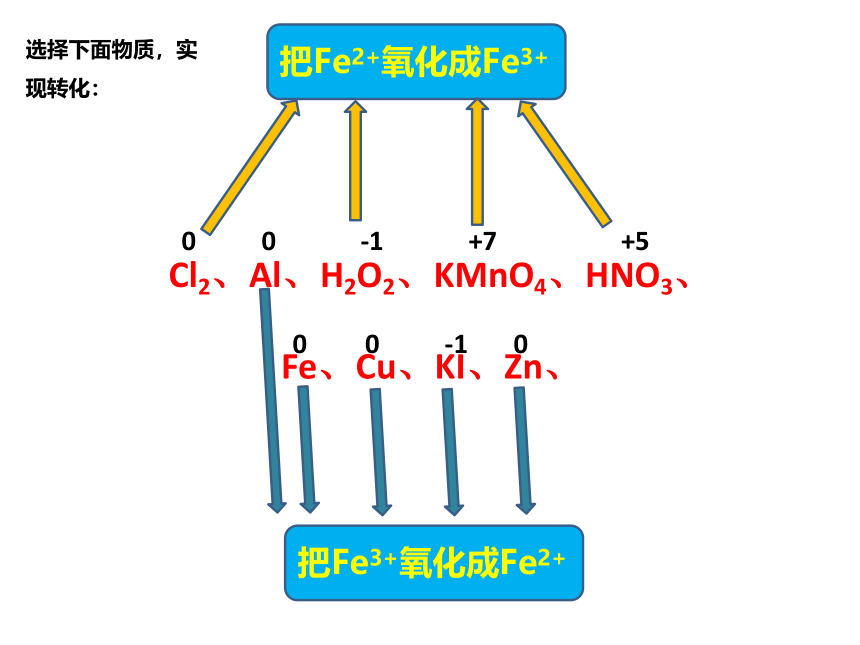
四、铁盐和亚铁盐的转化
Fe3+
Fe2+
Fe
把Fe2+氧化成Fe3+
Cl2、Al、H2O2、KMnO4、HNO3、
Fe、Cu、KI、Zn、
把Fe3+氧化成Fe2+
0 0 -1 +7 +5
0 0 -1 0
选择下面物质,实现转化:
FeCl3溶液
铁粉
加入少量铁粉
滴入几滴氯水
加KSCN溶液
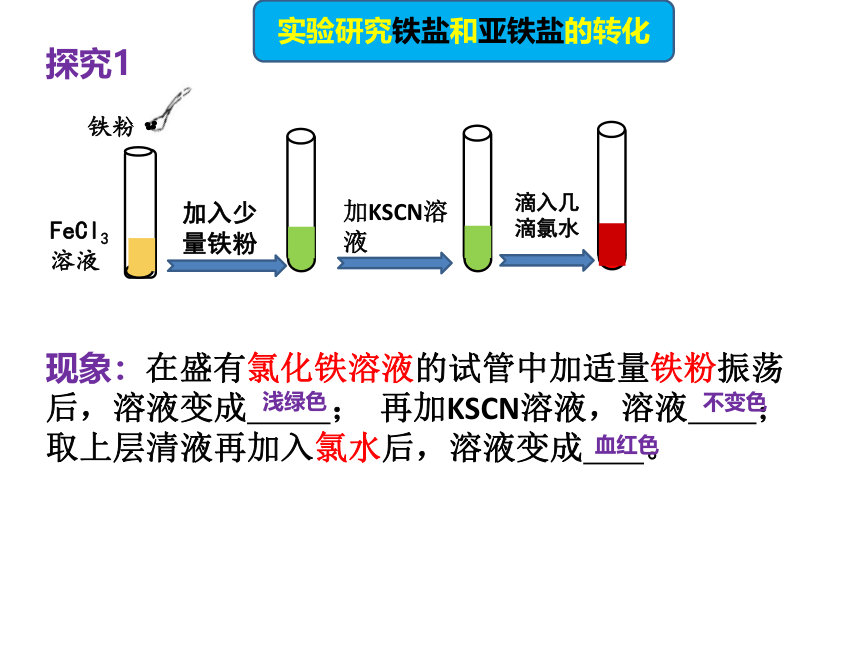
实验研究铁盐和亚铁盐的转化
现象:在盛有氯化铁溶液的试管中加适量铁粉振荡后,溶液变成 ; 再加KSCN溶液,溶液 ;取上层清液再加入氯水后,溶液变成 。
探究1
浅绿色
不变色
血红色
2Fe3+ + Fe = 3Fe2+
2Fe2++Cl2= 2Fe3++ 2Cl-
结论:
1、FeCl3溶液中的Fe3+被铁粉还原成Fe2+,Fe2+不能与KSCN溶液反应,则观察到溶液无明显现象。
写出有关化学方程式:
离子方程式:
2、Fe2+被Cl2氧化成Fe3+,与KSCN溶液反应,观察到溶液变成血红色。
写出有关化学方程式:
离子方程式:
2FeCl3 + Fe = 3FeCl2
2FeCl2 + Cl2 = 2FeCl3
FeCl3 + 3KSCN = Fe(SCN)3+3KCl
Fe3++3SCN-= Fe(SCN)3
硫氰化铁是络合物,不能拆写成离子形式
FeCl2(aq)中滴加KSCN(aq), 现象,再滴加几滴稀盐酸和适量H2O2(aq),出现 色,说明H2O2把Fe2+氧化成了 。
写出该反应离子方程式:
无
血红
Fe3+
实验室配制的FeSO4溶液中需要加入适量Fe粉,以防变质。
用离子方程式表示铁粉的作用:
2Fe3+ + Fe = 3Fe2+
应用
探究2
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
金属活动性
拓展探究 1
1、铁和CuCl2溶液会反应吗?
2、铜和FeCl2溶液会反应吗?
Fe + Cu2+ = Fe2+ + Cu
Fe + CuCl2 = FeCl2 + Cu
不能
3、把FeCl2换成FeCl3溶液,铜片放进去会反应吗?
Cu + 2FeCl3 = 2FeCl2+ CuCl2
Cu + 2Fe3+ = 2Fe2+ + Cu2+
电子工业上常用覆铜板制作印刷电路板,原理是:利用FeCl3溶液做腐蚀液,把覆铜板上不需要的铜腐蚀掉。预先设计好的电路在铜板上用蜡或不透水的物料覆盖,以保护铜线路不被腐蚀。
拓展探究 2
经常听说吃菠菜可以“补铁”,有个同学学过《铁及其化合物》后想通过实验,验证菠菜中到底有没有铁元素。他设计了如下过程:
新鲜菠菜
搅拌打碎挤出汁液
检测
(加KSCN溶液)
过滤得到滤液
灼烧
(灰化)
酸浸 (加盐酸、硝酸)
检测
(加KSCN溶液)
菠菜 (晒干)
过滤
在老师的指导下,他对实验进行了改进:
他能成功检测出铁元素吗?
Fe2O3
Fe3O4
Fe3+
硝酸具有强氧化性
1、绿色素会影响观察有无变色
2、菠菜汁中铁元素存在形式不确定
小结:
铁及其化合物之间的转化关系:
(写出每一步的化学反应方程式)
Fe
Fe2O3
Fe3O4
Fe(OH)2
FeCl2
Fe(OH)3
FeCl3
1、 要除去FeCl2溶液中的少量FeCl3,可行的办法是( )
A. 滴入KSCN溶液 B. 通入氯气
C. 加入铜粉 D. 加入铁粉
D
2、向某溶液中加入含Fe2+的溶液后,无明显变化,当再滴加几滴新制的氯水后,溶液变成红色,则下列结论错误的是( )
A.该溶液中一定含有SCN-
B.氧化性:Fe3+>Cl2
C.Fe2+与SCN-不能形成红色物质
D.Fe2+被氯水氧化成Fe3+
B
3.下列离子方程式中,正确的是( )
A.铁与盐酸反应:2Fe+6H+===2Fe3++3H2↑
B.氯气与氯化亚铁溶液反应:
2FeCl2+Cl2===2FeCl3
C.硫酸铜溶液与铁反应:Cu2++Fe=== Cu+Fe3+
D.氯化铁溶液与氢氧化钠溶液反应:
Fe3++3OH-===Fe(OH)3↓
D
4、为了检验硫酸亚铁溶液是否变质,可以向溶液中加入( )
A.KSCN溶液 B.NaOH溶液
C.石蕊溶液 D.铁片
A
5、除去下列物质中含有的少量杂质,写出除杂所用试剂的化学式和反应的离子方程式:
(1)FeCl2溶液中含有少量的FeCl3杂质;
(2)FeCl3溶液中含有少量的FeCl2杂质;
(3) FeSO4溶液中含有少量的CuSO4杂质。
所用试剂为Fe,反应的离子方程式是: 2Fe3+ + Fe = 3Fe2+
所用试剂为Cl2,反应的离子方程式是: 2Fe2++Cl2 =2Fe3+ +2C1-
所用试剂为Fe,反应的离子方程式是: Fe+Cu2+=Fe2++Cu
6、某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题:
(1)物质①为_______;
请写出Fe2O3与①反应的离子方程式:__________________。
(2)物质②为__________________。
(3)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,
该过程的现象为__________________,
发生的氧化还原反应方程式为:____________________________。
(4)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得的分散系
③为__________________,它与FeCl3溶液、Fe(OH)3浊液的本质区别是
_____________________________。
NaOH
Fe2O3+6H+=2Fe3++3H2O
HCl
生成白色沉淀,迅速变成灰绿色,最终变成红褐色
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe(OH)3胶体
分散质粒子直径大小不同
谢谢聆听
第一节 铁及其化合物
2019新教材必修一第三章
第3课时 铁盐和亚铁盐的转化
学习目标:
1、能通过氧化还原反应的原理,理解铁盐和亚铁盐的性质
2、通过探究实验,体会铁盐和亚铁盐的转化,并能写出相关的离子反应方程式
难点:铁盐和亚铁盐的转化
重点:铁盐和亚铁盐的转化
从氧化还原的角度分析Fe、Fe2+、Fe3+三种形态的铁元素,哪种只可以做氧化剂( )?哪种只可以做还原剂( )?哪种既能做氧化剂,又能做氧化剂( )?
Fe2+和Fe3+之间怎样实现相互转化呢?
Fe2+
Fe3+
氧化剂
还原剂
四、铁盐和亚铁盐的转化
Fe3+
Fe2+
Fe
把Fe2+氧化成Fe3+
Cl2、Al、H2O2、KMnO4、HNO3、
Fe、Cu、KI、Zn、
把Fe3+氧化成Fe2+
0 0 -1 +7 +5
0 0 -1 0
选择下面物质,实现转化:
FeCl3溶液
铁粉
加入少量铁粉
滴入几滴氯水
加KSCN溶液
实验研究铁盐和亚铁盐的转化
现象:在盛有氯化铁溶液的试管中加适量铁粉振荡后,溶液变成 ; 再加KSCN溶液,溶液 ;取上层清液再加入氯水后,溶液变成 。
探究1
浅绿色
不变色
血红色
2Fe3+ + Fe = 3Fe2+
2Fe2++Cl2= 2Fe3++ 2Cl-
结论:
1、FeCl3溶液中的Fe3+被铁粉还原成Fe2+,Fe2+不能与KSCN溶液反应,则观察到溶液无明显现象。
写出有关化学方程式:
离子方程式:
2、Fe2+被Cl2氧化成Fe3+,与KSCN溶液反应,观察到溶液变成血红色。
写出有关化学方程式:
离子方程式:
2FeCl3 + Fe = 3FeCl2
2FeCl2 + Cl2 = 2FeCl3
FeCl3 + 3KSCN = Fe(SCN)3+3KCl
Fe3++3SCN-= Fe(SCN)3
硫氰化铁是络合物,不能拆写成离子形式
FeCl2(aq)中滴加KSCN(aq), 现象,再滴加几滴稀盐酸和适量H2O2(aq),出现 色,说明H2O2把Fe2+氧化成了 。
写出该反应离子方程式:
无
血红
Fe3+
实验室配制的FeSO4溶液中需要加入适量Fe粉,以防变质。
用离子方程式表示铁粉的作用:
2Fe3+ + Fe = 3Fe2+
应用
探究2
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
金属活动性
拓展探究 1
1、铁和CuCl2溶液会反应吗?
2、铜和FeCl2溶液会反应吗?
Fe + Cu2+ = Fe2+ + Cu
Fe + CuCl2 = FeCl2 + Cu
不能
3、把FeCl2换成FeCl3溶液,铜片放进去会反应吗?
Cu + 2FeCl3 = 2FeCl2+ CuCl2
Cu + 2Fe3+ = 2Fe2+ + Cu2+
电子工业上常用覆铜板制作印刷电路板,原理是:利用FeCl3溶液做腐蚀液,把覆铜板上不需要的铜腐蚀掉。预先设计好的电路在铜板上用蜡或不透水的物料覆盖,以保护铜线路不被腐蚀。
拓展探究 2
经常听说吃菠菜可以“补铁”,有个同学学过《铁及其化合物》后想通过实验,验证菠菜中到底有没有铁元素。他设计了如下过程:
新鲜菠菜
搅拌打碎挤出汁液
检测
(加KSCN溶液)
过滤得到滤液
灼烧
(灰化)
酸浸 (加盐酸、硝酸)
检测
(加KSCN溶液)
菠菜 (晒干)
过滤
在老师的指导下,他对实验进行了改进:
他能成功检测出铁元素吗?
Fe2O3
Fe3O4
Fe3+
硝酸具有强氧化性
1、绿色素会影响观察有无变色
2、菠菜汁中铁元素存在形式不确定
小结:
铁及其化合物之间的转化关系:
(写出每一步的化学反应方程式)
Fe
Fe2O3
Fe3O4
Fe(OH)2
FeCl2
Fe(OH)3
FeCl3
1、 要除去FeCl2溶液中的少量FeCl3,可行的办法是( )
A. 滴入KSCN溶液 B. 通入氯气
C. 加入铜粉 D. 加入铁粉
D
2、向某溶液中加入含Fe2+的溶液后,无明显变化,当再滴加几滴新制的氯水后,溶液变成红色,则下列结论错误的是( )
A.该溶液中一定含有SCN-
B.氧化性:Fe3+>Cl2
C.Fe2+与SCN-不能形成红色物质
D.Fe2+被氯水氧化成Fe3+
B
3.下列离子方程式中,正确的是( )
A.铁与盐酸反应:2Fe+6H+===2Fe3++3H2↑
B.氯气与氯化亚铁溶液反应:
2FeCl2+Cl2===2FeCl3
C.硫酸铜溶液与铁反应:Cu2++Fe=== Cu+Fe3+
D.氯化铁溶液与氢氧化钠溶液反应:
Fe3++3OH-===Fe(OH)3↓
D
4、为了检验硫酸亚铁溶液是否变质,可以向溶液中加入( )
A.KSCN溶液 B.NaOH溶液
C.石蕊溶液 D.铁片
A
5、除去下列物质中含有的少量杂质,写出除杂所用试剂的化学式和反应的离子方程式:
(1)FeCl2溶液中含有少量的FeCl3杂质;
(2)FeCl3溶液中含有少量的FeCl2杂质;
(3) FeSO4溶液中含有少量的CuSO4杂质。
所用试剂为Fe,反应的离子方程式是: 2Fe3+ + Fe = 3Fe2+
所用试剂为Cl2,反应的离子方程式是: 2Fe2++Cl2 =2Fe3+ +2C1-
所用试剂为Fe,反应的离子方程式是: Fe+Cu2+=Fe2++Cu
6、某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题:
(1)物质①为_______;
请写出Fe2O3与①反应的离子方程式:__________________。
(2)物质②为__________________。
(3)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,
该过程的现象为__________________,
发生的氧化还原反应方程式为:____________________________。
(4)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得的分散系
③为__________________,它与FeCl3溶液、Fe(OH)3浊液的本质区别是
_____________________________。
NaOH
Fe2O3+6H+=2Fe3++3H2O
HCl
生成白色沉淀,迅速变成灰绿色,最终变成红褐色
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe(OH)3胶体
分散质粒子直径大小不同
谢谢聆听
