高一化学人教版(2019)必修第一册 第四章第三节 化学键(15张ppt)
文档属性
| 名称 | 高一化学人教版(2019)必修第一册 第四章第三节 化学键(15张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-13 11:24:51 | ||
图片预览





文档简介
(共15张PPT)
必修一第四章 第三节
化学键
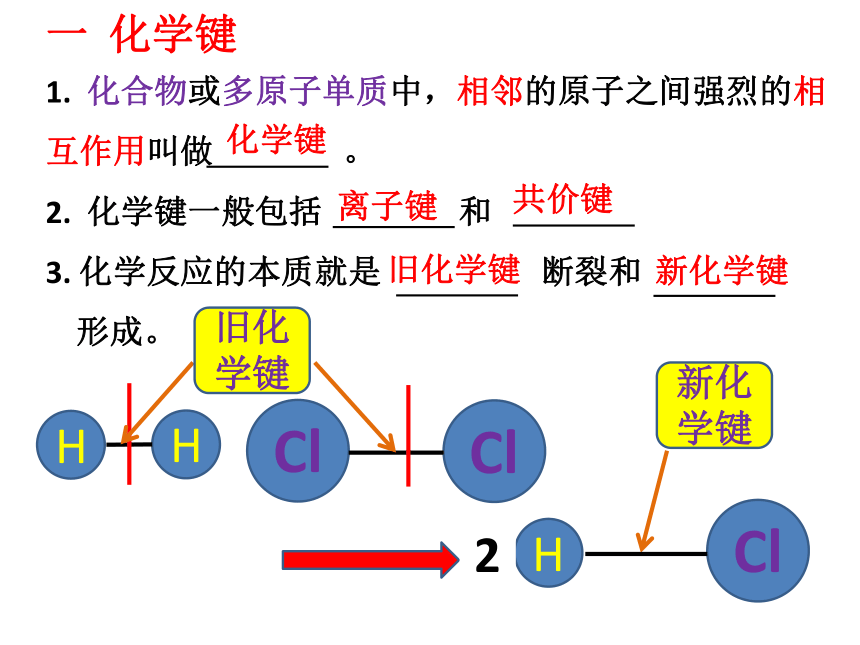
一 化学键
1. 化合物或多原子单质中,相邻的原子之间强烈的相互作用叫做 。
2. 化学键一般包括 和
3. 化学反应的本质就是 断裂和
形成。
H
H
Cl
Cl
旧化学键
新化学键
离子键
共价键
旧化学键
新化学键
化学键
H
Cl
2
二 离子键
1.右图是金属钠和氯气反应后的图片,你能写出方程式吗?
2.钠原子和氯原子的结构示意图如右,它们稳定吗?
3. 最外层有 个电子是稳定结构(若K为最外层时2个电子即为稳定结构)
4. 当钠原子和氯原子相遇时,你们认为它们怎么做才会双赢
(都稳定)?
导入篇
2Na + Cl2=2NaCl
不稳定
8
5. 氯化钠的形成过程
钠原子和氯原子最外层电子数分别为 和 ,均不稳定,它们通过得失电子后达到 电子稳定结构,分别形成Na+和Cl-,这两种带相反电荷的离子通过 结合在一起,形成新物质氯化钠。
6. 之间的相互作用叫做离子键。
成键本质:静电作用(包括 引力和斥力 )。
成键元素:一般是活泼金属元素与活泼非金属元素。
7.离子化合物:由离子键构成的化合物如强碱NaOH、KOH、绝大多数盐NaCl、K2SO4、NH4Cl、活泼金属氧化物K2O、Na2O、MgO、Al2O3等都是离子化合物,由离子键构成。
1
7
8
静电作用
带相反电荷离子
氯化铝AlCl3不是离子化合物,而是共价化合物
新知篇
1)原子:
2)阴离子和原子团要带[ ]和电荷:
H
O
Cl
Mg
Na
三 电子式
1.电子式:在元素符号周围用 .(或×)来表示原
子的最外层电子,这种式子叫电子式。
3)金属阳离子直接写离子符号:
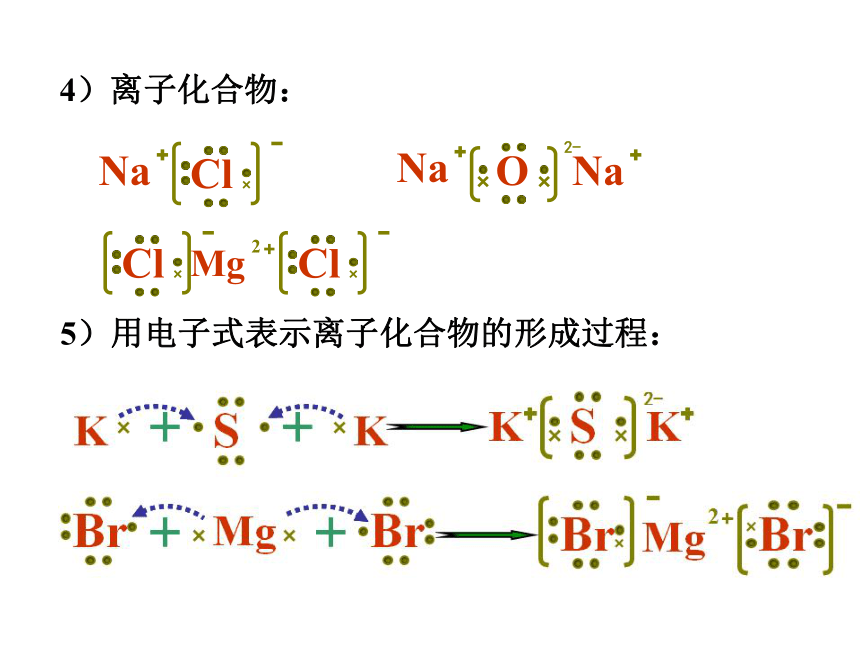
4)离子化合物:
Cl
Na
Na
O
2-
Na
Cl
Mg
2
Cl
5)用电子式表示离子化合物的形成过程:
Cl
]
[
K
Cl
K
练习 1.下列用电子式表示化合物的形成过程正确的是
K
O
K
O
]
[
K
2
K
]
Mg
F
F
Mg
F
2
[
2
[
]
Ba
[
]
Cl
[
]
Cl
2
Ba
Cl
Cl
A
B
C
D
( A )
2. 用电子式表示下列离子化合物的形成过程。
(1)Na2O (2)CaCl2
四 共价键
Na与Cl
H与Cl
引入篇
氯化氢分子的形成:
··
· Cl
··
:
H ·
+
→
Cl
··
··
H
··
··
H﹣Cl(结构式)
极性键
非极性键
共价化合物——以共用电子对形成分子的化合物,由非金属元素与非金属元素组成。
共价键:原子之间通过 所形成的相互作用,叫做共价键
成键微粒:非金属原子
相互作用:共用电子对
成键元素:同种或不同种非金属元素
共价键包括 和
极性键: 原子形成的共价键
非极性键: 原子形成的共价键
新知篇
共用电子对
极性键
非极性键
不同种
同种
铵盐如NH4Cl属于离子化合物
1、下列说法中正确的是( )
A.含有离子键的化合物必是离子化合物
B.具有共价键的化合物就是共价化合物
C.共价化合物可能含离子键
D.离子化合物中可能含有共价键
2、下列物质中含有共价键的离子化合物是( )
A.Ba(OH)2 B.CaCl2 C.H2O D.H2
课堂练习
AD
A
3.下列关于共价键的说法正确的是( )
A.金属原子在化学反应中只能失去电子,因而不能形成共价键
B.由共价键形成的分子可以是单质分子,也可以是化合物分子
C.共价键只能在不同原子之间形成
D.稀有气体分子中只存在共价键
4.下列过程没有发生化学键变化的是( )
A.生石灰投入水中
B.氯化氢气体通入水中
C.冰融化成水
D.高锰酸钾固体受热分解
B
C
5.下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是( )
A. H2O 电解成氢气和氧气与NaCl电解成钠和氯气
B.干冰CO2和碳酸氢钠分别受热得到气体
C.HCl和NaOH反应生成盐和水
D.MgCl2电解成镁和氯气与K2S电解成钾和硫
D
6.下列电子式错误的是( )
C
课堂小结:离子化合物和共价化合物
离子化合物 共价化合物
成键作用
成键微粒
成键本质
表示法
成键元素
[ ]
+
-
·
Na
Cl
·
·
:
:
·
Cl
··
··
H
··
··
离子键
共价键
阴、阳离子
原子
静电作用
共用电子对
以NaCl为例
以为HCl例
典型的金属元素、典型的非金属元素之间
同种元素或同类非金属元素之间
谢谢聆听!
必修一第四章 第三节
化学键
一 化学键
1. 化合物或多原子单质中,相邻的原子之间强烈的相互作用叫做 。
2. 化学键一般包括 和
3. 化学反应的本质就是 断裂和
形成。
H
H
Cl
Cl
旧化学键
新化学键
离子键
共价键
旧化学键
新化学键
化学键
H
Cl
2
二 离子键
1.右图是金属钠和氯气反应后的图片,你能写出方程式吗?
2.钠原子和氯原子的结构示意图如右,它们稳定吗?
3. 最外层有 个电子是稳定结构(若K为最外层时2个电子即为稳定结构)
4. 当钠原子和氯原子相遇时,你们认为它们怎么做才会双赢
(都稳定)?
导入篇
2Na + Cl2=2NaCl
不稳定
8
5. 氯化钠的形成过程
钠原子和氯原子最外层电子数分别为 和 ,均不稳定,它们通过得失电子后达到 电子稳定结构,分别形成Na+和Cl-,这两种带相反电荷的离子通过 结合在一起,形成新物质氯化钠。
6. 之间的相互作用叫做离子键。
成键本质:静电作用(包括 引力和斥力 )。
成键元素:一般是活泼金属元素与活泼非金属元素。
7.离子化合物:由离子键构成的化合物如强碱NaOH、KOH、绝大多数盐NaCl、K2SO4、NH4Cl、活泼金属氧化物K2O、Na2O、MgO、Al2O3等都是离子化合物,由离子键构成。
1
7
8
静电作用
带相反电荷离子
氯化铝AlCl3不是离子化合物,而是共价化合物
新知篇
1)原子:
2)阴离子和原子团要带[ ]和电荷:
H
O
Cl
Mg
Na
三 电子式
1.电子式:在元素符号周围用 .(或×)来表示原
子的最外层电子,这种式子叫电子式。
3)金属阳离子直接写离子符号:
4)离子化合物:
Cl
Na
Na
O
2-
Na
Cl
Mg
2
Cl
5)用电子式表示离子化合物的形成过程:
Cl
]
[
K
Cl
K
练习 1.下列用电子式表示化合物的形成过程正确的是
K
O
K
O
]
[
K
2
K
]
Mg
F
F
Mg
F
2
[
2
[
]
Ba
[
]
Cl
[
]
Cl
2
Ba
Cl
Cl
A
B
C
D
( A )
2. 用电子式表示下列离子化合物的形成过程。
(1)Na2O (2)CaCl2
四 共价键
Na与Cl
H与Cl
引入篇
氯化氢分子的形成:
··
· Cl
··
:
H ·
+
→
Cl
··
··
H
··
··
H﹣Cl(结构式)
极性键
非极性键
共价化合物——以共用电子对形成分子的化合物,由非金属元素与非金属元素组成。
共价键:原子之间通过 所形成的相互作用,叫做共价键
成键微粒:非金属原子
相互作用:共用电子对
成键元素:同种或不同种非金属元素
共价键包括 和
极性键: 原子形成的共价键
非极性键: 原子形成的共价键
新知篇
共用电子对
极性键
非极性键
不同种
同种
铵盐如NH4Cl属于离子化合物
1、下列说法中正确的是( )
A.含有离子键的化合物必是离子化合物
B.具有共价键的化合物就是共价化合物
C.共价化合物可能含离子键
D.离子化合物中可能含有共价键
2、下列物质中含有共价键的离子化合物是( )
A.Ba(OH)2 B.CaCl2 C.H2O D.H2
课堂练习
AD
A
3.下列关于共价键的说法正确的是( )
A.金属原子在化学反应中只能失去电子,因而不能形成共价键
B.由共价键形成的分子可以是单质分子,也可以是化合物分子
C.共价键只能在不同原子之间形成
D.稀有气体分子中只存在共价键
4.下列过程没有发生化学键变化的是( )
A.生石灰投入水中
B.氯化氢气体通入水中
C.冰融化成水
D.高锰酸钾固体受热分解
B
C
5.下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是( )
A. H2O 电解成氢气和氧气与NaCl电解成钠和氯气
B.干冰CO2和碳酸氢钠分别受热得到气体
C.HCl和NaOH反应生成盐和水
D.MgCl2电解成镁和氯气与K2S电解成钾和硫
D
6.下列电子式错误的是( )
C
课堂小结:离子化合物和共价化合物
离子化合物 共价化合物
成键作用
成键微粒
成键本质
表示法
成键元素
[ ]
+
-
·
Na
Cl
·
·
:
:
·
Cl
··
··
H
··
··
离子键
共价键
阴、阳离子
原子
静电作用
共用电子对
以NaCl为例
以为HCl例
典型的金属元素、典型的非金属元素之间
同种元素或同类非金属元素之间
谢谢聆听!
