铝的氧化物和氢氧化物
图片预览






文档简介
课件15张PPT。 第一单元 第二课时
铝的氧化物和氢氧化物1.耐火材料 难熔;高硬度;2.刚玉:氧化铝的一种晶型一、氧化铝刚玉耐磨球宝石Al2O3在物质分类中的类别?Al2O3 + 6HCl == 2AlCl3 + 3H2O Al2O3 + 2NaOH == 2NaAlO2 + H2O 化学性质两性氧化物——既能与酸反应又能碱反应生成盐和水的氧化物与酸的反应与碱的反应Al2O3 + 6H+ = 2Al3+ + 3H2OAl2O3 + 2OH- = 2AlO2- + H2O [商品名称]斯达舒
[成份]本品每粒含氢氧化铝
140毫克,维生素U50毫克,
颠茄提取物10毫克,辅料:
淀粉 。
[药理作用]本品中氢氧化铝
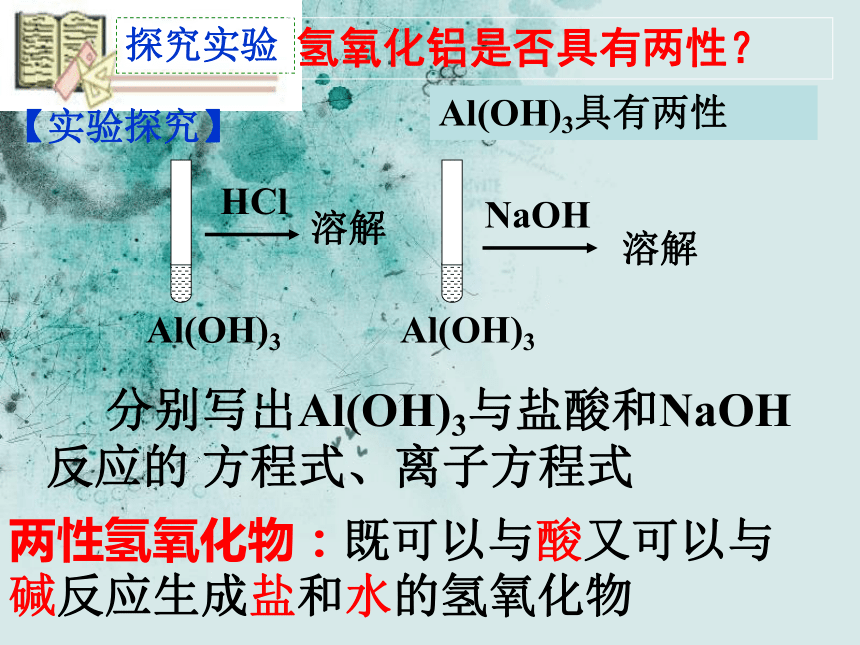
为抗酸药,能中和胃酸并保护溃疡面;维生素U能促进肉芽发育和黏膜再生;颠茄流浸膏可抑制腺体分泌,解除平滑痉挛引起的疼痛。二、铝的氢氧化物氢氧化铝物理性质 白色胶状物,几乎不溶于水,但能凝聚水中悬浮物,并能吸附色素。 【交流讨论】 请设计实验探究氢氧化铝是否具有两性。溶解溶解探究实验 分别写出Al(OH)3与盐酸和NaOH反应的 方程式、离子方程式Al(OH)3具有两性两性氢氧化物:既可以与酸又可以与碱反应生成盐和水的氢氧化物氢氧化铝是否具有两性?【实验探究】反思延伸沉淀AlCl3+3NaOH=3NaCl+Al(OH)3↓AlCl3 + 3NH3·H2O = Al(OH)3 ↓ + 3NH4Cl弱碱强碱Al(OH)3+NaOH= NaAlO2+2H2O酸性先沉淀后不溶解碱性比氨水弱不溶解于氨水氢氧化铝的性质反思延伸Al(OH)3 + 3HCl= AlCl3 + 3H2ONaAlO2+HCl+H2O=Al(OH)3↓+NaCl强酸弱酸弱碱沉淀NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3酸性比碳酸更弱沉淀氢氧化铝的性质氢氧化铝两性的原因酸式电离碱式电离氢氧化铝既有弱酸性又有弱碱性,酸性比碳酸还弱,碱性比氨水还弱科学探究如何制备Al(OH)3呢?1.偏铝酸钠溶液中通入二氧化碳。
2.氯化铝溶液中加入氢氧化钠溶液。
3.氯化铝溶液中加入氨水。
4.偏铝酸钠溶液中加入氯化铝溶液
为什么不可以?×Al(OH)3可以用来净水浑浊塘水成为救命水 Al(OH)的3应用硫酸铝钾KAl(SO4)2明矾:KAl(SO4)2·12H2O在天然水中产生的Al(OH)3胶体吸附能力很强,可以用来吸附水里的杂质,而作净水剂。KAl(SO4)2=K+ + Al3+ + 2SO42-无色晶体,可溶于水小结Al(OH)3AlO2-Al 3+3、H+4、少量OH- 或NH3·H2O1、OH-6、OH-5、H+2、少量H+ 或CO2“铝三角”1. 氢氧化铝可作为治疗某种胃病的内服药,这是利用了氢氧化铝的 ( )
A.酸性 B. 碱性
C.两性 D.氧化性B2.下列物质中属于两性氢氧化物的是:( )
A. NaOH B.Al(OH)3 C.Mg(OH)2 D.Ba(OH)2
B巩固与练习巩固与练习3.要使AlCl3中的 完全转化成Al(OH)3沉淀,
选用的最佳试剂为:( )
A. NaOH B.稀盐酸 C.氨水 D. AgNO3
C
铝的氧化物和氢氧化物1.耐火材料 难熔;高硬度;2.刚玉:氧化铝的一种晶型一、氧化铝刚玉耐磨球宝石Al2O3在物质分类中的类别?Al2O3 + 6HCl == 2AlCl3 + 3H2O Al2O3 + 2NaOH == 2NaAlO2 + H2O 化学性质两性氧化物——既能与酸反应又能碱反应生成盐和水的氧化物与酸的反应与碱的反应Al2O3 + 6H+ = 2Al3+ + 3H2OAl2O3 + 2OH- = 2AlO2- + H2O [商品名称]斯达舒
[成份]本品每粒含氢氧化铝
140毫克,维生素U50毫克,
颠茄提取物10毫克,辅料:
淀粉 。
[药理作用]本品中氢氧化铝
为抗酸药,能中和胃酸并保护溃疡面;维生素U能促进肉芽发育和黏膜再生;颠茄流浸膏可抑制腺体分泌,解除平滑痉挛引起的疼痛。二、铝的氢氧化物氢氧化铝物理性质 白色胶状物,几乎不溶于水,但能凝聚水中悬浮物,并能吸附色素。 【交流讨论】 请设计实验探究氢氧化铝是否具有两性。溶解溶解探究实验 分别写出Al(OH)3与盐酸和NaOH反应的 方程式、离子方程式Al(OH)3具有两性两性氢氧化物:既可以与酸又可以与碱反应生成盐和水的氢氧化物氢氧化铝是否具有两性?【实验探究】反思延伸沉淀AlCl3+3NaOH=3NaCl+Al(OH)3↓AlCl3 + 3NH3·H2O = Al(OH)3 ↓ + 3NH4Cl弱碱强碱Al(OH)3+NaOH= NaAlO2+2H2O酸性先沉淀后不溶解碱性比氨水弱不溶解于氨水氢氧化铝的性质反思延伸Al(OH)3 + 3HCl= AlCl3 + 3H2ONaAlO2+HCl+H2O=Al(OH)3↓+NaCl强酸弱酸弱碱沉淀NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3酸性比碳酸更弱沉淀氢氧化铝的性质氢氧化铝两性的原因酸式电离碱式电离氢氧化铝既有弱酸性又有弱碱性,酸性比碳酸还弱,碱性比氨水还弱科学探究如何制备Al(OH)3呢?1.偏铝酸钠溶液中通入二氧化碳。
2.氯化铝溶液中加入氢氧化钠溶液。
3.氯化铝溶液中加入氨水。
4.偏铝酸钠溶液中加入氯化铝溶液
为什么不可以?×Al(OH)3可以用来净水浑浊塘水成为救命水 Al(OH)的3应用硫酸铝钾KAl(SO4)2明矾:KAl(SO4)2·12H2O在天然水中产生的Al(OH)3胶体吸附能力很强,可以用来吸附水里的杂质,而作净水剂。KAl(SO4)2=K+ + Al3+ + 2SO42-无色晶体,可溶于水小结Al(OH)3AlO2-Al 3+3、H+4、少量OH- 或NH3·H2O1、OH-6、OH-5、H+2、少量H+ 或CO2“铝三角”1. 氢氧化铝可作为治疗某种胃病的内服药,这是利用了氢氧化铝的 ( )
A.酸性 B. 碱性
C.两性 D.氧化性B2.下列物质中属于两性氢氧化物的是:( )
A. NaOH B.Al(OH)3 C.Mg(OH)2 D.Ba(OH)2
B巩固与练习巩固与练习3.要使AlCl3中的 完全转化成Al(OH)3沉淀,
选用的最佳试剂为:( )
A. NaOH B.稀盐酸 C.氨水 D. AgNO3
C
