9.2.2溶解度曲线课件(19张PPT)—2022—2023学年九年级化学人教版下册
文档属性
| 名称 | 9.2.2溶解度曲线课件(19张PPT)—2022—2023学年九年级化学人教版下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 8.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-12 22:05:07 | ||
图片预览




文档简介
9.2 溶解度
第二课时 溶解度曲线
温故知新
溶解度的概念、四要素
含义: 硝酸钾在60 ℃时的溶解度是110.0g
饱和溶液中的质量关系
影响溶解度的因素
探究新知
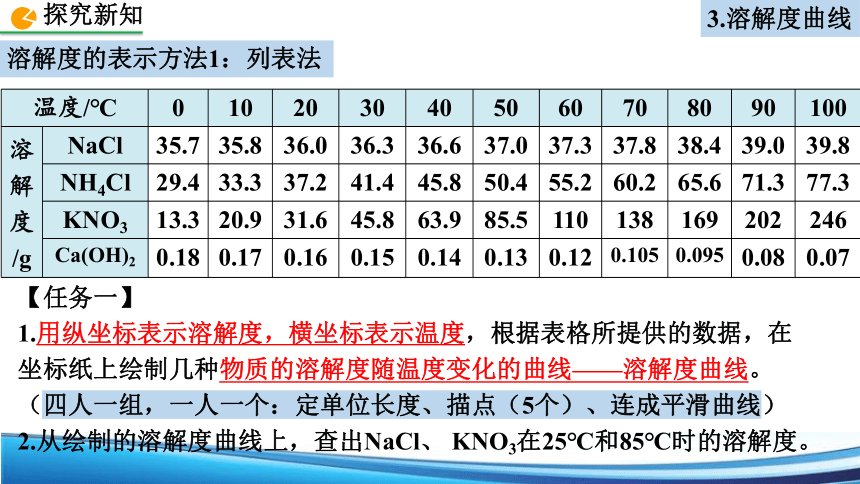
溶解度的表示方法1:列表法
温度/℃
0
10
20
30
40
50
60
70
80
90
100
溶
解
度
/g
NaCl
35.7
35.8
36.0
36.3
36.6
37.0
37.3
37.8
38.4
39.0
39.8
NH4Cl
29.4
33.3
37.2
41.4
45.8
50.4
55.2
60.2
65.6
71.3
77.3
KNO3
13.3
20.9
31.6
45.8
63.9
85.5
110
138
169
202
246
Ca(OH)2
0.18
0.17
0.16
0.15
0.14
0.13
0.12
0.105
0.095
0.08
0.07
【任务一】
1.用纵坐标表示溶解度,横坐标表示温度,根据表格所提供的数据,在坐标纸上绘制几种物质的溶解度随温度变化的曲线——溶解度曲线。(四人一组,一人一个:定单位长度、描点(5个)、连成平滑曲线)
2.从绘制的溶解度曲线上,查出NaCl、 KNO3在25℃和85℃时的溶解度。
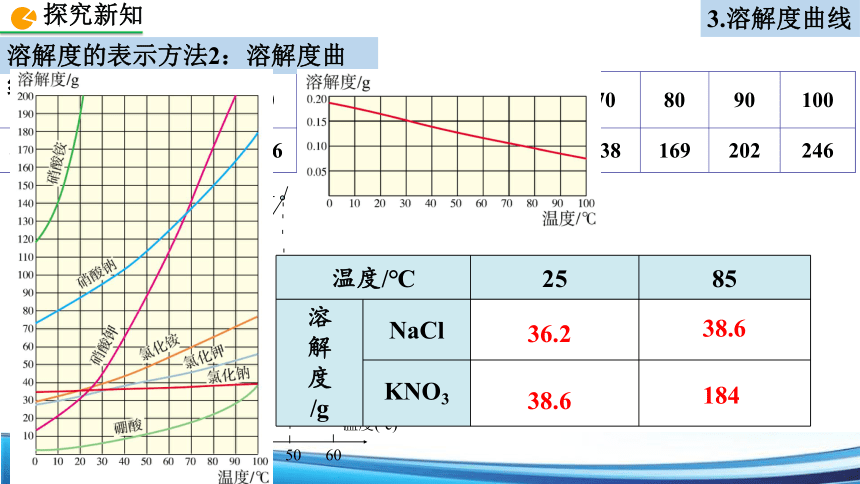
3.溶解度曲线
探究新知
{284E427A-3D55-4303-BF80-6455036E1DE7}温度 (°C)
0
10
20
30
40
50
60
70
80
90
100
硝酸钾
13.3
20.9
31.6
45.8
63.9
85.5
110.0
138
169
202
246
温度(oc)
0 10 20 30 40 50 60
80
70
60
50
40
30
20
10
KNO3
溶解度(克)
溶解度的表示方法2:溶解度曲线
3.溶解度曲线
{5940675A-B579-460E-94D1-54222C63F5DA}温度/℃
25
85
溶
解
度
/g
NaCl
KNO3
36.2
38.6
38.6
184
探究新知
溶解度(克)
200
3.溶解度曲线
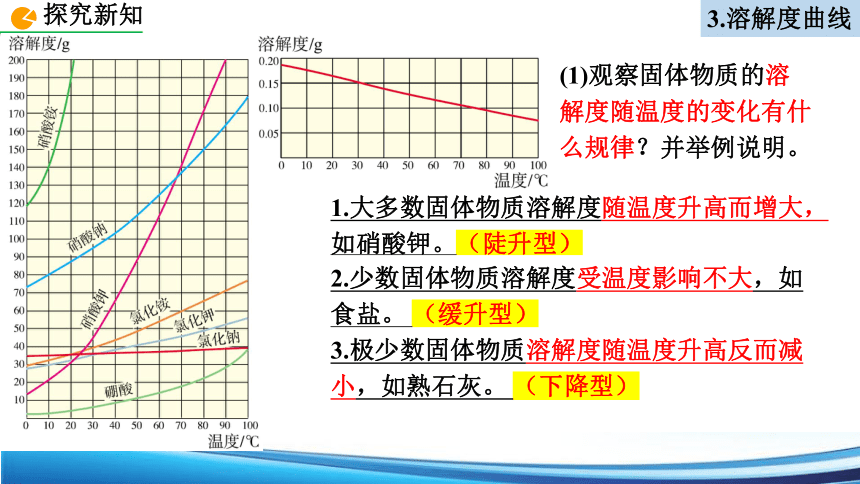
3.根据图9-12和图9-13分析 :
(1)观察固体物质的溶解度随温度的变化有什么规律?并举例说明。
(2)从溶解度曲线中,能获得哪些信息?
(3)溶解度数据表和溶解度曲线都可以表示物质在不同温度时的溶解度,二者有什么区别?
探究新知
溶解度(克)
200
(1)观察固体物质的溶解度随温度的变化有什么规律?并举例说明。
1.大多数固体物质溶解度随温度升高而增大, 如硝酸钾。(陡升型)
2.少数固体物质溶解度受温度影响不大,如食盐。 (缓升型)
3.极少数固体物质溶解度随温度升高反而减小,如熟石灰。 (下降型)
3.溶解度曲线
探究新知
茶卡盐湖里含有丰富的食盐(NaCl)和纯碱(Na2CO3)资源,生活在湖区附近的人们习惯“夏天晒盐,冬天捞碱”。
(提示:Na2CO3的溶解度曲线与KNO3类似)
冬天捞碱
夏天晒盐
“夏天晒盐”是因为食盐的溶解度受温度变化的影响不大,夏天气温高,水分蒸发快,食盐易结晶析出;“冬天捞碱”,是因为纯碱的溶解度受温度变化的影响较大,冬天气温降低,纯碱易结晶析出。
(2)从溶解度曲线中,能获得哪些信息?
3.溶解度曲线
探究新知
3.可以比较不同物质的溶解度受温度变化影响的大小。
2.可以比较不同物质在同一温度时溶解度的大小。
1.可以查出某物质在不同温度时的溶解度。
4.可以看出物质的溶解度随温度变化的规律。
探究新知
{284E427A-3D55-4303-BF80-6455036E1DE7}温度 (°C)
0
10
20
30
40
50
60
70
80
90
100
硝酸钾
13.3
20.9
31.6
45.8
63.9
85.5
110.0
138
169
202
246
温度(oc)
0 10 20 30 40 50 60
80
70
60
50
40
30
20
10
KNO3
溶解度(克)
3.溶解度曲线
(3)溶解度数据表和溶解度曲线都可以表示物质在不同温度时的溶解度,二者有什么区别?
列表法是以实验为基础,数据准确,来源可靠。但任意温度下的溶解度不容易测定,有一定的局限性。
溶解度曲线可以直观地表示溶解度随温度变化的趋势,能查到任意温度下的溶解度。但是数据会有误差。
点
面
线
曲线上的点:物质在该温度时的溶解度
两曲线的交点:在该温度时两物质的溶解度相等
走向:溶解度随温度改变而变化的趋势
陡缓:溶解度受温度影响的大小
曲线下方的点:不饱和溶液
曲线上方的点:过饱和溶液
3.溶解度曲线
探究新知
【任务2】溶解度曲线中:点、线、面的含义。
(1)A点的含义?KNO3的溶解度曲线上各点的含义?B点的含义?
(2)KNO3的溶解度曲线的走向和陡缓各表示什么?
(3)KNO3的溶解度曲线下方和上方的点各表示什么?
.A
.B
.
.
.
.
溶解度/
g
?
?
?
?
?
?
?
?
?
?
200
?
100
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
50
10
20
30
40
0
90
60
70
80
温度/℃
.
硝酸钾
.
.
.
.
在80℃时,将110g硝酸钾加入到100g水中,充分溶解后,形成的溶液为该温度下硝酸钾的______溶液。欲使其刚好形成饱和溶液,可采用的方法有?
增加溶质(59g)
蒸发溶剂
降低温度(至60℃)
若降温到10℃,会怎样?
硝酸钾晶体析出(89g)
21
169
不饱和
59g
89g
学以致用
学以致用
溶解度大小的判断和比较
饱和溶液和不饱和溶液的判断
一定温度下,配制不同物质的饱和溶液时,溶剂质量、溶质质量、溶液质量的大小比较
等质量的饱和溶液,降温后析出晶体质量的比较
溶解度曲线的应用
(1)如图所示,t1 ℃时,三种物质溶解度由大到小的顺序为______________;甲和乙溶解度相等时的温度为________℃。
(2)________(填“能”或“不能”)说甲的溶解度大于乙的溶解度。
(3)由图可知,甲、乙两种物质的溶解度受温度影响较大的是______。
丙>乙>甲
t3
不能
甲
1 .溶解度大小的判断和比较
陡缓
交点
未指明温度
(指明温度)
(1)t1 ℃时,100 g水中溶解________g丙恰好形成饱和溶液。
(2)t3 ℃时,将50 g甲加入到50 g水中,充分溶解,得到的溶液是________(填“饱和”或“不饱和”)溶液,溶液的质量为_____g。将该溶液降温到t2 ℃时可析出晶体________g。
50
饱和
75
2.饱和溶液与不饱和溶液的判断(找S)
12.5
(1)t2 ℃时,分别用等质量水配制甲、乙的饱和溶液,所需溶质的质量关系为__________。
(2)t2 ℃时,分别将等质量甲、乙配制成饱和溶液,所需溶剂的质量关系为________。
(3) t1 ℃时,配制相同质量的甲、乙的饱和溶液,所需溶质的质量关系为___________。所需溶剂的质量关系为___________。
甲<乙
甲>乙
无法判断
3.一定温度下,配制不同物质的饱和溶液时,溶剂质量、溶质质量、溶液质量的大小比较
甲<乙
找????,????(质)????(剂)=????????????????????????????(质)????(????????)=????????+???????????????
?
甲>乙
(5)t4 ℃时,分别用等质量水配制甲、乙、丙的饱和溶液,所需溶质的质量关系为__________。 (6)t4 ℃时,分别将等质量甲、乙、丙配制成饱和溶液,所需溶剂的质量关系为___________。(7)t4 ℃时,配制相同质量的甲、乙、丙的饱和溶液,所需溶剂的质量关系为___________。
(4) t1 ℃时,分别将等质量甲、乙配制成溶液,所需溶剂的质量关系为________。
甲>乙>丙
丙>乙>甲
丙>乙>甲
(1)分别将等质量的甲、乙的饱和溶液由t4 ℃降温到t3 ℃,析出晶体较多的是________。
(2) t3℃时分别将甲乙的饱和溶液恒温蒸发等质量的水,析出晶体的质量关系为_________。
(3)若将t2 ℃时X、Y两种物质的饱和溶液降温到t1 ℃,只有Y析出晶体,则X表示的物质是____(填“甲”或“丙”)。
(4)分别将甲、乙的饱和溶液由t4 ℃降温到t1 ℃,析出晶体较多的是________。
(5)分别将等质量甲、乙的溶液由t4 ℃降温到t1 ℃,析出晶体较多的是________。
甲=乙
丙
无法确定
甲
4.等质量的饱和溶液,降温后析出晶体质量的比较(找S、 ????(质)????(剂)=?????????????????????、 ????(质)????(????????)=????????+?????????????????)
?
1.溶解度曲线越陡,析出晶体越多
2.改变温度使溶解度增大时,无晶体析出
3.比较析出晶体的前提条件:等质量、饱和溶液
无法确定
4.等质量的饱和溶液,降温后析出晶体质量的比较(找S、 ????(质)????(剂)=?????????????????????、 ????(质)????(????????)=????????+?????????????????)
?
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
S
m(aq)
m(质)
m(剂)
t4℃
t3℃
分别将等质量甲、乙的饱和溶液由t4 ℃降温到t3 ℃,完成表格:
甲>乙
甲=乙
甲=乙
甲>乙
甲<乙
甲<乙
甲<乙
甲<乙
????(质)????(????????)=????????+?????????????????
?
m(aq)=m(剂)
+m(质)
m(aq)=m(剂)+m(质)
改变温度,
m(剂)不变
1.如图是甲、乙两种固体物质的溶解度曲线。能使乙的不饱和溶液变成饱和溶液的一种方法是__________________________;相同质量的甲、乙饱和溶液分别从t2 ℃降温到t1 ℃时,析出固体的质量为甲________乙(填“>”、“<”或“=”) 。
加入乙物质(或蒸发溶剂等)
>
丙>乙>甲
析出晶体质量由大到小的顺序为_______________
甲>乙>丙
2.
巩固练习
C
巩固练习
第二课时 溶解度曲线
温故知新
溶解度的概念、四要素
含义: 硝酸钾在60 ℃时的溶解度是110.0g
饱和溶液中的质量关系
影响溶解度的因素
探究新知
溶解度的表示方法1:列表法
温度/℃
0
10
20
30
40
50
60
70
80
90
100
溶
解
度
/g
NaCl
35.7
35.8
36.0
36.3
36.6
37.0
37.3
37.8
38.4
39.0
39.8
NH4Cl
29.4
33.3
37.2
41.4
45.8
50.4
55.2
60.2
65.6
71.3
77.3
KNO3
13.3
20.9
31.6
45.8
63.9
85.5
110
138
169
202
246
Ca(OH)2
0.18
0.17
0.16
0.15
0.14
0.13
0.12
0.105
0.095
0.08
0.07
【任务一】
1.用纵坐标表示溶解度,横坐标表示温度,根据表格所提供的数据,在坐标纸上绘制几种物质的溶解度随温度变化的曲线——溶解度曲线。(四人一组,一人一个:定单位长度、描点(5个)、连成平滑曲线)
2.从绘制的溶解度曲线上,查出NaCl、 KNO3在25℃和85℃时的溶解度。
3.溶解度曲线
探究新知
{284E427A-3D55-4303-BF80-6455036E1DE7}温度 (°C)
0
10
20
30
40
50
60
70
80
90
100
硝酸钾
13.3
20.9
31.6
45.8
63.9
85.5
110.0
138
169
202
246
温度(oc)
0 10 20 30 40 50 60
80
70
60
50
40
30
20
10
KNO3
溶解度(克)
溶解度的表示方法2:溶解度曲线
3.溶解度曲线
{5940675A-B579-460E-94D1-54222C63F5DA}温度/℃
25
85
溶
解
度
/g
NaCl
KNO3
36.2
38.6
38.6
184
探究新知
溶解度(克)
200
3.溶解度曲线
3.根据图9-12和图9-13分析 :
(1)观察固体物质的溶解度随温度的变化有什么规律?并举例说明。
(2)从溶解度曲线中,能获得哪些信息?
(3)溶解度数据表和溶解度曲线都可以表示物质在不同温度时的溶解度,二者有什么区别?
探究新知
溶解度(克)
200
(1)观察固体物质的溶解度随温度的变化有什么规律?并举例说明。
1.大多数固体物质溶解度随温度升高而增大, 如硝酸钾。(陡升型)
2.少数固体物质溶解度受温度影响不大,如食盐。 (缓升型)
3.极少数固体物质溶解度随温度升高反而减小,如熟石灰。 (下降型)
3.溶解度曲线
探究新知
茶卡盐湖里含有丰富的食盐(NaCl)和纯碱(Na2CO3)资源,生活在湖区附近的人们习惯“夏天晒盐,冬天捞碱”。
(提示:Na2CO3的溶解度曲线与KNO3类似)
冬天捞碱
夏天晒盐
“夏天晒盐”是因为食盐的溶解度受温度变化的影响不大,夏天气温高,水分蒸发快,食盐易结晶析出;“冬天捞碱”,是因为纯碱的溶解度受温度变化的影响较大,冬天气温降低,纯碱易结晶析出。
(2)从溶解度曲线中,能获得哪些信息?
3.溶解度曲线
探究新知
3.可以比较不同物质的溶解度受温度变化影响的大小。
2.可以比较不同物质在同一温度时溶解度的大小。
1.可以查出某物质在不同温度时的溶解度。
4.可以看出物质的溶解度随温度变化的规律。
探究新知
{284E427A-3D55-4303-BF80-6455036E1DE7}温度 (°C)
0
10
20
30
40
50
60
70
80
90
100
硝酸钾
13.3
20.9
31.6
45.8
63.9
85.5
110.0
138
169
202
246
温度(oc)
0 10 20 30 40 50 60
80
70
60
50
40
30
20
10
KNO3
溶解度(克)
3.溶解度曲线
(3)溶解度数据表和溶解度曲线都可以表示物质在不同温度时的溶解度,二者有什么区别?
列表法是以实验为基础,数据准确,来源可靠。但任意温度下的溶解度不容易测定,有一定的局限性。
溶解度曲线可以直观地表示溶解度随温度变化的趋势,能查到任意温度下的溶解度。但是数据会有误差。
点
面
线
曲线上的点:物质在该温度时的溶解度
两曲线的交点:在该温度时两物质的溶解度相等
走向:溶解度随温度改变而变化的趋势
陡缓:溶解度受温度影响的大小
曲线下方的点:不饱和溶液
曲线上方的点:过饱和溶液
3.溶解度曲线
探究新知
【任务2】溶解度曲线中:点、线、面的含义。
(1)A点的含义?KNO3的溶解度曲线上各点的含义?B点的含义?
(2)KNO3的溶解度曲线的走向和陡缓各表示什么?
(3)KNO3的溶解度曲线下方和上方的点各表示什么?
.A
.B
.
.
.
.
溶解度/
g
?
?
?
?
?
?
?
?
?
?
200
?
100
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
50
10
20
30
40
0
90
60
70
80
温度/℃
.
硝酸钾
.
.
.
.
在80℃时,将110g硝酸钾加入到100g水中,充分溶解后,形成的溶液为该温度下硝酸钾的______溶液。欲使其刚好形成饱和溶液,可采用的方法有?
增加溶质(59g)
蒸发溶剂
降低温度(至60℃)
若降温到10℃,会怎样?
硝酸钾晶体析出(89g)
21
169
不饱和
59g
89g
学以致用
学以致用
溶解度大小的判断和比较
饱和溶液和不饱和溶液的判断
一定温度下,配制不同物质的饱和溶液时,溶剂质量、溶质质量、溶液质量的大小比较
等质量的饱和溶液,降温后析出晶体质量的比较
溶解度曲线的应用
(1)如图所示,t1 ℃时,三种物质溶解度由大到小的顺序为______________;甲和乙溶解度相等时的温度为________℃。
(2)________(填“能”或“不能”)说甲的溶解度大于乙的溶解度。
(3)由图可知,甲、乙两种物质的溶解度受温度影响较大的是______。
丙>乙>甲
t3
不能
甲
1 .溶解度大小的判断和比较
陡缓
交点
未指明温度
(指明温度)
(1)t1 ℃时,100 g水中溶解________g丙恰好形成饱和溶液。
(2)t3 ℃时,将50 g甲加入到50 g水中,充分溶解,得到的溶液是________(填“饱和”或“不饱和”)溶液,溶液的质量为_____g。将该溶液降温到t2 ℃时可析出晶体________g。
50
饱和
75
2.饱和溶液与不饱和溶液的判断(找S)
12.5
(1)t2 ℃时,分别用等质量水配制甲、乙的饱和溶液,所需溶质的质量关系为__________。
(2)t2 ℃时,分别将等质量甲、乙配制成饱和溶液,所需溶剂的质量关系为________。
(3) t1 ℃时,配制相同质量的甲、乙的饱和溶液,所需溶质的质量关系为___________。所需溶剂的质量关系为___________。
甲<乙
甲>乙
无法判断
3.一定温度下,配制不同物质的饱和溶液时,溶剂质量、溶质质量、溶液质量的大小比较
甲<乙
找????,????(质)????(剂)=????????????????????????????(质)????(????????)=????????+???????????????
?
甲>乙
(5)t4 ℃时,分别用等质量水配制甲、乙、丙的饱和溶液,所需溶质的质量关系为__________。 (6)t4 ℃时,分别将等质量甲、乙、丙配制成饱和溶液,所需溶剂的质量关系为___________。(7)t4 ℃时,配制相同质量的甲、乙、丙的饱和溶液,所需溶剂的质量关系为___________。
(4) t1 ℃时,分别将等质量甲、乙配制成溶液,所需溶剂的质量关系为________。
甲>乙>丙
丙>乙>甲
丙>乙>甲
(1)分别将等质量的甲、乙的饱和溶液由t4 ℃降温到t3 ℃,析出晶体较多的是________。
(2) t3℃时分别将甲乙的饱和溶液恒温蒸发等质量的水,析出晶体的质量关系为_________。
(3)若将t2 ℃时X、Y两种物质的饱和溶液降温到t1 ℃,只有Y析出晶体,则X表示的物质是____(填“甲”或“丙”)。
(4)分别将甲、乙的饱和溶液由t4 ℃降温到t1 ℃,析出晶体较多的是________。
(5)分别将等质量甲、乙的溶液由t4 ℃降温到t1 ℃,析出晶体较多的是________。
甲=乙
丙
无法确定
甲
4.等质量的饱和溶液,降温后析出晶体质量的比较(找S、 ????(质)????(剂)=?????????????????????、 ????(质)????(????????)=????????+?????????????????)
?
1.溶解度曲线越陡,析出晶体越多
2.改变温度使溶解度增大时,无晶体析出
3.比较析出晶体的前提条件:等质量、饱和溶液
无法确定
4.等质量的饱和溶液,降温后析出晶体质量的比较(找S、 ????(质)????(剂)=?????????????????????、 ????(质)????(????????)=????????+?????????????????)
?
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
S
m(aq)
m(质)
m(剂)
t4℃
t3℃
分别将等质量甲、乙的饱和溶液由t4 ℃降温到t3 ℃,完成表格:
甲>乙
甲=乙
甲=乙
甲>乙
甲<乙
甲<乙
甲<乙
甲<乙
????(质)????(????????)=????????+?????????????????
?
m(aq)=m(剂)
+m(质)
m(aq)=m(剂)+m(质)
改变温度,
m(剂)不变
1.如图是甲、乙两种固体物质的溶解度曲线。能使乙的不饱和溶液变成饱和溶液的一种方法是__________________________;相同质量的甲、乙饱和溶液分别从t2 ℃降温到t1 ℃时,析出固体的质量为甲________乙(填“>”、“<”或“=”) 。
加入乙物质(或蒸发溶剂等)
>
丙>乙>甲
析出晶体质量由大到小的顺序为_______________
甲>乙>丙
2.
巩固练习
C
巩固练习
同课章节目录
